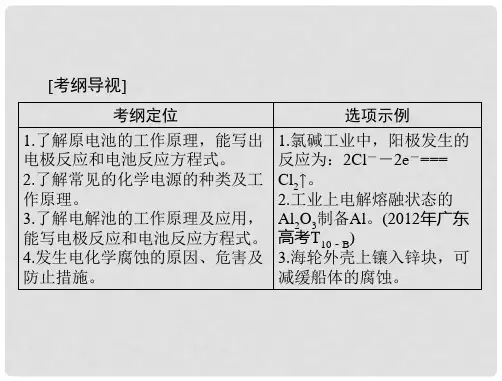
原电池电极反应的书写
(1)
负极: Mg - 2e- = Mg2+
Mg
Al
正极: 2H++ 2e- = H2 ↑
总反应: 2H++ Mg = Mg2++H2 ↑
H2SO4(aq)
Mg
(2)
–- 6e-=2AlO –+4H O
2Al+8OH
负极:
2
2
Al
正极: 6H2O + 6e-=3H2↑+6OH–
通电一段时间后关闭电源,测得溶液的质量减少了
13.4g,下列有关叙述正确的是(NA代表阿伏加德罗
常数的值)( B )
A. 电解过程中流经外电路的电子数目为0.1NA
B. 在标准状况下,两极共产生3.92L气体
C. 电解后溶液的pH为2(假设溶液体积不变)
D. 加入13.8g Ag2CO3可将溶液彻底复原
正极:
O2+2H2O+4e-===4OH-
与电化学有关的定量计算
原电池和电解池的相关计算包括两极产物的定量
计算、溶液pH的计算、根据电量求产物的量与
根据产物的量求电量等的计算。
(1)根据电子守恒法计算:
用于串联电路,阴阳两极产物、正负两极产物等类
型的计算,其依据是电路中转移的电子数相等。
(2)根据总反应式计算:
法拉利常数的相关计算
例4、(2015新课标Ⅱ )维持电流强度为0.5 A,酸性锌
锰电池持续工作5分钟,理论上消耗锌_____________g。
(已知F=96500 C·mol-1)
例5、[2013新课标全国卷Ⅰ,28(5),5分]二甲醚
(CH3OCH3)直接燃料电池具有启动快、效率高等优