硫酸的工业制法
- 格式:doc
- 大小:300.00 KB
- 文档页数:3




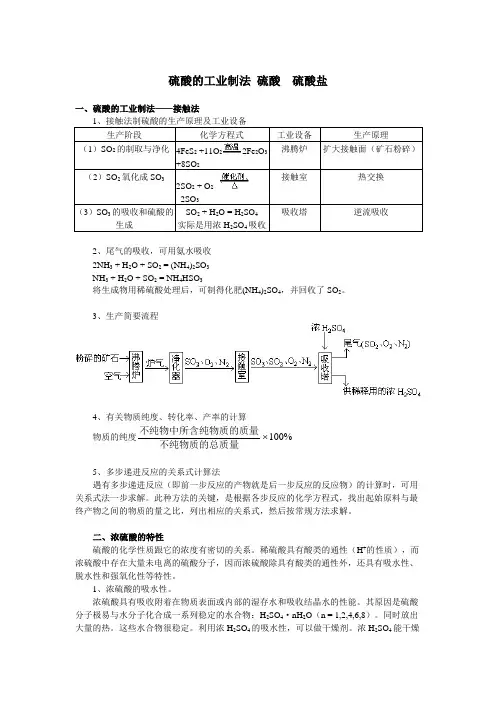
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。


硫酸的工业制法———接触法制硫酸
⑴接触法制硫酸的过程和原理(完成化学方程式):
(1)造气:4FeS2+11O2==2Fe2O3+8SO2(在沸腾炉中进行);
(2)接触氧化:2SO2+O2==2SO3(在接触室中进行);
(3)SO3的吸收:SO3+H2O==H2SO4(在吸收塔中进行)。
量空气。
⑶煅烧黄铁矿制得的炉气中含有SO2、O2、N2、水蒸气及砷、硒等化合物和矿尘,
需要除尘、__洗涤____和干燥,避免催化剂中毒。
条件下进行有利?
①使用催化剂:V2O5
②温度的选择:400℃--500℃
③压强的选择:常压
⑸接触氧化过程,应用了热交换器设备,其优点是预热炉气、冷却反应后生成的气体。
⑹工业上用98%浓硫酸吸收SO3,是因为防止形成酸雾,以便使三氧化硫吸收完全,提高三氧化硫的吸收效率。
⑺硫酸工业“三废”的处理和利用:
①尾气中的SO2,用氨水吸收,可得到氮肥。
反应方程式是SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O。
②污水中含有硫酸,可用石灰乳吸收,反应方程式是Ca(OH)2+H2SO4=CaSO4+2H2O
③废渣的利用。
矿渣一般可用来作为制造水泥的原料或用于制砖
含铁品位高的矿渣,经处理后可以炼铁。
④硫酸生产过程中的三个反应是放热反应。
⑤如果要筹建一间硫酸厂,你认为应该考虑哪些因素?
硫酸厂靠近消费中心比靠近原料产地更为有利
硫酸厂不应建在人口稠密的居民区和环保要求高的地区。
生产过程示意图。

工业制硫酸的工艺流程
《工业制硫酸的工艺流程》
工业制硫酸是一项重要的化工生产过程,其工艺流程包括硫磺燃烧、稀释、吸收、浓缩和结晶等阶段。
以下是一般工业制硫酸的操作步骤:
1. 硫磺燃烧:首先,将硫磺粉末燃烧生成二氧化硫气体。
硫磺燃烧反应的化学方程式是:
S + O2 → SO2
2. 稀释:将二氧化硫气体和空气以一定的比例稀释,以便进行后续的吸收和处理。
3. 吸收:将稀释后的二氧化硫气体通过吸收塔,用稀释的硫酸或氢氧化钠溶液进行吸收,生成硫酸或硫酸钠溶液。
4. 浓缩:通过蒸发器或其它设备,将稀释的硫酸或硫酸钠溶液进行浓缩,得到某一浓度的硫酸或硫酸钠。
5. 结晶:在合适的温度和压力下,通过冷却结晶或者蒸发结晶的方式,使得硫酸或硫酸钠结晶,并进行提纯和干燥处理,得到成品硫酸。
除了上述基本的工艺流程外,工业制硫酸的生产还需要考虑设备的选型和操作参数的控制,以确保生产过程的安全和稳定。
同时,对废气和废水的处理也是工业制硫酸生产中需要重点考
虑的环保问题。
总之,工业制硫酸的工艺流程涉及反应、分离、浓缩和干燥等多个步骤,需要综合考虑原料、能耗、安全和环保等因素,以满足市场的需求和国家的标准。

硫酸工业制法化学方程式硫酸,这玩意儿听着就有点吓人,对吧?可它可是工业界的“明星”,用处大得很!咱们今天就聊聊硫酸的工业制法,顺便说说这背后的化学方程式,嘿,别怕,咱不搞深奥的,咱轻松聊。
硫酸的生产,简单说就是把硫、氧和水搞到一起,经过几道工序,嘿,就能得到硫酸。
这其中的关键就在于硫的燃烧。
想象一下,咱把硫放在高温的环境里,它一碰到氧气,哗啦啦地燃烧起来,产生二氧化硫。
这可不是简单的烟雾,真的是一股浓烈的气体,闻了让人想打喷嚏。
不过,这可不是结束,咱得让这个二氧化硫再跟氧气来一场“约会”,这时就需要一个催化剂,通常是五氧化二磷,嘿,这家伙就像个红娘,把二氧化硫和氧气聚在一起,让它们亲密接触,形成三氧化硫。
哎,三氧化硫来了,这可真是个热心肠的家伙,它特别爱水。
一遇到水,就像干渴的游子见到故乡的河流,立马扑上去,咕噜咕噜地化成硫酸。
这个化学反应,看似简单,但可不是每个地方都能随便搞的,环境和条件得合适,才能顺利出产这位“硫酸大咖”。
如果你听到的硫酸的化学方程式是这样的:( S + O2 → SO2 ),然后再有 ( 2SO2 + O2 → 2SO3 ),最后( SO3 + H2O → H2SO_4 ),这可是一个完整的过程。
怎么样,简单吧?没啥高深的理论,真心简单到没朋友。
工业制硫酸可不止这些表面功夫。
还得考虑到设备的安全和效率,毕竟硫酸可不是善茬,弄不好可真是“无妄之灾”。
在高温高压下,得确保反应器的材质耐得住这火力,不能让它出问题。
想想看,反应器里冒着烟,嘶嘶作响,唉,那可真是个令人头疼的场景。
生产出来的硫酸,纯度高、质量好,才能在市场上站稳脚跟。
像什么肥料、清洁剂、电池液,全靠它的“保驾护航”。
所以,咱们的硫酸在生产过程中的每一个环节,都得小心翼翼,确保没有任何意外。
说到这里,不禁让我想起一句话:“细节决定成败”,在硫酸的世界里,这句话可真是实至名归。
硫酸不仅仅是工业的宠儿,它的化学特性也是让人惊叹的。

工业制硫酸的化学方程式硫酸,也称硫酸盐,是对多种元素的酸性化合物,在化学中占有极重要的地位,能够溶解金属、有机物和非金属物质等。
硫酸的主要产品来自工业制硫酸,其化学方程式如下:2SO2(硫气) + O2(氧气) + 2H2O(水) 2H2SO4(硫酸)工业制硫酸存在多种制硫方式,但最有效的办法仍然是建立在化学反应原理和工艺设计上的。
据此,我们可以把制硫酸分为以下四个步骤:(1)提取原料:首先,要提取并收集原料,尤其是硫气和氧气,是制硫酸的主要原料。
在提取原料时,可采用吸收、蒸汽、真空和低温等技术,以保证硫气和氧气的纯度和活性。
(2)调整温度和压力:在这一步,将上述原料的温度和压力调节到最适宜的制硫条件,以保证反应固定催化剂使硫气,氧气和水彻底发生反应,得到硫酸盐。
(3)吸热:在这一步,需要有充足的吸热,以保证反应能快速而高效地完成,以减少反应时间和有效利用原料。
(4)净化:最后,需要对硫酸盐的净化,以避免因反应产生的有害物质和废物造成污染,满足产品的质量要求。
上述步骤是完整的工业制硫酸的反应过程,被称为硫酸的发酵法。
由于它的简单性、快速反应和易于操作等特点,硫酸的发酵法仍然是工业上制硫酸最常采用的方法。
硫酸是一种重要的化学材料,用于生产多种农药、氨基酸、有机酸、纤维素等产品,它还可以作为分析试剂,用于酸度测定的计算等。
同时,硫酸还广泛用于给水剂及其它水中污染物的处理,是水处理行业最重要的化学添加剂之一。
综上所述,硫酸在工业生产中占有重要地位,相关产品可用于各种应用,而工业制硫酸的化学方程式是其制备的基本原理,具有重要的意义。
任何制硫酸形式的工艺必须建立在上述原理和步骤之上,否则制硫酸将无法得到有效的实施。

硫酸工业制法流程宝子们!今天咱们来唠唠硫酸工业制法的流程呀。
一、原料准备。
咱得先说说原料,制取硫酸的主要原料有硫铁矿,还有硫磺呢。
就像做菜得先准备食材一样,这就是制取硫酸的“食材”。
硫铁矿长啥样呢?它是一种矿石,里面含有很多有用的东西哦。
硫磺呢,相对来说就比较纯净一些,像那种黄色的小颗粒或者块状的东西。
二、硫铁矿的焙烧。
要是用硫铁矿制取硫酸呀,那第一步就是焙烧硫铁矿。
这就好比是把食材放到锅里开始炒啦。
把硫铁矿放到专门的炉子里面,加热到很高的温度。
在这个过程中呢,会发生好多化学反应。
硫铁矿里面的硫化亚铁会和氧气发生反应,生成氧化铁和二氧化硫。
这二氧化硫可重要啦,它是制取硫酸的关键一步。
这个反应可热闹了,就像一场小派对,各种原子啊分子啊在高温下跳来跳去,重新组合。
三、二氧化硫的净化。
从焙烧炉里出来的二氧化硫可不是干干净净就能去制硫酸的哦。
它里面夹杂着好多杂质呢,像灰尘啊、砷的化合物之类的。
这就像咱们买的菜上可能带着泥,得洗干净一样。
要把这些杂质去掉,就需要经过一系列的净化过程。
先让二氧化硫通过除尘装置,把那些灰尘小颗粒都给拦住。
然后再用一些化学方法去除砷等有害物质。
这个过程就像是给二氧化硫做了个大扫除,让它变得干干净净、清清爽爽的。
四、二氧化硫的转化。
净化后的二氧化硫就要开始变身啦。
把它和氧气混合,然后通过一种叫做催化剂的神奇东西。
这个催化剂就像是一个魔法师,在它的作用下,二氧化硫和氧气反应就生成了三氧化硫。
这个反应可没有那么容易哦,得控制好温度、压力还有二氧化硫和氧气的比例这些条件。
就像烤蛋糕,各种配料的比例和烘焙的温度、时间都得刚刚好,蛋糕才能烤得又香又松软。
五、三氧化硫的吸收。
最后一步啦,生成的三氧化硫要被吸收才能变成硫酸。
通常是用浓硫酸来吸收三氧化硫。
三氧化硫一碰到浓硫酸,就像小朋友找到了妈妈一样,立马就结合在一起,形成了发烟硫酸。
然后再经过一些处理,把发烟硫酸变成我们平常使用的硫酸。
这个过程就像是把做好的蛋糕放进盒子里包装好,这样就可以拿出去卖啦,硫酸也就制取完成喽。
硫酸的工业制法硫酸硫酸盐
一、硫酸的工业制法——接触法
1、接触法制硫酸的生产原理及工业设备
生产阶段化学方程式工业设备生产原理
(1)SO2的制取与净化4FeS
2
+11O22Fe2O3
+8SO2
沸腾炉扩大接触面(矿石粉碎)
(2)SO2氧化成SO3
2SO2 + O2
2SO3
接触室热交换
(3)SO3的吸收和硫酸的
生成
SO2 + H2O = H2SO4
实际是用浓H2SO4吸收
吸收塔逆流吸收
2、尾气的吸收,可用氨水吸收
2NH3 + H2O + SO2 = (NH4)2SO3
NH3 + H2O + SO2 = NH4HSO3
将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程
4、有关物质纯度、转化率、产率的计算
物质的纯度不纯物中所含纯物质的质量
不纯物质的总质量
100%
5、多步递进反应的关系式计算法
遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性
硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥
H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
浓硫酸能把纸张、木材、蔗糖等有机物中的氢、氧元素,按水分子里的氢、氧原子个数比(2∶ 1)脱出,使其碳化。
如: C 12H 22O 11 浓
H SO 24−→−−− 12C + 11H 2O 蔗糖
3、浓硫酸的氧化性。
硫酸分子中S 6
+有较强的得电子能力,故浓硫酸有较强的氧化性,加热时其氧化性增强。
(1)与金属的反应:在加热的条件下,绝大部分金属(除Pt 、Au 外)能被浓H 2SO 4氧化到高价态,同时H 2SO 4被还原成SO 2(一般情况下),反应中没有氢气生成。
Cu + 2H 2SO 4 (浓) CuSO 4 + SO 2 ↑ + 2H 2O Hg + 2H 2SO 4 (浓)
HgSO 4 + SO 2 ↑ + 2H 2O
Zn + 2H 2SO 4 (浓) ZnSO 4 + SO 2 ↑ + 2H 2O
(2)常温时浓H 2SO 4使铁、铝钝化。
加热时铁、铝可与浓硫酸剧烈反应。
2Fe + 6H 2SO 4 (浓)
Fe 2 (SO 4)3 + 3SO 2 ↑ + 6H 2O
2Al + 6H 2SO 4 (浓) Al 2(SO 4)3 + 3SO 2 ↑ + 6H 2O (3)与非金属的反应 C + 2H 2SO 4 ( 浓) 2SO 2 ↑ + CO 2 ↑+ 2H 2O S + 2H 2SO 4 (浓)
3SO 2 ↑ + 2H 2O
2P + 5H 2SO 4(浓) 2H 3PO 4 + 5SO 2 ↑ + 2H 2O (4)与具有还原性的化合物反应 H 2S + H 2SO 4 (浓) = S + SO 2 ↑ + 2H 2O
2HBr + H 2SO 4 (浓) = Br 2 ↑ + SO 2 ↑ + 2H 2O 8HI + H 2SO 4(浓) = 4I 2 + H 2S ↑ + 4H 2O
4、浓H 2SO 4氧化性与稀H 2SO 4氧化性的比较
浓H 2SO 4
稀H 2SO 4
硫酸的存在形式
硫酸分子H 2SO 4
H +和SO 42-
起氧化作用的元素 硫酸分子中S 6
+ H + 能够氧化哪些物质 金属、非金属、有还原性的化合物 较活泼的金属(H 前的金属)
还原产物 一般是SO 2 H 2 氧化性强弱
强
弱
5、硫酸的性质与作用的联系。
(1)硫酸的酸性实际上就是硫酸中H +的性质 Zn + H 2SO 4 (稀) = ZnSO 4 + H 2 ↑ CuO + H 2SO 4 = CuSO 4 + H 2O 2NaOH + H 2SO 4 = Na 2SO 4 + H 2O
(2)硫酸可与弱酸盐反应,表现出硫酸的强酸性。
FeS + H 2SO 4 (稀) = FeSO 4 + H 2S ↑
Ca3(PO4)2 + 3H2SO4(浓) 3CaSO4↓ + 2H3PO4
2CH3COONa + H2SO4(浓) = Na2SO4 + 2CH3COOH
(3)硫酸的难挥发性(或称高沸点性)可以用硫酸与易挥发酸的盐反应来制取易挥发的酸,或者说可以用硫酸与低沸点酸的盐反应来制取低沸点的酸。
NaCl (固) + H2SO4 (浓) NaHSO4 + HCl ↑
2NaCl(固) + H2SO4 (浓) Na2SO4 + 2HCl↑
NaNO3(固) + H2SO4 (浓) NaHSO4 + HNO3↑
在这些反应中是硫酸的难挥发性(即高沸点性)与酸性的共同表现。
(4)硫酸的稳定性:硫酸对热的稳定性强,可以用硫酸与不稳定酸的盐反应来制取不稳定酸。
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑
不稳定酸分解后可得到相应的气体。
(5)浓H2SO4的吸水性:在实验室用浓H2SO4做干燥剂;或把少量研细的胆矾放入浓H2SO4中,胆矾会逐渐变为白色。
这些都是浓H2SO4吸水性的表现。
(6)浓H2SO4的脱水性:浓H2SO4使蔗糖、纤维素等碳化,是浓H2SO4脱水性的表现。
(7)浓H2SO4与C、S、H2S、HBr、HI等反应时,只表现出氧化性。
(8)浓H2SO4与Cu、Ag等金属反应,或与NaBr、FeS等还原性化合物反应时,是浓H2SO4的氧化性与酸性的共同体现。
2NaBr + 3H2SO4 (浓) = 2NaHSO4 + Br2↑ + SO2↑ + 2H2O
2FeS + 6H2SO4(浓) = Fe2(SO4)3 + 2S ↓ + 3SO2↑ + 6H2O
三、硫酸根离子的检验
1、所用试剂:BaCl2溶液(或Ba(NO3)2溶液)和稀盐酸。
2、原理:Ba2+与SO42-结合生成的BaSO4,即不溶于水也不溶于稀HCl或稀HNO3。
3、操作方法:取样→加试剂→观察与描述现象→根据现象得出结论。
4、加入试剂的顺序,为了防止溶液中可能存在的Ag+、SO32-、CO32-等离子的干扰,应在待检液中先加入足量稀HCl,若无沉淀和气泡时,再加入BaCl2溶液,此时若出现白色沉淀,则可肯定原试液中必定含有SO42-。
俗名化学式颜色主要用途
生石膏CaSO4·2H2O 白色制水泥、熟石膏
熟石膏2CaSO4·H2O 白色制模型、石膏绷带
皓矾ZnSO4·7H2O 无色收敛剂、防腐剂、媒染剂、制白色颜料重晶石BaSO4白色钡餐
绿矾FeSO4·7H2O 浅绿色制墨水、媒染剂
胆矾CuSO4·5H2O 蓝色农药
明矾KAl(SO4)2·12H2O 无色净水剂
芒硝Na2SO4·7H2O 无色制玻璃原料,造纸工业,缓泻剂。