硫酸的工业制法分析解析
- 格式:ppt
- 大小:1.48 MB
- 文档页数:42


工业硫酸含量的测定分析工业硫酸的含量测定是工业化学分析中常见的一项分析技术。
硫酸是工业生产中广泛使用的一种重要化学品,其含量的准确测定对于生产工艺的控制以及质量的保证至关重要。
本文将介绍工业硫酸含量测定的原理、方法和应用。
一、工业硫酸含量测定的原理酸碱滴定法是通过将标定的酸溶液滴定到含有硫酸的溶液中,利用反应的化学方程式得到硫酸与酸溶液之间的化学反应,进而计算出硫酸的含量。
二、工业硫酸含量测定的方法1.酸碱滴定法步骤如下:(1)将定量的硫酸溶液倒入滴定烧杯中。
(2)配制氢氧化钠或氧化钠溶液。
(3)用滴管将氢氧化钠溶液滴定到硫酸溶液中,直到溶液中的颜色出现明显的变化。
(4)记录滴定的滴数。
(5)根据酸碱滴定反应的化学方程式,计算出硫酸的含量。
2.重量法步骤如下:(1)取一定重量的硫酸样品。
(2)将样品溶解于一定体积的水中,制备一定浓度的硫酸溶液。
(3)将溶液进行物质的加热和蒸发,直至溶液中只剩下硫酸。
(4)将残留的硫酸定量称重。
(5)根据样品的质量和硫酸的质量,计算出硫酸的含量。
3.光度法该方法是利用硫酸与有机染料之间的物质反应。
在一定条件下,将硫酸样品与染料反应后,根据反应物质的吸光度测定硫酸的含量。
三、工业硫酸含量测定的应用1.质量控制:对于生产过程中的硫酸含量进行准确测定可以帮助企业监控生产工艺,确保产品的质量。
2.质量评估:对于供应商提供的硫酸样品进行含量测定,可以评估其产品质量的稳定性和可靠性。
3.质量检测:在产品出厂前,对最终产品中的硫酸含量进行测定,以确保产品满足相关的质量标准和要求。
4.工艺改进:通过对硫酸含量的测定,可以评估和改进生产工艺,提高产品的质量和性能。
综上所述,工业硫酸含量的准确测定对于生产过程的控制、质量的保证以及工艺的改进具有重要意义。
酸碱滴定法、重量法和光度法是常用于工业硫酸含量测定的方法。
这些方法不仅可以满足工业生产的需求,还可以为企业提供准确、可靠的数据支持,从而提高产品质量和市场竞争力。

硫酸的工业制法三个方程式
硫酸是一种重要的化工原料,在工业上有几种制备方法。
其中最常见的三种制法分别为铁硫矿氧化法、硫三氧化二硫催化剂法和硫酸盐矿石法。
首先是铁硫矿氧化法,其化学方程式为,2FeS2 + 7O2 + 2H2O → 2FeSO4 + 2H2SO4。
这个过程中,铁硫矿(黄铁矿)被氧化成硫酸铁和硫酸。
其次是硫三氧化二硫催化剂法,其化学方程式为,2SO2 + O2 → 2SO3。
这个过程中,二氧化硫被氧化成三氧化硫,而后者溶于水形成硫酸。
最后是硫酸盐矿石法,其化学方程式为,CaSO4 + 2C + O2 → 2CO2 + 2CO + 2SO2 + CaS。
这个过程中,硫酸盐矿石(石膏)经过还原反应生成二氧化硫,再经过催化氧化反应生成硫三氧化二硫,最终形成硫酸。
这三种工业制法分别从硫化物、二氧化硫和硫酸盐矿石出发,通过不同的化学反应途径最终制得硫酸。
这些方程式展示了硫酸的
工业制备过程,每个方程式都代表着不同的反应路径和条件。
希望这些信息能够满足你的需求。
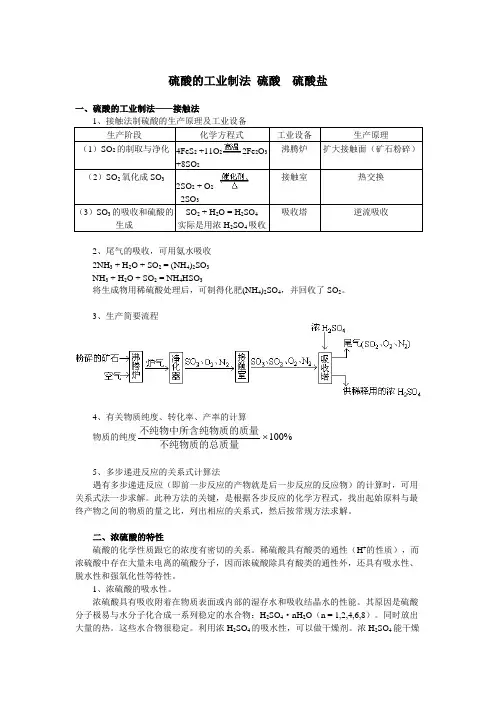
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
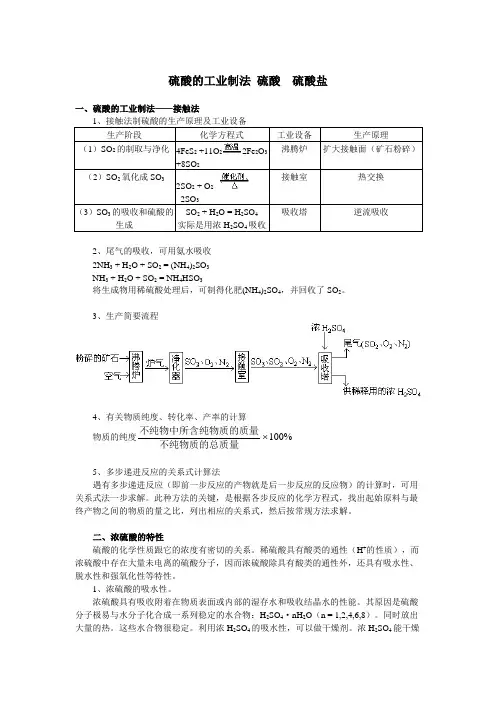
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。

硫酸及硫酸生产原理硫酸(H2SO4)是一种无色透明的液体,常用于许多工业过程中,如肥料制造、化学品生产和石油炼制。
它是世界上最重要的化工原料之一,其生产原理主要包括硫磺氧化法和非金属硫酸铜法。
1.硫磺氧化法硫磺氧化法是最常用的硫酸生产方法之一、硫磺(S)在高温下被气体氧(O2)氧化生成二氧化硫(SO2),然后二氧化硫在催化剂存在下与空气氧反应生成三氧化硫(SO3)。
SO3会与水反应生成硫酸。
硫磺的氧化反应:S+O2→SO2二氧化硫氧化为三氧化硫的反应:2SO2+O2⇌2SO3SO3与水生成硫酸的反应:SO3+H2O→H2SO4这个过程主要分为两个步骤:硫磺的氧化和硫 trioxide(SO3)的水合。
硫磺的氧化通常在燃烧炉中进行,燃烧时需要控制温度和氧气供应。
硫 trioxide的水合需要催化剂的存在,常见的催化剂有氧化铥或五氧化二磷。
2.非金属硫酸铜法非金属硫酸铜法是另一种硫酸的生产方法。
它主要涉及到硫酸铜(CuSO4)的氧化还原反应。
硫酸铜与硫酸反应生成二氧化硫和Cu2+离子,在还原剂的作用下Cu2+离子还原为Cu+离子并生成硫酸。
然后,硫酸被进一步氧化为H2SO4硫酸铜与硫酸反应生成二氧化硫和Cu2+离子的反应:CuSO4+H2SO4⇌SO2+Cu^2++2H2OCu2+离子还原为Cu+离子生成硫酸的反应:Cu^2++H2SO4→Cu++H2SO4硫酸的氧化反应:2H2SO4+O2→2H2O+2SO3这种方法相对于硫磺氧化法来说,生产过程相对简单。
然而,硫酸铜生产通常需要使用更多的能量和化学品,并且产生的二氧化硫是一种环境有害物质。
无论是硫磺氧化法还是非金属硫酸铜法,都需要密切控制反应条件,以获得较高的产率和纯度。
此外,两种方法都需要进行后续的分离和净化步骤,以去除杂质和浓缩硫酸。
总之,硫酸的生产原理主要包括硫磺氧化法和非金属硫酸铜法。
这些方法可以在工业生产中大规模应用,并为许多行业提供关键的化工原料。



硫酸生产流程
硫酸是一种重要的化工原料,在工业生产中具有广泛的应用。
硫酸的生产流程
主要包括硫磺燃烧、吸收制酸和结晶干燥三个主要步骤。
接下来,我将详细介绍硫酸的生产流程。
首先,硫磺燃烧是硫酸生产的第一步。
硫磺燃烧是指将硫磺与空气在燃烧炉内
进行反应,生成二氧化硫气体。
硫磺燃烧的化学方程式为,S + O2 → SO2。
在燃
烧炉内,硫磺经过加热后燃烧,生成二氧化硫气体。
其次,吸收制酸是硫酸生产的第二步。
在这一步骤中,将生成的二氧化硫气体
通过吸收塔进行吸收,与稀硫酸或水溶液反应生成浓硫酸。
吸收塔内通常填充有吸收液,如稀硫酸或水溶液,用于与二氧化硫气体进行接触反应。
化学方程式为,
SO2 + H2O + 1/2O2 → H2SO4。
最后,结晶干燥是硫酸生产的第三步。
在这一步骤中,通过结晶器将浓硫酸进
行结晶,然后进行干燥,得到成品硫酸。
结晶干燥是将浓硫酸在结晶器内冷却结晶,然后通过离心机或真空过滤机进行固液分离,得到硫酸结晶体。
最后,将硫酸结晶体进行干燥处理,得到成品硫酸。
总的来说,硫酸的生产流程由硫磺燃烧、吸收制酸和结晶干燥三个主要步骤组成。
这一生产流程能够高效地生产出优质的硫酸产品,满足工业生产和市场需求。
同时,对于硫酸生产过程中的环保和安全问题也需要引起重视,以确保生产过程安全、环保、高效。

硫酸的工业制法———接触法制硫酸
⑴接触法制硫酸的过程和原理(完成化学方程式):
(1)造气:4FeS2+11O2==2Fe2O3+8SO2(在沸腾炉中进行);
(2)接触氧化:2SO2+O2==2SO3(在接触室中进行);
(3)SO3的吸收:SO3+H2O==H2SO4(在吸收塔中进行)。
量空气。
⑶煅烧黄铁矿制得的炉气中含有SO2、O2、N2、水蒸气及砷、硒等化合物和矿尘,
需要除尘、__洗涤____和干燥,避免催化剂中毒。
条件下进行有利?
①使用催化剂:V2O5
②温度的选择:400℃--500℃
③压强的选择:常压
⑸接触氧化过程,应用了热交换器设备,其优点是预热炉气、冷却反应后生成的气体。
⑹工业上用98%浓硫酸吸收SO3,是因为防止形成酸雾,以便使三氧化硫吸收完全,提高三氧化硫的吸收效率。
⑺硫酸工业“三废”的处理和利用:
①尾气中的SO2,用氨水吸收,可得到氮肥。
反应方程式是SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O。
②污水中含有硫酸,可用石灰乳吸收,反应方程式是Ca(OH)2+H2SO4=CaSO4+2H2O
③废渣的利用。
矿渣一般可用来作为制造水泥的原料或用于制砖
含铁品位高的矿渣,经处理后可以炼铁。
④硫酸生产过程中的三个反应是放热反应。
⑤如果要筹建一间硫酸厂,你认为应该考虑哪些因素?
硫酸厂靠近消费中心比靠近原料产地更为有利
硫酸厂不应建在人口稠密的居民区和环保要求高的地区。
生产过程示意图。

工业制硫酸时二氧化硫和氧气的比例-回复工业制硫酸是一种重要的化学工艺过程,其中二氧化硫(SO2)和氧气(O2)的比例起着关键的作用。
本文将一步一步回答"[工业制硫酸时二氧化硫和氧气的比例]"这个问题,并介绍工业制硫酸的原理、流程以及相关的关键参数。
第一步:理解工业制硫酸的原理工业制硫酸是一种氧化反应,其中二氧化硫与氧气在催化剂的作用下反应生成二氧化硫。
具体反应方程式如下:2SO2 + O2 -> 2SO3这个反应式表明,二氧化硫与氧气的化学计量比是2比1。
也就是说,每两个分子的二氧化硫需要与一个分子的氧气反应生成二氧化硫。
第二步:工业制硫酸的流程工业制硫酸的流程通常包括三个步骤:硫矿石的转化、二氧化硫的制取和二氧化硫氧化为二氧化硫。
硫矿石的转化:硫矿石(如黄铁矿)首先需要被转化成二氧化硫。
这个过程通常通过煅烧硫矿石来完成,产生含有二氧化硫的气体。
二氧化硫的制取:这个步骤涉及将煅烧产生的气体中的二氧化硫分离出来。
常用的方法是通过冷却和凝结,将气体中的二氧化硫液化或固化为硫酸。
二氧化硫氧化为二氧化硫:将前一步骤得到的二氧化硫与氧气混合,并在催化剂的作用下进行氧化反应。
这个步骤的目的是将二氧化硫转化为二氧化硫,产生硫酸。
第三步:确定二氧化硫和氧气的比例在工业制硫酸过程中,确定二氧化硫和氧气的比例是至关重要的。
该比例直接影响制取硫酸的效率和产量。
确定适当的二氧化硫和氧气比例的方法之一是基于反应方程式。
根据反应方程式2SO2 + O2 -> 2SO3,我们可以看出,二氧化硫和氧气的化学计量比为2比1。
这意味着,每两个分子的二氧化硫需要与一个分子的氧气反应生成二氧化硫。
因此,如果希望最大化反应的产量和效率,就需要确保提供足够的氧气来满足二氧化硫的氧化需求。
此外,氧气的供应量还受到催化剂的选择和使用效率的影响。
常用的催化剂包括五氧化二钒(V2O5)和二氧化铯(Cs2O2),它们能够促使二氧化硫和氧气更有效地发生反应。
工业制硫酸的工艺流程
《工业制硫酸的工艺流程》
工业制硫酸是一项重要的化工生产过程,其工艺流程包括硫磺燃烧、稀释、吸收、浓缩和结晶等阶段。
以下是一般工业制硫酸的操作步骤:
1. 硫磺燃烧:首先,将硫磺粉末燃烧生成二氧化硫气体。
硫磺燃烧反应的化学方程式是:
S + O2 → SO2
2. 稀释:将二氧化硫气体和空气以一定的比例稀释,以便进行后续的吸收和处理。
3. 吸收:将稀释后的二氧化硫气体通过吸收塔,用稀释的硫酸或氢氧化钠溶液进行吸收,生成硫酸或硫酸钠溶液。
4. 浓缩:通过蒸发器或其它设备,将稀释的硫酸或硫酸钠溶液进行浓缩,得到某一浓度的硫酸或硫酸钠。
5. 结晶:在合适的温度和压力下,通过冷却结晶或者蒸发结晶的方式,使得硫酸或硫酸钠结晶,并进行提纯和干燥处理,得到成品硫酸。
除了上述基本的工艺流程外,工业制硫酸的生产还需要考虑设备的选型和操作参数的控制,以确保生产过程的安全和稳定。
同时,对废气和废水的处理也是工业制硫酸生产中需要重点考
虑的环保问题。
总之,工业制硫酸的工艺流程涉及反应、分离、浓缩和干燥等多个步骤,需要综合考虑原料、能耗、安全和环保等因素,以满足市场的需求和国家的标准。
工业硫酸制法
工业硫酸制法是一种重要的化学工业生产方法,广泛应用于化工、冶金、电子、纺织、医药等领域。
硫酸是一种重要的化学原料,广泛用于制造肥料、燃料电池、电子元件、纺织品、医药品等。
本文将介绍工业硫酸制法的原理、工艺流程和应用。
工业硫酸制法的原理是利用硫磺或硫化物与空气或氧气在催化剂的作用下反应生成二氧化硫,再将二氧化硫氧化为三氧化硫,最后与水反应生成硫酸。
硫酸制法的反应式为:S + O2 → SO2,2SO2 + O2 → 2SO3,SO3 + H2O → H2SO4。
工业硫酸制法的工艺流程包括硫磺熔炼、燃烧、吸收、浓缩和脱水等步骤。
硫磺熔炼是将硫磺加热至熔点,使其变成液态,以便于后续的燃烧反应。
燃烧是将硫磺与空气或氧气混合燃烧,生成二氧化硫。
吸收是将二氧化硫通过吸收剂(如浓硫酸)吸收,生成硫酸。
浓缩是将稀硫酸通过蒸馏或蒸发等方法浓缩,提高硫酸的浓度。
脱水是将浓硫酸通过蒸馏或干燥等方法脱去水分,得到纯净的硫酸。
工业硫酸制法的应用非常广泛。
硫酸是制造肥料的重要原料,如磷酸二铵、硫酸铵等。
硫酸也是制造燃料电池的重要原料,如聚合物电解质膜等。
此外,硫酸还广泛用于制造电子元件、纺织品、医药品等。
工业硫酸制法是一种重要的化学工业生产方法,其原理简单、工艺
流程清晰、应用广泛。
随着科技的不断发展,硫酸的应用领域将会更加广泛,工业硫酸制法也将会得到更加广泛的应用。