硫酸工业制法
- 格式:ppt
- 大小:2.07 MB
- 文档页数:24




工业制硫酸方案引言工业制硫酸是一种重要的化工工艺,广泛应用于许多工业领域,例如化肥生产、金属冶炼和废水处理等。
本文将介绍一种常见的工业制硫酸方案,包括硫矿的选矿与制酸过程。
硫矿的选矿硫矿的种类硫矿是指含有高浓度硫元素的矿石,常见的硫矿主要有黄铁矿、白铁矿和黄铜矿等。
在工业制硫酸的过程中,选择适合的硫矿对于提高产量和质量至关重要。
选矿工艺硫矿的选矿工艺一般包括破碎、磨矿、浮选等步骤。
首先,将原始硫矿经过破碎和磨矿处理,得到合适的矿石颗粒大小;然后,采用浮选工艺将硫矿与杂质分离,得到富含硫的硫精矿。
制酸过程硫矿的烧结硫精矿通过烧结工艺转化为硫酸。
烧结是将硫精矿加热至一定温度,使硫精矿中的硫元素氧化为二氧化硫气体的过程。
烧结炉是常用的设备,硫矿与空气在炉内进行反应,生成二氧化硫气体。
二氧化硫的净化二氧化硫气体中常含有一定的杂质,如尘埃和氧气等。
这些杂质会影响后续的反应产物质量和设备运行。
因此,需要对二氧化硫气体进行净化处理。
净化二氧化硫气体的常用方法是采用干法洗涤和湿法洗涤。
干法洗涤一般使用碱液吸附气体中的杂质,湿法洗涤则是通过水洗涤将杂质溶解掉。
选择适合的净化方法取决于具体的要求和硫矿的特性。
硫酸的制备经过净化的二氧化硫气体可以进一步用于硫酸的制备。
硫酸通常采用接触法制备,具体步骤如下:1.将净化后的二氧化硫气体经过压缩处理,以提高反应速率和减少空间占用。
2.将压缩后的二氧化硫气体与氧气在催化剂存在下进行反应,生成三氧化硫。
3.三氧化硫与水反应生成硫酸。
硫酸的制备工艺一般较为成熟,而且可以根据需要进行优化或改良,以提高产量和降低能耗。
结论工业制硫酸是一种复杂的化工工艺,涉及到选矿、烧结、气体净化和硫酸制备等多个过程。
这些过程都需要合理的工艺控制和设备支持,以确保硫酸的质量和产量达到预期的要求。
希望本文所介绍的工业制硫酸方案能对相关领域的从业人员提供参考和帮助。


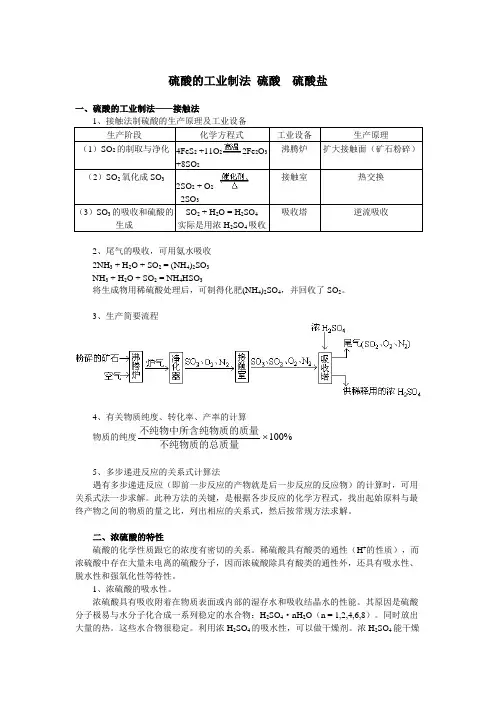
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
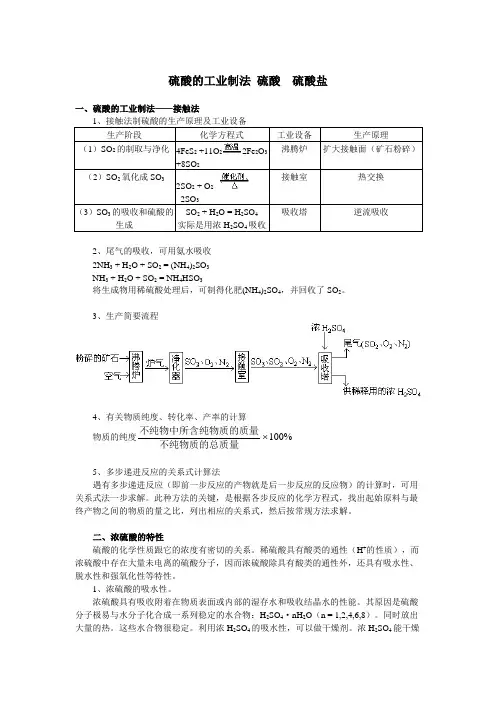
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。



硫酸的工业制法———接触法制硫酸
⑴接触法制硫酸的过程和原理(完成化学方程式):
(1)造气:4FeS2+11O2==2Fe2O3+8SO2(在沸腾炉中进行);
(2)接触氧化:2SO2+O2==2SO3(在接触室中进行);
(3)SO3的吸收:SO3+H2O==H2SO4(在吸收塔中进行)。
量空气。
⑶煅烧黄铁矿制得的炉气中含有SO2、O2、N2、水蒸气及砷、硒等化合物和矿尘,
需要除尘、__洗涤____和干燥,避免催化剂中毒。
条件下进行有利?
①使用催化剂:V2O5
②温度的选择:400℃--500℃
③压强的选择:常压
⑸接触氧化过程,应用了热交换器设备,其优点是预热炉气、冷却反应后生成的气体。
⑹工业上用98%浓硫酸吸收SO3,是因为防止形成酸雾,以便使三氧化硫吸收完全,提高三氧化硫的吸收效率。
⑺硫酸工业“三废”的处理和利用:
①尾气中的SO2,用氨水吸收,可得到氮肥。
反应方程式是SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O。
②污水中含有硫酸,可用石灰乳吸收,反应方程式是Ca(OH)2+H2SO4=CaSO4+2H2O
③废渣的利用。
矿渣一般可用来作为制造水泥的原料或用于制砖
含铁品位高的矿渣,经处理后可以炼铁。
④硫酸生产过程中的三个反应是放热反应。
⑤如果要筹建一间硫酸厂,你认为应该考虑哪些因素?
硫酸厂靠近消费中心比靠近原料产地更为有利
硫酸厂不应建在人口稠密的居民区和环保要求高的地区。
生产过程示意图。
工业制硫酸的工艺流程
《工业制硫酸的工艺流程》
工业制硫酸是一项重要的化工生产过程,其工艺流程包括硫磺燃烧、稀释、吸收、浓缩和结晶等阶段。
以下是一般工业制硫酸的操作步骤:
1. 硫磺燃烧:首先,将硫磺粉末燃烧生成二氧化硫气体。
硫磺燃烧反应的化学方程式是:
S + O2 → SO2
2. 稀释:将二氧化硫气体和空气以一定的比例稀释,以便进行后续的吸收和处理。
3. 吸收:将稀释后的二氧化硫气体通过吸收塔,用稀释的硫酸或氢氧化钠溶液进行吸收,生成硫酸或硫酸钠溶液。
4. 浓缩:通过蒸发器或其它设备,将稀释的硫酸或硫酸钠溶液进行浓缩,得到某一浓度的硫酸或硫酸钠。
5. 结晶:在合适的温度和压力下,通过冷却结晶或者蒸发结晶的方式,使得硫酸或硫酸钠结晶,并进行提纯和干燥处理,得到成品硫酸。
除了上述基本的工艺流程外,工业制硫酸的生产还需要考虑设备的选型和操作参数的控制,以确保生产过程的安全和稳定。
同时,对废气和废水的处理也是工业制硫酸生产中需要重点考
虑的环保问题。
总之,工业制硫酸的工艺流程涉及反应、分离、浓缩和干燥等多个步骤,需要综合考虑原料、能耗、安全和环保等因素,以满足市场的需求和国家的标准。
工业制硫酸的原理硫酸是一种重要的化学品,广泛应用于冶金、化工、制药、纺织等领域。
工业制硫酸的原理是利用硫矿石或硫化物为原料,在高温下氧化生成二氧化硫,再经过催化氧化反应生成三氧化硫,最终与水反应形成硫酸。
本文将详细介绍工业制硫酸的原理及其过程。
一、硫酸的基本概念硫酸是一种无色、无臭、有强酸性的液体,化学式为H2SO4。
它的分子量为98.1,密度为1.84g/cm,沸点为338℃。
硫酸具有很强的腐蚀性,能与大多数金属反应,生成相应的盐和氢气。
硫酸在工业上广泛应用于制造肥料、制药、染料、塑料等化工产品,还用于冶金、纺织、电镀等行业。
二、硫酸的制备方法在工业生产中,硫酸的主要制备方法是接触法。
它的原理是将硫矿石或硫化物作为原料,在高温下氧化生成二氧化硫,再经过催化氧化反应生成三氧化硫,最终与水反应形成硫酸。
1、硫矿石的氧化反应硫矿石是工业上制备硫酸的主要原料之一,主要成分为辉硫矿、黄铁矿、黄铜矿等。
硫矿石的氧化反应式为:S + O2 → SO2在高温下,硫矿石与空气中的氧气反应,生成二氧化硫和少量的三氧化硫。
该反应需要一定的能量,通常采用电炉或焦炉等高温设备进行。
2、三氧化硫的催化氧化反应三氧化硫是硫酸制备的重要中间体,它的制备需要将二氧化硫进一步氧化。
该反应可以在高温下自发进行,但速度较慢,需要引入催化剂来加速反应。
SO2 + 1/2O2 → SO3通常采用铁、钼、钒等金属氧化物作为催化剂,将SO2和O2混合后通过催化剂层,在一定温度和压力下进行反应。
反应产物为三氧化硫,也称硫酸酐。
3、硫酸的水解反应硫酸的制备最后一步是将三氧化硫与水反应生成硫酸。
该反应需要在一定的温度和压力下进行,主要反应式为:SO3 + H2O → H2SO4这个反应是放热反应,需要控制反应温度和压力,以避免反应过程中产生过多的热量和气体。
三、硫酸制备的流程硫酸的制备过程包括硫矿石的氧化、三氧化硫的催化氧化和硫酸的水解三个步骤。