有机化学反应类型总结
- 格式:doc
- 大小:114.28 KB
- 文档页数:5

高中化学十二种有机反应类型本文将介绍高中化学中的十二种有机反应类型。
这些反应类型涵盖了烃、醇、醛、酸、酯等常见有机化合物之间的基本转化。
了解这些反应对于学习有机化学至关重要。
一、烷烃的取代反应烷烃在光照或高温条件下,可以与氯气、溴蒸气等发生取代反应。
例如,甲烷与氯气在光照条件下反应,生成一氯甲烷和氯化氢。
二、烯烃的加成反应烯烃在催化作用下,可以与氢气、卤素等发生加成反应。
例如,乙烯与氢气在催化作用下反应,生成乙烷。
三、炔烃的加成反应炔烃在催化作用下,可以与氢气、卤素等发生加成反应。
例如,乙炔与氢气在催化作用下反应,生成乙烯和氢气。
四、醇的氧化反应醇可以在催化作用下,被氧化成醛或酮。
例如,乙醇在催化作用下被氧化成乙醛。
五、醛的氧化反应醛可以在催化作用下,被氧化成酸。
例如,乙醛在催化作用下被氧化成乙酸。
六、醛的还原反应醛可以在催化作用下,被还原成醇。
例如,乙醛在催化作用下被还原成乙醇。
七、酯的合成反应酯可以通过酸和醇的酯化反应生成。
例如,乙酸和乙醇在浓硫酸和加热条件下反应,生成乙酸乙酯和水。
八、酯的水解反应酯可以在水溶液中,发生水解反应生成酸和醇。
例如,乙酸乙酯在酸性条件下水解生成乙酸和乙醇。
九、酰胺的合成反应酰胺可以通过氨和羧酸或酸酐反应生成。
例如,氨和乙酸在浓硫酸和加热条件下反应,生成乙酸铵(酰胺)。
十、酮的双分子亲核取代反应酮可以在强碱条件下,发生双分子亲核取代反应生成烯烃和卤代烃。
例如,环己酮在强碱条件下反应,生成乙烯酮和卤代烃。
十一、羧酸的氧化反应羧酸可以在氧化剂作用下,被氧化生成过氧化物。
例如,乙酸在氧化剂作用下被氧化成过氧乙酸。
十二、环氧化合物的开环反应环氧化合物可以在酸或碱的作用下,发生开环反应生成醇或醚。
例如,环氧乙烷在酸性条件下开环生成乙醇。
以上是高中化学中常见的十二种有机反应类型。
这些反应为有机化合物之间的转化提供了基础理论依据。
在学习有机化学的过程中,掌握这些基本反应类型对于理解有机化合物的性质和合成具有重要意义。
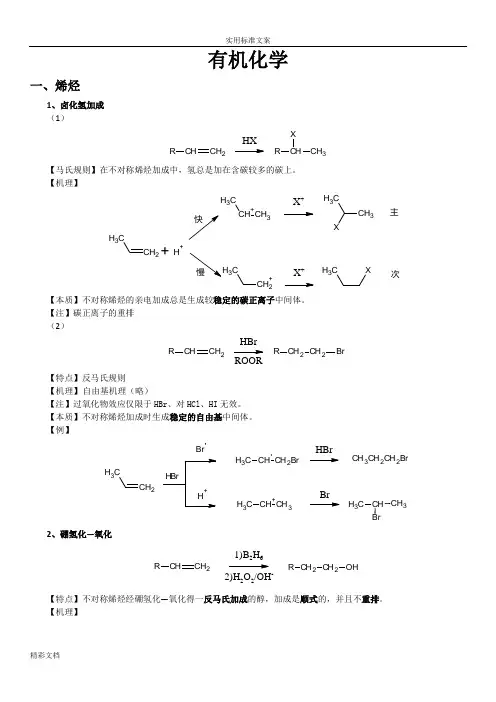
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr/CClC CBrBr【机理】CCC CBrBrCBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。

有机物主要反应类型归纳
有机物的主要反应类型可以归纳如下:
1. 取代反应:取代反应是有机化学中最常见的反应类型之一。
它涉及到一个原子或官能团被其他原子或官能团取代的过程。
例如,卤代烃可以和氢氧化钠反应形成醇,醛或酮可以通过醛缩反应形成酯或胺。
2. 加成反应:加成反应是指两个或多个分子中的原子或官能团结合在一起形成一个新分子的过程。
例如,烯烃可以和溴反应产生溴代烷烃,烯烃可以和水加成生成醇。
3. 消除反应:消除反应是指一个分子中的两个官能团通过消除一个小分子(通常是水、氨等)从而结合在一起形成一个新分子的过程。
例如,醇可以通过脱水反应形成烯烃,醇可以和酸反应形成醚。
4. 缩合反应:缩合反应是指两个或多个分子合成一个较大的分子的过程。
例如,酮或醛可以和胺反应形成Schiff碱,酮或醛可以和醇反应形成醚。
5. 氧化还原反应:氧化还原反应是指有机物中的电子转移过程。
氧化是指失去电子,而还原是指获得电子。
例如,醇可以被氧化为酮或羧酸,醛可以被还原为醇。
这些是有机物主要的反应类型,但并不是全部。
有机化学中还存在许多其他特定的反应类型,如重排反应、环化反应等。

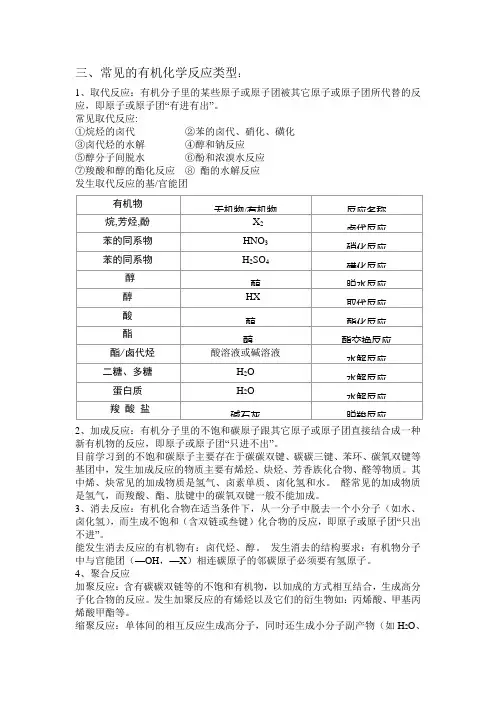
三、常见的有机化学反应类型:1、取代反应:有机分子里的某些原子或原子团被其它原子或原子团所代替的反应,即原子或原子团“有进有出”。
常见取代反应:①烷烃的卤代 ②苯的卤代、硝化、磺化 ③卤代烃的水解 ④醇和钠反应⑤醇分子间脱水 ⑥酚和浓溴水反应 ⑦羧酸和醇的酯化反应 ⑧ 酯的水解反应 发生取代反应的基/官能团2、加成反应:有机分子里的不饱和碳原子跟其它原子或原子团直接结合成一种新有机物的反应,即原子或原子团“只进不出”。
目前学习到的不饱和碳原子主要存在于碳碳双键、碳碳三键、苯环、碳氧双键等基团中,发生加成反应的物质主要有烯烃、炔烃、芳香族化合物、醛等物质。
其中烯、炔常见的加成物质是氢气、卤素单质、卤化氢和水。
醛常见的加成物质是氢气,而羧酸、酯、肽键中的碳氧双键一般不能加成。
3、消去反应:有机化合物在适当条件下,从一分子中脱去一个小分子(如水、卤化氢),而生成不饱和(含双链或叁键)化合物的反应,即原子或原子团“只出不进”。
能发生消去反应的有机物有:卤代烃、醇。
发生消去的结构要求:有机物分子中与官能团(—OH ,—X )相连碳原子的邻碳原子必须要有氢原子。
4、聚合反应加聚反应:含有碳碳双链等的不饱和有机物,以加成的方式相互结合,生成高分子化合物的反应。
发生加聚反应的有烯烃以及它们的衍生物如:丙烯酸、甲基丙烯酸甲酯等。
缩聚反应:单体间的相互反应生成高分子,同时还生成小分子副产物(如H 2O 、有机物无机物/有机物 反应名称 烷,芳烃,酚X 2 卤代反应 苯的同系物HNO 3 硝化反应 苯的同系物H 2SO 4 磺化反应 醇 醇 脱水反应 醇 HX 取代反应 酸 醇 酯化反应 酯醇酯交换反应酯/卤代烃酸溶液或碱溶液水解反应二糖、多糖 H 2O水解反应蛋白质H 2O水解反应羧 酸 盐碱石灰 脱羧反应HX等)的反应。
5、氧化反应:氧化反应就是有机物分子里“加氧”或“去氢”的反应。
有机物的燃烧,烯烃、炔烃、苯的同系物的侧链、醇、醛等可被某些氧化剂所氧化。

重要的有机反应及类型 1.取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫取代反应。
(1)酯化反应:醇、酸(包括有机羧酸和无机含氧酸)(2)水解反应:卤代烃、酯、油脂、糖、蛋白质;水解条件应区分清楚。
如:卤代烃—强碱的水溶液;糖—强酸溶液;酯—无机酸或碱(碱性条件水解反应趋于完全);油脂—无机酸或碱(碱性条件水解反应趋于完全);蛋白质—酸、碱、酶。
C 2H 5Cl+H 2O ∆−−→−NaOH C 2H 5OH+HClCH 3COOC 2H 5+H 2O −−−→−无机酸或碱CH 3COOH+C 2H 5OH (3)硝化反应:苯、苯的同系物、苯酚(4)卤代反应:烷烃、苯,苯的同系物,苯酚、醇、饱和卤代烃等。
特点:每取代一个氢原子,消耗一个卤素分子,同时生成一个卤化氢分子。
2.加成反应:有机物分子里不饱和碳原子与其他原子或原子团直接结合生成新化合物的反应叫加成反应。
如烯烃与卤素、卤化氢或氢气、水的反应;炔烃与卤素、卤化氢或氢气的反应;苯与氢气的反应等。
3.氧化反应(1)与O 2反应①点燃:有机物燃烧的反应都是氧化反应. ②催化氧化:如:醇→醛(属去氢氧化反应);醛→羧酸(属加氧氧化反应)2C 2H 2+5O 2−−−−→−点燃4CO 2+2H 2O 2CH 3CH 2OH+O 2℃网550−−→−Ag 2CH 3CHO+2H 2O 2CH 3CHO+O 2℃~锰盐7565−−→− (2)使酸性高锰酸钾溶液褪色的反应在有机物中如:R —CH=CH 2、R—CCH 、 ROH (醇羟基)、R—CHO 、苯的同系物等都能使酸性高锰酸钾溶液褪色,发生的反应都属氧化反应。
(3)银镜反应和使Cu(OH)2转变成Cu 2O 的反应实质上都是有机物分子中的醛基(-CHO )加氧转变为羧基(—COOH )的反应.因此凡是含有醛基的物质均可发生上述反应(碱性条件).例如:含醛基的物质:醛、甲酸(HCOOH )、甲酸酯(HCOOR )、甲酸盐、葡萄糖、麦芽糖 。
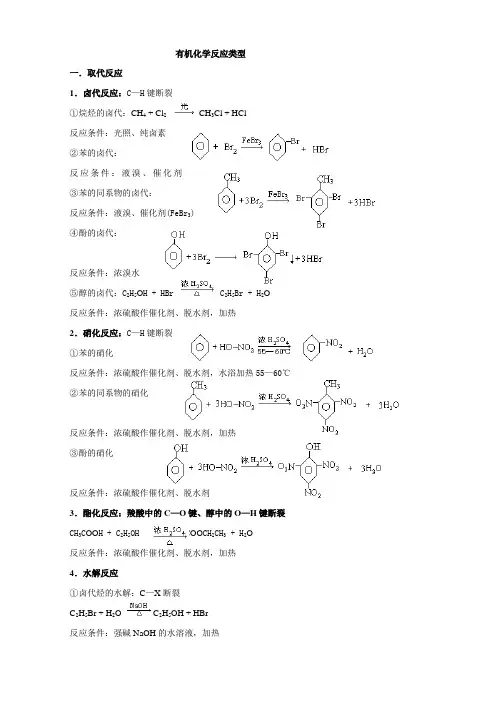
有机化学反应类型一.取代反应1.卤代反应:C—H键断裂①烷烃的卤代:CH4 + Cl2CH3Cl + HCl反应条件:光照、纯卤素②苯的卤代:反应条件:液溴、催化剂(FeBr3) ③苯的同系物的卤代:反应条件:液溴、催化剂(FeBr3)④酚的卤代:反应条件:浓溴水⑤醇的卤代:C2H5O H + HBr C2H5Br + H2O反应条件:浓硫酸作催化剂、脱水剂,加热2.硝化反应:C—H键断裂①苯的硝化反应条件:浓硫酸作催化剂、脱水剂,水浴加热55—60℃②苯的同系物的硝化反应条件:浓硫酸作催化剂、脱水剂,加热③酚的硝化反应条件:浓硫酸作催化剂、脱水剂3.酯化反应:羧酸中的C—O键、醇中的O—H键断裂CH3C OO H + C2H5OH CH3C OO CH2CH3 + H2O反应条件:浓硫酸作催化剂、脱水剂,加热4.水解反应①卤代烃的水解:C—X断裂C2H5Br + H2O C2H5OH + HBr反应条件:强碱NaOH的水溶液,加热②酯的水解:C—O键断裂反应条件:稀硫酸作催化剂,水浴加热70—80℃③蛋白质的水解:酰氨键中C—N键断裂5.醇与醇分子间脱水:醇分子中的的C—O键与另一醇分子中与羟基相连碳原子上的C—H键发生断裂2 CH3CH2OH CH3CH2OCH2CH3 + H2O反应条件:浓硫酸作催化剂、脱水剂,加热140℃6.置换反应:①醇的置换反应:O—H键断裂2 CH3CH2OH + 2 Na →2CH3CH2ONa + H2↑反应条件:活泼金属(K、Ca、Na、Mg、Al、Li等)②酚的置换反应:O—H键断裂反应条件:活泼金属(K、Ca、Na、Mg、Al、Li等),熔化的苯酚③羧酸的置换反应:O—H键断裂2CH3COOH + Zn →(CH3COO)2Zn + H2↑反应条件:氢以前的活泼金属7.羧酸盐的脱羧反应:C—C键断裂(了解)CH3C OO Na + Na O H CH4↑+ Na2CO3反应条件:羧酸盐无水,加热8.复分解反应:C—H键断裂①中和反应:R COOH + NaOH → R COONa + H2O②羧基的检验:R COOH + NaHCO3→ R COONa + H2O + CO2↑二.加成反应1.烯烃的加成反应:断裂中的一个键①与水的加成:CH2=CH2 + H2O CH3CH2OH②与卤素的加成:CH2=CH2 + Br2 →CH2BrCH2Br③与卤代烃的加成:CH2=CH2 + HCl CH3CH2Cl④与氢气的加成:CH2=CH2 + H2CH3CH32.炔烃:断裂中的一个键或二个键①与水的加成:②与卤素的加成:③与卤代烃的加成:④与氢气的加成:3.苯及苯的同系物的加成:断裂苯环上的特殊化学键4.醛的加成:断裂碳氧双键中的一个键三.消去反应:1.醇的消去反应:羟基与碳相连的C—O键及与羟基所在碳原子相邻的碳上的C—H键断裂CH3CH2OH CH2==CH2↑+ H2O反应条件:浓硫酸作催化剂、脱水剂,加热170℃2.卤代烃的消去反应:卤代烃C—X键及与卤素原子所在碳原子相邻的碳上的C—H键断裂CHCH2Cl + NaOH CH2==CH2↑+ NaCl + H2O反应条件:强碱NaOH的醇溶液,加热四.氧化反应:1.剧烈氧化(有机物的燃烧):断裂分子中所有化学键CH3CH2OH + 3O22CO2 +3 H2O2.控制氧化①醇的催化氧化:醇羟基上的C—H键及与羟基所在碳原子相邻的碳上的C—H键断裂2 CH3CH2OH + O22CH3CHO + H2O②醛的催化氧化:断裂醛基上的C—H键2R—CHO + O2RCOO H③醛的银镜反应:断裂醛基上的C—H键R—CHO + 2Ag(NH3)2OH RCOONH4 + 3NH3 +2Ag↓+H2O反应条件:现配的银氨溶液,水浴加热④醛与新制的Cu(OH)2反应:断裂醛基上的C—H键R—CHO +2Cu(O H)2 RCOOH + Cu2O↓+ 2H2O反应条件:新配的Cu(O H)2悬浊液,加热⑤苯的同系物与酸性KMnO4反应:断裂苯环侧链上的C—H、C—C键五、聚合反应:1.加聚反应:断裂中的一个键断裂①烯烃的加聚:②卤烯烃的加聚:③不饱和羧酸的加聚:六、分解与裂化、裂解(了解)1.分解反应①甲烷的分解:断裂C—H键反应条件:隔绝空气,加热到1000—1500℃2.裂化与裂解:C—C键断裂CH3CH2 CH2CH3 C2H4 + C2H6七、颜色反应酚遇Fe3+显蓝色:酚羟基上的O—H键断裂。

化学有机反应类型总结有机化学是研究有机物质的结构、性质和反应的科学。
有机反应是有机化学的重要组成部分,是指有机物质之间或有机物质与其他物质之间发生的化学变化。
有机反应类型繁多,下面我们将对常见的有机反应类型进行总结。
1. 取代反应取代反应是指有机物中的一个官能团被另一个官能团所取代的反应。
常见的取代反应有卤代烃的取代反应、醇的取代反应、酸的取代反应等。
取代反应的机理一般是通过亲核试剂或电子受体试剂的作用,使原有官能团离去,再由新的试剂与空位上的碳原子形成新的官能团。
2. 加成反应加成反应是指两个或多个分子中的双键或三键被破裂,形成新的单键或双键的反应。
常见的加成反应有烯烃的加成反应、芳香族化合物的加成反应等。
加成反应的机理是通过亲电试剂或自由基试剂的作用,使原有的双键或三键断裂,再由新的试剂与空位上的碳原子形成新的单键或双键。
3. 消除反应消除反应是指有机物中的两个官能团之间的原子或原子团被消除,形成双键或三键的反应。
常见的消除反应有醇的消除反应、卤代烃的消除反应等。
消除反应的机理是通过碱性试剂或热作用,使原有官能团中的原子或原子团离去,再由空位上的碳原子形成新的双键或三键。
4. 氧化还原反应氧化还原反应是指有机物中的氧化剂和还原剂之间的电子转移反应。
常见的氧化还原反应有醇的氧化反应、醛的还原反应等。
氧化还原反应的机理是通过氧化剂或还原剂的作用,使电子从一个分子转移到另一个分子,形成氧化物或还原物。
5. 缩合反应缩合反应是指两个或多个分子中的官能团之间形成新的化学键的反应。
常见的缩合反应有醛的缩合反应、胺的缩合反应等。
缩合反应的机理是通过亲核试剂或电子受体试剂的作用,使原有官能团之间形成新的化学键。
有机反应类型繁多,每种反应都有其独特的机理和应用场景。
在实际应用中,我们需要根据不同的反应类型和反应条件,选择合适的试剂和反应条件,以达到预期的反应目的。



有机化学反应类型1、取代反应指有机物分子中的某些原子或原子团被其他原子或原子团取代的反应。
常见的取代反应:⑴烃(主要是烷烃和芳香烃)的卤代反应;⑵芳香烃的硝化反应;⑶醇与氢卤酸的反应、醇的羟基氢原子被置换的反应;⑷酯类(包括油脂)的水解反应;⑸酸酐、糖类、蛋白质的水解反应。
2、加成反应指试剂与不饱和化合物分子结合使不饱和化合物的不饱和程度降低或生成饱和化合物的反应。
常见的加成反应:⑴烯烃、炔烃、芳香族化合物、醛、酮等物质都能与氢气发生加成反应(也叫加氢反应、氢化或还原反应);⑵烯烃、炔烃、芳香族化合物与卤素的加成反应;⑶烯烃、炔烃与水、卤化氢等的加成反应。
3、聚合反应指由相对分子质量小的小分子互相结合成相对分子质量大的高分子的反应。
参加聚合反应的小分子叫作单体,聚合后生成的大分子叫作聚合物。
常见的聚合反应:加聚反应:指由不饱和的相对分子质量小的小分子结合成相对分子质量大的高分子的反应。
较常见的加聚反应: ①单烯烃的加聚反应 在方程式中,—CH 2—CH 2—叫作链节, 中n 叫作聚合度,CH 2=CH 2叫作单体, 叫作加聚物(或高聚物)②二烯烃的加聚反应 4、氧化和还原反应(1)氧化反应:有机物分子中加氧或去氢的反应均为氧化反应。
常见的氧化反应: ①有机物使酸性高锰酸钾溶液褪色的反应。
如:R —CH=CH —R ′、R —C ≡C —R ′、 (具有α—H)、—OH 、R —CHO 能使酸性高锰酸钾溶液褪色。
②醇的催化氧化(脱氢)反应醛的氧化反应 ③醛的银镜反应、费林反应(凡是分子中含有醛基或相当于醛基的结构,都可以发生此类反应) (2)还原反应:有机物分子中去氧或加氢的反应均为还原反应。
n CH 2=CH 2 n CH 2—CH 2催化剂 n CH 2—CH 2 n CH 2—CH 2 n CH 2=C —CH=CH 2CH 3 CH 2—C=CH —CH 2 CH 3 n 催化剂 —R 2RCH 2OH + O 22RCHO + 2H 2O △ Cu 或Ag 2R —CH —R ′+ O 22R —C —R ′+ 2H 2OOH O △ Cu 或Ag 2RCHO + O 22RCOOH 催化。
有机化学中反应的主要类型有机反应的基本类型:取代反应、加成反应、消去反应、聚合反应(分加聚与缩聚)、氧化反应与还原反应、酯化反应、水解反应、中和反应及其它反应1、取代反应:概念:有机物分子里某些原子或原子团被其它原子或原子团所代替的反应。
能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)。
2、加成反应:能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)。
加成反应有两个特点:①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
②加成反应后生成物只有一种(不同于取代反应,还会有卤化氢生成)。
3、消去反应:概念:有机物在适当的条件下,从一个分子中脱去一个小分子(如水、HX等),生成不饱和(双键或三键)化合物的反应。
如:实验室制乙烯。
能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。
3.反应机理:相邻消去3、聚合反应:聚合反应是指小分子互相作用生成高分子的反应。
聚合反应包括加聚和缩聚反应。
加聚反应:由不饱和的单体加成聚合成高分子化合物的反应。
反应是通过单体的自聚或共聚完成的。
能发生加聚反应的官能团是:碳碳双键.加聚反应的实质是:加成反应。
加聚反应的反应机理是:碳碳双键断裂后,小分子彼此拉起手来,形成高分子化合物。
缩聚反应:有机物单体间通过失去水分子或其它小分子形成高分子化合物的反应叫缩聚反应。
该类反应的单体一般具有两个或两个以上的官能团。
如酚醛树脂、氨基酸形成蛋白质等。
5、氧化反应与还原反应:氧化反应就是有机物分子里“加氧”或“去氢”的反应。
能发生氧化反应的物质和官能团:烯(碳碳双键)、炔(碳碳三键)、醇、酚、苯的同系物、含醛基的物质等。
还原反应是有机物分子里“加氢”或“去氧”的反应,其中加氢反应又属加成反应。
还原反应具体有:与氢气的加成、硝基苯的还原。
有机化学反应类型归纳
1.取代反应
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
(1)卤代:
(2)硝化:
(3)磺化:
(4)卤代烃水解:
2.加成反应
有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
(1)加H2:
(2)加H2O:
(3)加X2
3.加成聚合(加聚)反应
不饱和的单体聚合成高分子的反应。
(1)乙烯加聚:
(2)丙烯加聚:
(3)合成顺丁橡胶:
(4)乙炔聚合成苯:
4.缩合聚合(缩聚)反应
单体间相互反应而生成高分子,同时还生成小分子(如水、氨、氯化氢等)的反应(又叫逐步聚合反应)。
制酚醛树脂
5.消去反应
从一个分子脱去一个小分子(如水、卤化氢),因而生成不饱和化合物的反应
6.氧化还原反应
有机物得氧或去氢称为氧化反应;反之加氢或去氧的反应称为还原反应。
例:
7.酯化反应
酸和醇起作用生成酯和水的反应。
8.水解反应
化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、酰胺、糖等):
9.脱水反应
有机物分子脱去相当于水的组成的反应。
10.裂化反应
在一定条件下,把相对分子质量大、沸点高的长链烃,断裂为相对分子质量小、沸点低的短链烃的反应。
11.增链反应
卤代烃与金属钠作用,使碳链增长的反应。
有机化学六大反应类型
有机化学是研究碳及其化合物的化学性质和反应的学科,其中包括了许多反应类型。
本文将介绍有机化学中的六大反应类型。
1. 取代反应
取代反应是有机化学中最基本的反应之一。
它是指一个原子或基团被另一个原子或基团取代的过程。
这个反应类型最常见的例子是卤代烃与碱性物质发生氢氧化反应。
2. 加成反应
加成反应是指两个或更多的单体通过化学键的形成而形成一个更大的分子。
常见的加成反应包括烯烃与卤代烃的反应以及炔烃的加成反应。
这些反应通常需要催化剂。
3. 消除反应
消除反应是一种有机反应,其中一个分子中的两个官能团被移除来生成一个双键。
消除反应的例子包括烯烃生成,炔烃生成等。
4. 氧化还原反应
氧化还原反应是指化合物中原子氧化态的变化。
当一个分子失去电子时,它被氧化,而当一个分子获得电子时,它被还原。
氧化还原反应在许多有机化合物的合成和分解中都扮演着重要的角色。
5. 重排反应
重排反应是指一个分子内部的原子或官能团重新排列形成不同的化学结构。
常见的重排反应包括烷基重排反应和环重排反应等。
6. 光化学反应
光化学反应是指通过光的作用产生的化学反应。
这些反应可以通过紫外线或可见光来激发。
其中最常见的反应是光解反应,其中一个分子被光分解成两个或更多的分子。
以上是有机化学中的六大反应类型,它们对于化学合成和反应机理的研究都有重要的意义。
有机化学的十大基本反应类型有机化学是研究含有碳元素的化合物的科学。
它是化学的分支学科,主要研究分子和化学反应。
在有机化学中,有许多类型的化学反应。
这些反应被组织成十个基本类型,这十个基本反应类型是:1. 取代反应取代反应是一种常见的有机化学反应类型。
它是指一个原子或一个功能基团被另一个原子或功能基团取代的过程。
这种反应可以在芳香族化合物和非芳香族化合物中发生。
代表性的反应有卤代烷与氢氧化钠反应,酰氯与醇反应,也有烯烃的卤化反应等。
2. 加成反应加成反应是一种将两个分子合成为一个分子的反应。
在这种类型的反应中,通常需要一个碳-碳或碳-氢双键和一个特殊的试剂。
代表性的反应有烯烃与溴反应,芳香烃与氢气反应等。
3. 消除反应4. 氧化还原反应氧化还原反应是一种电子转移的反应。
在有机化学中,这种类型的反应可以改变有机分子的氧化状态。
代表性的反应有醇的氧化反应,醛的还原反应等。
5. 酸碱反应6. 分解反应分解反应是指一个化合物分解成两个或更多的产物。
这种类型的反应可发生在有机分子的单个原子或部分上,例如C-C键的断裂等。
代表性的反应有乙酸乙酯的水解反应,酮类的酸催化分解反应等。
7. 缩合反应8. 重排反应9. 反应机理反应机理是指化学反应中化学物质之间相互作用的顺序及机理。
涉及的化学过程有两种:中间体和过渡态。
中间体是一个反应中的可观察到的中间化合物,过渡态是位于反应物之间的不稳定化合物。
反应机理对于我们理解反应过程的细节至关重要,也是有机化学研究的重点。
10. 重要化合物和反应最后一种类型的反应是有机化合物和反应的总结。
这是有机化学中最重要的一组反应类型,包含了所有其他反应的总结。
在这些化合物和反应中,含有许多常见的有机物,如醇、酯、醛、酮、芳香化合物等。
有机化学四大反应类型有机化学四大反应类型是有机化学中最基本且重要的四种反应类型,分别是取代反应、消除反应、加成反应和重排反应。
本文将详细介绍这四种反应类型的定义、机理和应用。
一、取代反应取代反应是指一个原子、基团或官能团被另一个原子、基团或官能团所取代的反应。
这种反应常见于醇、酸、醛、酮等有机化合物中,通常涉及到亲核试剂和电子受体之间的反应。
取代反应的机理可以分为亲核取代和电子受体取代两种。
亲核取代反应中,亲核试剂攻击电子亏损的反应物,形成碳正离子中间体,并最终生成新的化合物。
常见的亲核试剂有氢氧根离子、卤素离子、氨基离子等。
电子受体取代反应中,电子富集的反应物攻击亲电子试剂,形成碳负离子中间体,并最终生成新的化合物。
常见的亲电子试剂有卤代烃、烯烃、芳香族化合物等。
二、消除反应消除反应是指有机化合物中发生键的断裂,生成双键或三键的过程。
消除反应通常涉及到酸碱催化剂和高温条件。
消除反应的机理可以分为β消除和α消除两种。
β消除反应中,发生消除的反应物中的β碳和邻位原子之间的键被断裂,生成双键。
β消除反应常见于醇、酮、酯等化合物中。
α消除反应中,发生消除的反应物中的α碳和邻位原子之间的键被断裂,生成双键或三键。
α消除反应常见于醇、酸、醛等化合物中。
三、加成反应加成反应是指两个或多个反应物中的原子或基团结合在一起,生成一个新的化合物。
加成反应通常涉及到亲电试剂和亲核试剂之间的反应。
加成反应的机理可以分为亲电加成和亲核加成两种。
亲电加成反应中,亲电试剂攻击亲核试剂,生成一个带正电荷的中间体,并最终生成新的化合物。
常见的亲电试剂有卤代烃、烯烃、芳香族化合物等;常见的亲核试剂有氢氧根离子、卤素离子、氨基离子等。
亲核加成反应中,亲核试剂攻击亲电试剂,生成一个带负电荷的中间体,并最终生成新的化合物。
常见的亲电试剂有卤代烃、酰卤、酸酐等;常见的亲核试剂有氢氧根离子、氨基离子、醇等。
四、重排反应重排反应是指有机化合物中的原子或基团在分子内或分子间发生位置变化的反应。
有机化学反应类型总结
1、取代反应
定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。
(1)能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)等。
(2)能发生取代反应的有机物种类如下图所示:
2、加成反应
定义:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合,生成别的物质的反应,叫加成反应。
分子结构中含有双键或三键的化合物,一般能与H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子物质起加成反应。
1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。
2.加成反应有两个特点:
①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
②加成反应后生成物只有一种(不同于取代反应)。
说明:
1.羧基和酯基中的碳氧双键不能发生加成反应。
2.醛、酮的羰基只能与H2发生加成反应。
3.共轭二烯有两种不同的加成形式。
3、消去反应
定义:有机化合物在适当条件下,从一个分子相邻两个碳原子上脱去一个小分子(如H2O、HX等)而生成不饱和(双键或三键)化合物的反应称为消去反应。
发生消去反应的化合物需具备以下两个条件:
(1)是连有—OH(或—X)的碳原子有相邻的碳原子。
(2)是该相邻的碳原子上还必须连有H原子。
(1)能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。
(2)反应机理:相邻消去
发生消去反应,必须是与羟基或卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。
如CH3OH,没有邻位碳原子,不能发生消去反应。
4、聚合反应
定义:有许多单个分子互相结合生成高分子化合物的反应叫聚合反应。
聚合反应有两个基本类型:加聚反应和缩聚反应
(1)加聚反应:
由许多单个分子互相加成,又不缩掉其它小分子的聚合反应称为加成聚合反应。
烯烃、二烯烃及含C=C的物质均能发生加聚反应。
烯烃加聚的基本规律:
(2)缩聚反应:
单体间相互结合生成高分子化合物的同时,还生成小分子物质的聚合反应,称为缩合聚合反应。
酚和醛、氨基酸(形成多肽)、葡萄糖(形成多糖)、二元醇与二元酸、羟基羟酸等均能发生缩聚反应。
(1)二元羧酸和二元醇的缩聚,如合成聚酯纤维:
(2)醇酸的酯化缩聚:
(3)氨基与羧基的缩聚
(1)氨基酸的缩聚,如合成聚酰胺6:
(2)二元羧酸和二元胺的缩聚:
nHOOC-(CH2)4-COOH+nNH2(CH2)6NH2
=[CO(CH2)4CONH(CH2)6NH]n+2nH2O
5、氧化反应与还原反应
1.氧化反应就是有机物分子里“加氧”或“去氢”的反应。
能发生氧化反应的物质和官能团:烯(碳碳双键)、醇、酚、苯的同系物、含醛基的物质等。
官能团与有机物类别、性质的关系
有机合成推断技巧
(1)合成原则:原料价廉,原理正确,途径简便,便于操作,条件适宜,易于分离。
(2)思路:将原料与产物的结构进行对比,一比碳干的变化,二比官能团的差异。
①根据合成过程的反应类型,所带官能团性质及题干中所给的有关知识和信息,审题分析,理顺基本途径。
②根据所给原料,反应规律,官能团引入、转换等特点找出突破点。
③综合分析,寻找并设计最佳方案。
(3)方法指导:找解题的“突破口”的一般方法是:
a、找已知条件最多的地方,信息量最大的;
b、寻找最特殊的——特殊物质、特殊的反应条件、特殊颜色等等;
c.特殊的分子式,这种分子式只能有一种结构;
d.如果不能直接推断某物质,可以假设几种可能,认真小心去论证,看是否完全符合题意。
(4)应具备的基本知识:
①官能团的引入:
引入卤原子(烯、炔的加成,烷、苯及其同系物,醇的取代等);
引入双键(醇、卤代烃的消去,炔的不完全加成等);
引入羟基(烯加水,醛、酮加H2,醛的氧化,酯水解,卤代烃水解,糖分解为乙醇和CO2等);
生成醛、酮(烯的催化氧化,醇的催化氧化等)
②碳链的改变:
增长碳链(酯化、炔、烯加HCN,聚合,肽键的生成等);
减少碳链(酯水解、裂化、裂解、脱羧,烯催化氧化,肽键水解等)
③成环反应(不饱和烃小分子加成——三分子乙炔生成苯;酯化、分子间脱水,缩合、聚合等)。