酶的作用机制和酶的调节
- 格式:ppt
- 大小:4.81 MB
- 文档页数:99


第十章酶的作用机制和酶的调节目的和要求:理解、掌握酶活性部位的相关概念和特点;掌握酶催化高效性的相关机理;了解几种酶的催化机制,理解结构和功能的适应性;了解酶活性的调节方式,掌握酶活性的别构调节、可逆共价调节和酶原激活调节方式及生物代谢中的作用。
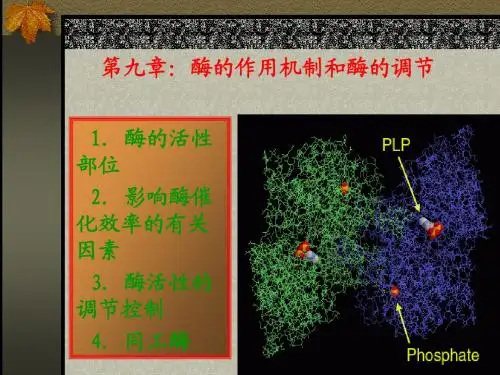
一、酶的活性部位㈠酶的活性部位的特点1、概念:三维结构上比较接近的少数特异的氨基酸残基参与底物的结合与催化作用,这一与酶活力直接相关的区域称酶的活性部位。
结合部位:专一性催化部位:催化能力,对需要辅酶的酶分子,辅酶或其一部分就是活性中心的组成部分;组成酶活性部位的氨基酸数目对不同酶而言存在差异,占整个酶氨基酸残基小部分酶活性部位的基团:亲核性基团,丝氨酸的羟基,半胱氨酸的巯基和组氨酸的咪唑基。
酸碱性基团:天冬氨酸和谷氨酸的羧基,赖氨酸的氨基,酪氨酸的酚羟基,组氨酸的咪唑基和半胱氨酸的巯基等。
2、特点⑴活性部位在酶分子的总体中只占相当小的部分(1%~2%)⑵酶的活性部位是一个三维实体⑶酶的活性部位并不是和底物的形状互补的⑷酶的活性部位是位于酶分子表面的一个裂隙内⑸底物通过次级键结合到酶上⑹酶活性部位具有柔性㈡研究酶活性部位的方法1、酶分子基团的侧链化学修饰⑴非特异性共价修饰:活力丧失程度与修饰剂浓度有正比关系;底物或可逆的抑制剂可保护共价修饰剂的修饰作用。
⑵特异性共价修饰:分离标记肽段,可判断活性部位的氨基酸残基,如二异丙基氟磷酸(DFP)专一性与胰凝乳蛋白酶活性部位丝氨酸残基的羟基结合。
⑶亲和标记:利用底物类似物和酶活性部位的特殊亲和力将酶加以修饰标记来研究酶活性部位的方法。
修饰剂的特点:①结构与底物类似,能专一性引入到酶活性部位;②具活泼化学基团,能与活性部位某一氨基酸共价结合,相应的试剂称“活性部位指示剂”。
胰凝乳蛋白酶和胰蛋白酶,TPE是酶的底物,TPCK是酶的亲和试剂,当酶与TPCK温浴后,酶活性丧失,这种结合具有空间结构的需求,同时也阻止其他试剂如DFP结合。



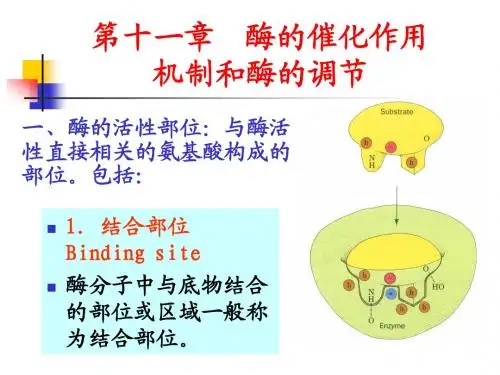
第10章酶的作用机制和酶的调节第10章酶的作用机制和酶的调节教学目的:掌握酶的活性部位结构与功能、酶活性的别构调节、酶原激活,了解酶高效性原因教学重点:酶活性部位的结构与功能及酶的活性的别构调节教学难点:酶活性的别构调节教学方法:多媒体教学内容:一、酶的活性部位及确定方法(一)酶活性部位概念及特点1、酶的活性中心(活性部位):指酶分子中的表面有一个必需基团比较集中、并构成一定空间结构的微小区域。
酶活性中心的基团,按其功能可分为结合基团和催化基团。
活性中心的基团都是维持酶活性的必需基团,2、酶活性部位的共同点:(1)酶活性部位仅占酶体积的很小一部分,通常只占整个酶分子体积的1~2%,酶分子是大分子物质,由很多氨基酸构成,而活性部位仅由几个氨基酸残基组成催化部位一般由2~3个氨基酸残基组成。
结合部位氨基酸残基数目,不同的酶有所不同。
可能是一个,也可能是多个。
(2)酶的活性部位具有三维结构,构成酶活性中心的基团,可位于同一条肽链上,也可位于不同的肽链上,在一级结构上可能相距甚远,但在空间结构上位置必须相互靠近;酶的空间结构受物理或化学因素影响时,酶的活性部位可能会遭破坏,酶会失活。
(3)活性中心的结合基团与底物专一性结合,这需要活性部位的基团精确排列。
活性部位具有一定的柔韧性,活性部位的结构并不是与底物的结构正好互补。
在酶与底物结合过程中,酶活性中心的构象在底物的诱导下可发生形变,然后嵌合互补形成中间产物,而底物在酶活性中心的诱导下也可发生形变,变的易与酶结合,有时是两者的构象同时发生变化后才互补契合(诱导契合学说)。
(4)酶活性部位位于酶分子表面的一个裂缝内,底物分子或底物分子的一部分结合到裂缝中,裂缝内的非极性基团较多,形成一个疏水环境,提高与底物的结合能力,也有极性的氨基酸残基,以便与底物结合并催化底物发生反应。
(5)底物通过较弱的次级键与酶结合。
组成酶活性中心的氨基酸残基,常见的有:组氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、半胱氨酸和酪氨酸3、研究酶活性部位的方法(1)共价修饰(2)亲和标记法(3)切除法(4)X射线晶体结构分析法二、酶促反应机制(一)基元催化的分子机制:酶的催化作用包括若干基元催化。


酶的作用和调控酶是一种生物催化剂,可以加速化学反应的速率,而且在反应过程中自身不发生改变。
酶在生物体内起着极其重要的作用,参与了几乎所有的生物反应,包括新陈代谢的调节、信号传导、DNA复制等等。
本文将重点讨论酶的作用和调控机制。
一、酶的作用酶具有高度特异性,只能催化特定的底物。
它们通过在底物分子上形成暂时的键合,降低活化能,从而使反应速率增加。
酶的作用主要可以从以下几个方面来理解。
1. 催化底物转化酶可以催化底物转化为产物,如淀粉酶能将淀粉分解为葡萄糖单元,蛋白酶能加速蛋白质的降解,而核酸酶能剪切DNA链。
这些反应都是通过酶与底物的特定结合来实现的。
2. 降低活化能酶可以通过形成酶-底物复合物来降低反应的活化能。
这是因为酶能够在底物的特定位置形成特定的电荷分布或空间结构,从而使底物分子更容易发生化学反应。
3. 提高反应速率由于降低了反应的活化能,酶可以使反应速率大大增加。
一般来说,酶催化的反应速率比非酶催化的速率快几百到几百万倍。
二、酶的调控为了维持生物体内的稳态,酶的活性需要得到严格调控。
酶的调控可以分为两类:遗传调控和非遗传调控。
1. 遗传调控遗传调控是通过改变酶的基因表达水平来调控酶的活性。
这可以通过以下几种方式实现。
a. 转录调控转录调控是通过调控酶基因的转录来控制酶的产量。
这可以通过激活或抑制酶基因的转录因子来实现。
转录因子是一类能够结合到基因启动子上的蛋白质,它们可以增强或抑制酶基因的转录,从而影响酶的产量。
b. 翻译调控翻译调控是通过调控酶基因的转录产物的翻译过程来调控酶的产量。
这可以通过调控转录产物的稳定性或翻译速率来实现。
例如,一些miRNA可以与转录产物相互作用,从而降解转录产物或阻止其翻译。
c. RNA剪接调控RNA剪接调控是通过调控基因转录产物的剪接方式来调控酶的活性。
不同的剪接方式会生成不同的转录产物,从而影响酶的功能。
2. 非遗传调控非遗传调控是通过调控已存在的酶分子的活性、稳定性或定位来调控酶的活性。


酶的作用与调节酶是生物体内一种特殊的蛋白质,具有催化化学反应的功能。
酶在生物体内起着至关重要的作用,参与了代谢过程中几乎所有的生化反应。
本文将探讨酶的作用机制以及它们是如何被调节的。
一、酶的作用机制酶能够催化化学反应的原因是因为它们具有一种特殊的结构,称为活性中心。
活性中心是酶分子中的一个小结构,与底物分子结合,促进其转化成产物。
酶与底物之间的结合是非常具体和高度选择性的,这是因为活性中心中的氨基酸残基与底物之间能够形成氢键、离子键和范德华力等相互作用。
酶催化反应的过程可以分为两步:底物结合和催化反应。
在底物结合阶段,底物与酶的活性中心发生相互作用,形成酶底物复合物。
在催化反应阶段,酶改变了底物的化学键,使其转化成产物。
酶并不参与反应本身,因此,在反应完成后,酶可以再次被使用。
二、酶的调节方式酶的活性受多种因素的调节,这些调节机制有助于维持生物体内化学反应的平衡,使代谢过程能够适应外部环境的变化。
1. 温度调节酶的活性受温度的影响。
随着温度的升高,酶的活性增加,因此在生物体内,温度的变化会影响酶催化反应的速率。
然而,当温度超过酶的特定温度范围时,酶的结构可能会受到破坏,导致其失去活性。
这种现象被称为酶的热变性。
2. pH值调节酶的活性还受pH值的调节。
不同的酶对pH值的依赖程度不同,有些酶对酸性环境敏感,而另一些酶则对碱性环境敏感。
这是因为不同的pH值能够改变酶的活性中心的电离状态,从而影响酶底物复合物的形成。
3. 底物浓度调节酶的活性还受底物浓度的调节。
当底物浓度较低时,酶与底物之间的碰撞几率较小,限制了酶催化反应的速率。
随着底物浓度的增加,酶与底物之间的碰撞次数增加,酶催化反应的速率也随之增加。
然而,当底物浓度过高时,酶活性可能达到饱和状态,酶催化反应速率停止增加。
4. 抑制剂与激活剂抑制剂和激活剂是调节酶活性的重要因素。
抑制剂能够结合到酶的活性中心,阻止底物与酶的结合,从而降低酶活性。
激活剂则能够增加酶与底物的亲和力,促进酶活性。
酶的作用机制和调节酶是一类生物催化剂,它在生物体内起着至关重要的作用。
酶能够加速化学反应的进行,降低活化能,使生物体内的代谢过程更加高效。
本文将探讨酶的作用机制以及调节机制。
一、酶的作用机制酶的催化作用主要通过两个机理实现,即酶与底物的结合和酶催化反应。
1. 酶与底物的结合酶与底物之间的结合是通过酶的活性位点来完成的。
活性位点是酶分子上具有特定结构和氨基酸残基的区域,与底物结构相互吻合。
酶与底物结合的特异性是酶高效催化的基础。
酶与底物的结合可以通过“钥匙-锁”模型来描述。
即酶的活性位点(“锁孔”)与底物的结构(“钥匙”)相互适配,形成酶底物复合物。
这种结合使得底物的活化能降低,从而促进酶催化反应的进行。
2. 酶催化反应酶催化反应是指酶通过调整反应路径、提供催化剂或者转移化学基团而加速化学反应的过程。
酶能够调整底物的构象,使得底物更容易进行特定的化学转化。
此外,酶还可以提供催化剂,如辅因子或金属离子,来促进反应的进行。
同时,酶还可以通过转移化学基团的方式来调节反应,例如酶可以将底物中的氢离子或者电子转移给另一个底物分子。
这些机制使得酶能够高效地催化反应,提高反应速率。
二、酶的调节机制为了适应生物体内不同的环境和代谢需求,酶的活性需要被调节。
酶的调节机制主要分为两种类型:可逆性调节和不可逆性调节。
1. 可逆性调节可逆性调节是指酶的活性可以在不同条件下被逆转或者恢复的调节机制。
可逆性调节主要包括以下几种形式。
(1)反馈抑制:产物在代谢途径中的积累可以抑制酶的活性,从而调节代谢途径的进行。
这种调节机制可以保证代谢途径的稳定性和平衡性。
(2)物质的结合:某些物质(如激活剂或抑制剂)可以结合到酶上,通过改变酶的构象或者酶与底物的结合能力来调节酶的活性。
(3)共价修饰:酶可以通过化学修饰(如磷酸化、乙酰化等)来调节自身的活性。
这种修饰可以通过激酶和磷酸酶等酶的协同作用来实现。
2. 不可逆性调节不可逆性调节是指酶的活性受到不可逆的结构变化或者修饰的调节机制。
酶的作用机制和酶的调节重点综述1. 酶作用机制:有专一性机理(锁与钥匙学说和诱导契和假说)和高效性的机理,以后者出现偏多,而且考查的题型上也是多样化(填写、选择、判断、问答等)。
(1)酶作用机理的两种学说,可以只作一般性的了解。
(2)酶作用高效性的机理要重点掌握。
体现在以下5个方面:①靠近与定向;②变形与扭曲;③共价催化;④酸碱催化;⑤酶活性部位的低介电区。
在这一部分中,还要了解某些酶的作用原理:①溶菌酶:活性部位有Clu3,和ASP52典型的酸碱催化。
②胰凝乳蛋白酶:活性部位有ASPl02、His57和Serl95组成的电荷拉力网。
③羧肽酶A:含金属离子zn2+的酶。
2. 酶的调节:酶调节的类型(共价调节,化学修饰,酶原激活,酶含量在分子水平的调节)。
几个概念也很重要:别构酶,调节酶等。
(一)名词解释1.变构酶(allosteric enzyme);2.同工酶(isozyme);3.活性中心(active center);4. 酶原的激活(activation of zymogen); 5. 别构效应(allosteric effect); 6. 正协同效应(positive cooperative effect)(二)选择题(在备选答案中选出1个或多个正确答案)1. 酶原激活的实质是A. 激活剂与酶结合使酶激活B. 酶蛋白的变构效应C. 酶原分子一级结构发生改变从而形成或暴露出酶的活性中心D. 酶原分子的空间构象发生了变化而一级结构不变E. 以上都不对2. 同工酶的特点是A. 催化相同的反应,但分子结构和理化性质不同的一类酶B. 催化相同反应,分子组成相同,但辅酶不同的一类酶C. 催化同一底物起不同反应的酶的总称D. 多酶体系中酶组分的统称E. 催化作用,分子组成及理化性质相同,但组织分布不同的酶3. 乳酸脱氢酶(LDH)是一个由两种不同的亚基组成的四聚体。
假定这些亚基随机结合成四聚体,这种酶有多少种同工酶?A. 两种B. 三种C. 四种D. 五种E. 六种4.下列关于酶活性中心的叙述哪些是正确的A.是由一条多肽链中若干相邻的氨基酸残基以线状排列而成B.对于整个酶分子来说,只是酶的一小部分C.仅通过共价键与作用物结合D.多具三维结构5.已知两种酶互为同工酶:A.它们的Km值一定相同B.它们催化的化学反应相同C.它们的分子结构一定相同D.它们的等电点相同E.它们的辅基一定相同6.在羧肽酶A的活性部位存在一个紧密结合的Zn2+离子,这个Zn2+离子的作用是A.诱导酶的构象变化B.共价催化C.提供低介电区D.使底物敏感键产生电子张力E.直接催化底物转变为底物7.构成胰凝乳蛋白酶活性中心的电荷中继网,有三个氨基酸残基组成,他们是A.His,Arg,Glu B.His,Ser,AspC.Arg,Ser,Asp n Asp,Glu,Ser8.V—[S]曲线可以用来描述酶的动力学特性,在下列几种酶中,V一[S]曲线为双曲线的酶是①,V一[S]曲线可以为S形曲线的酶是②。