必修一,酸碱盐在水溶液中的电离
- 格式:ppt
- 大小:1.21 MB
- 文档页数:25





人教高中化学必修一酸碱盐在水中的电离教案第1课时酸、碱、盐在水溶液中的电离一、教学内容及解析内容:引见电离、电解质的概念以及罕见酸、碱、盐电离方程式的书写。
解析:本节内容在教材中承上启下。
上节讲了物质的分类,这节就依据化合物在水溶液中或熔融形状下能否导电将其分为了电解质和非电解质。
并且引见了电解质、电离和电离方程式,使先生从电离的角度看法酸、碱、盐实质,为下节讲离子反响及其发作条件做了铺垫。
本节内容的主要特点是注重化学知识的综合运用,对电解质的概念也仅从分类的思想角度来看法,是为看法电解质电离进程和离子反响效劳的,并没有引见强、弱电解质的概念〔这局部知识将在选修四中学到〕,教学中不可过于加深拓宽。
因此,本课的重点是电解质的电离;从电离角度看法酸碱盐的实质。
难点是看法电解质及其电离的进程。
二、教学目的及解析目的:1、看法电离、电解质的概念;2、能用电离方程式表达罕见、典型的电解质在水溶液中的电离;3、能从电离实际的角度看法酸、碱、盐;解析:经过探求食盐晶体、食盐溶液、蔗糖、蔗糖溶液、NaOH溶液和稀盐酸的导电性实验创设教学情形,引导先生提出效果;经过先生的自主探求、观看视频、讨论和交流来得出电解质和非电解质的概念,看法电解质的电离进程;经过先生的练习,引导先生反思以加深对概念的了解运用,初步学会电离方程式的书写技艺;经过引导先生参考酸的定义,尝试从电离的角度概括出碱和盐的实质,培育先生运用所学知识剖析效果,处置效果的才干。
在整个教学进程中都是教员启示引导先生经过探求去获取知识,训练思想,加深他们对所学知识的了解和运用。
三、教学效果诊断剖析先生在初中化学中已接触过溶液的导电性实验,并经过上一课时对物质分类的学习,已初步掌握了物质分类的思想方法。
本课时要指点先生运用知识迁移来看法电解质及其电离,并从电离的角度看法酸碱盐的实质,引导先生构成迷信的思想方法。
同时,先生入手才干还在构成进程中,要培育先生经过〝练〞来深化了解,掌握技艺,构成练后反思的良好学习习气。


(人教版必修1)第二章《化学物质及其变化》教学设计第二节离子反应(第一课时酸、碱、盐在水溶液中的电离)【引入】在初中化学中,我们已经做过溶液的导电性实验,同学们思考过为什么氯化钠溶液能导电吗?我们也学习过盐酸和氢氧化钡反应、硫酸与氢氧化钠反应都是酸碱中和反应,那么这些反应有什么共同点呢?这节课我们对此作进一步探讨。
【强调】本节的课标是:知道酸碱盐在溶液中能发生电离。
了解电解质的概念。
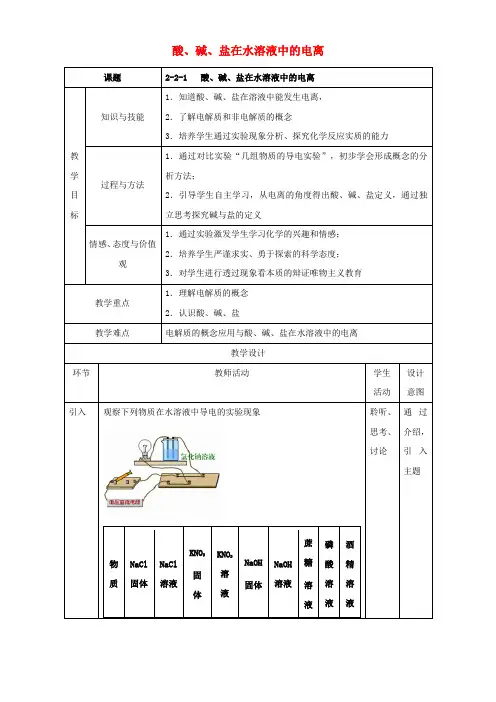
【板书】第二节离子反应【板书】一、酸、碱、盐在水溶液中的电离活动一、电解质和非电解质【回顾】【提问】据初中所学判断,下列物质中能导电吗?为什么?请大家思考。
盐酸、NaOH溶液、NaCl固体、石墨、蔗糖溶液、K2SO4溶液、酒精溶液、Cu、NaCl溶液。
【交流】石墨、铜能导电。
盐酸、NaOH溶液、K2SO4溶液和NaCl溶液能导电。
因为其中有自由移动的电子存在。
【讲解】很好,酸、碱、盐的水溶液可以导电,说明他们可以电离出自由移动的离子。
不仅如此,酸、碱、盐等在熔融状态下也能电离而导电,于是我们依据这个性质把能够在水溶液里或熔融状态下能导电的化合物统称为电解质。
【板书1】电解质:在水溶液里或熔融状态下能导电的化合物。
【板书2】非电解质:在水溶液里和熔化状态下都不导电的化合物。
【强调】要注意定义里面的“或”字还有“化合物”!是电解质要能够导电,什么情况下呢?水溶液状态或者熔融状态。
而且一定要是化合物。
但是它是氯化氢气体的水溶液,是混合物,所以不属于电解质。
氯化氢是电解质。
【交流2】电解质导电须有外界条件:水溶液或熔融状态。
只要满足在其中一种情况下能够导电的化合物就是电解质。
【交流3】电解质还应是在一定条件下本身电离而导电的化合物。
怎么理解这个本身电离?某些化合物,像SO2、CO2、NH3,它们的水溶液虽能导电,但他们不是电解质。
如二氧化碳溶于水生成碳酸,碳酸发生电离导电,并非二氧化碳本身电离导电。
【交流4】某些难溶于水的化合物。


高一化学人教版必修Ⅰ 导学案 编排 蓬安中学化学备课组 2012年9月使用 合作探究 共同进步 自强不息 厚德博学矮油,你又想偷懒啊?反省反省吧,亲! 想成为一名成功者,先必须做一名奋斗者。
《必修Ⅰ第2章第2节 离子反应》导学案(第1课时)高一 班 第 组 姓名 组内评价 教师评价【课标要求】1.知道盐在水中能发生电离2.了解电解质和非电解质的概念 【重点难点】1.本节课重点学习电解质的概念和电解质的判断2.从电离的角度得出酸、碱、盐定义,通过独立思考学会形成概念的分析方法 【新课导学】阅读教材P30-31思考:酸、碱、盐在水溶液中或熔化状态下离解出自由离子的过程称为 。
【实验探究】1、大家都知道金属和石墨都能导电,那么化合物能否导电呢?通过实验进行探究:小结:酸碱盐在水中能够电离出____,所以能够导电。
金属内部存在_____,所以也能导电。
部分物质在熔融状态下也会电离出____,所以也能导电,如NaCl 。
物质导电原因:①存在自由移动阴阳离子②存在自由移动的电子例:下列物质的水溶液,能导电的是 。
①酒精○2硫酸○3蔗糖○4氢氧化钠○5硫酸铝 一、电离定义:电解质在水溶液中或熔融状态下离解成自由移动阴阳离子的过程。
电离方程式:用符号表示电离过程的式子,如NaCl = Na + + Cl -例:写出下列电离方程式①Na 2CO 3___________________②NaOH______________________ ③H 2SO 4__________________ ④K 2SO 4__________________⑤HCl ___________________⑥HCl ___________________ 【归纳总结】从电离的角度认识酸、碱、盐酸:在水溶液中电离出的 化合物。
碱:在水溶液中电离出的 化合物。
盐: 组成的化合物。
特殊:①水溶液中NaHSO 3 = Na + + HSO 3- NaHCO 3 = Na + + HCO 3-②水溶液中NaHSO 4 = Na + + H + + SO 42- 熔融时NaHSO 4 = Na + + HSO 4-二、电解质与非电解质1、电解质:在 或 能够导电的化合物,如酸、碱、盐等。

离子反应第1课时酸碱盐在水溶液中的电离一、选择题1.下列关于电解质的判断中,正确的观点是()A.在熔融状态下能导电的物质B.在熔融或溶解状态下能导电的物质C.在水溶液里或熔融状态下能导电的化合物D.在熔融和溶液的状态下都能导电的化合物2.下列在给定状态下能导电的是()A.固体氯化钠B.液态氯化氢C.乙醇溶液D.液态氢氧化钾3.今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中,正确的是()A.X一定是电解质B.X可能为非电解质C.X只能是盐类D.X可以是任意化合物4.下列电离方程式中,正确的是()A.Na2SO4===2Na++SO-24B.Ba(OH)2===Ba2++OH-2C.Al2(SO4)3===2Al3++3SO2-4D.Ca(NO3)2===Ca2++2(NO3)2-5.下列物质在水溶液中能够全部电离的是()A.H2O B.NH3·H2OC.CH3COONH4D.CH3COOH6.有一种用实际参加化学反应的离子符号来表示化学反应的式子叫离子方程式,在离子方程式中,反应前后电荷是守恒的。
如下离子方程式:RO n-3+F2+2OH-===RO-4+2F-+H2O,由此可知在RO n-3中,元素R的化合价是()A.+4 B.+5 C.+6 D.+77.NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划分为一类物质,下列分类标准不正确的是()A.钠的化合物B.可与硝酸反应C.可溶于水D.电解质8.用20mL 0.1mol/L的含氧酸H x RO4溶液与15mL 0.2mol/L的某碱M(OH)a溶液恰好完全反应,全部生成正盐,则R 元素的化合价是( )A .+(8-2a 3)B .+(8-2a )C .+(8-3a2) D .+(8-3a )9.下列各组物质,前者属于电解质,后者属于非电解质的是( ) A .NaCl 晶体、BaSO 4 B .铜、二氧化硫C .液态的醋酸、酒精D .熔融的KNO 3、硫酸溶液10.下列关于电解质说法正确的是( ) A .能导电的物质叫电解质 B .电解质在通电时发生电离C .NaCl 晶体不导电,所以NaCl 不是电解质D .熔融的KOH 导电,所以KOH 是电解质 11.下列说法正确的是( )A .水导电性很差,所以水是非电解质B .电解质与非电解质的本质区别是在一定条件下能否电离C .酸、碱和盐类都属于电解质,其他化合物都是非电解质D .NaCl 和HCl 都是电解质,所以它们熔融状态下都能导电 12.下列叙述正确的是( )A .NaCl 溶液在电流作用下电离成Na +和Cl -B .NaCl 是电解质,故NaCl 晶体能导电C .氯化氢溶于水能导电,但液态氯化氢不能导电D .导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 二、非选择题13.在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来:则:(1)加水的烧杯为________。
化学必修一《第二节离子反应》教学设计——第1课时酸、碱、盐在水溶液中的电离增城市中新中学戴剑湘一、教材分析:本节知识属基本概念和基本理论部分,是学生认识离子反应和离子方程式的起始课。
从教材的体系看,它是初中学习溶液导电性实验、酸碱盐电离知识的延续和深化,又是学习电解质溶液理论知识的基础,起承上启下的作用。
学好这一节内容,不仅巩固了初中学过的电离的初步知识,又为后面学习电解质在溶液中反应的实质,元素及其化合物的学习以及选修四电解质溶液的学习奠定了一定的基础。
二、教法分析:由于高一学生还没学习化学键的概念,也不具备晶体、极性分子等相关知识。
在初中,学生对导电实验的认知只是感性认识,如何从微观上理解导电的本质,大多数学生会感到比较困难,故必须借助电脑视频这一媒体尽快使学生上升到理性认识。
故本课时对电离概念的建立是以熔融氯化钠和氯化钠溶液如何导电这一事实为载体,再加以蔗糖溶液不导电这一事实加以对比,深化电离的概念。
至于电解质概念的形成,是在彻底认识和理解电离的基础上进一步延伸而得出的。
三、学法分析:学生自主探讨问题,并采用小组合作形式。
四、教学目标知识与技能1、理解电解质的概念,了解电解质的电离过程,并知道离子在溶液中是以水合离子的形式存在。
2、知道酸、碱、盐在溶液中能发生电离,会书写常见强酸、强碱和可溶性盐的电离方程式。
3、从电离角度认识酸、碱、盐。
过程与方法1、经历对电解质导电性的探究过程,提高科学探究活动。
2、学会运用观察、实验等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工。
情感、态度与价值观1.发展学生学习化学的兴趣,让学生乐于探索物质变化的奥秘,感受化学世界的奇妙。
2.培养学生将化学知识运用于生活实际的意识,增强对化学生活的热情。
五、教学重点1、电离概念、电解质概念的形成。
2、电离方程式的书写。
六、教学难点电离概念、电解质概念的形成七、教学过程。
《酸碱盐在水溶液中的电离》
1、酸碱电离:一般在水溶液中,当pH 小于7时,水是H2O2的电解质;大于等于7时,水是OH-的电解质.
2、酸碱反应的规律:若反应前后元素种类不变(只改变原子个数或核外电子数)则生成物为中性的(中和反应);若有物质分子结构发生改变则产物是气体;若产物是弱电解质,则该弱电解质与另一部分强电解质反应得到水(可逆)
3、盐的水解:可以看作与酸碱相同的反应
4、沉淀溶解平衡:各种阳离子大量存在的化合物可被看做沉淀。
能够溶解它们的水必定大量地吸收这些阳离子,所以化学上把它们叫做不溶性的。
《酸碱盐在水溶液中的电离》教学设计一、教材分析本节课内容是高中《化学必修1》第二章第一节离子反应的第一课时,在教材中承前启后。
在学习基本分类法的基础上又将化合物分为电解质与非电解质,并介绍了电离和电离方程式,让学生从电离角度认识酸、碱、盐的本质,为下节讲离子反应及其发生条件做好铺垫。
二、学情分析高一学生对于一些概念的形成过程的学习可能会有些吃力,一些微观过程的理解不到位,所以本节课宜适当增加实验和动画以帮助学生对抽象概念的理解。
直观、形象的东西往往容易激发学生的学习兴趣,也容易被接受和掌握。
新课程标准的核心是要学生参与到知识学习的整个过程中来,亲历学习探究的过程,这也是本节课教学设计十分注重的方面。
三、教学目标1.知识与技能(1)了解电解质和非电解质的概念,知道常见的电解质。
(2)认识电解质电离过程,会写电离方程式。
(3)从电离角度认识酸、碱、盐本质。
2.过程与方法(1)通过实验观察与分析,提高科学分析问题的能力。
(2)学会运用类推的方法分析问题,定义概念。
(3)利用图片分析微观过程,学会由微观视角探究化学的本质。
3.情感态度与价值观提高学习化学的兴趣,培养乐于探究,合作学习的精神,体验探究的艰辛和喜悦,形成良好的科学探究精神和学习习惯。
四、教学重、难点1.教学重点(1)电解质概念的理解;(2)电离方程式的书写;2.教学难点:电解质概念的理解五、教学过程教学环节及用时教师活动学生活动设计意图环节一新课导入由泡腾片引入新课【板书】第二节离子反应一、酸、碱、盐在水溶液中的电离观察实验现象,积极调整自己的状态激发学生学习兴趣,帮助学生把注意力集中到课堂上来。
激发学生学习兴趣,帮助学生集中注意力。
环节二电解质与非电解质引导学生完成导电实验(PPT展示实验用品)【提问】哪些可以导电?【过渡】那么只有在水溶液中可以导电吗?请看一个视频。
【ppt播放】熔融氢氧化钠的导电实验【PPT展示】1、电解质:在水溶液中或熔融状态能导电的化合物。