组织切片技术概述
- 格式:ppt
- 大小:18.63 MB
- 文档页数:15

组织切片技术
固定:
组织块大小:1.5×1.5×0.2 CM
固定液>4倍组织体积
1. 酒精固定
纯究竟有较大的收缩力,固定时先用80%酒精固定数小时,然后换95%酒精。
优点:(1)尿酸结晶和糖类,用100%乙醇固定
(2)别的固定液固定后,80%乙醇保存
(3)边固定边脱水
缺点:(1)核染色不良
(2)脂类不行
(3)色素不行
(4)表面发硬,块大不行
2.福尔马林固定
市售为40%甲醛水溶液,应放入小量碳酸钠放置一段时间
福尔马林固定液:40%甲醛溶液1份,水9份
固定数小时后用水洗24小时
优点:克服了乙醇固定的缺点
苦味酸固定
以苦味酸饱和水溶液储存,固定后的组织经酒精脱水即可。
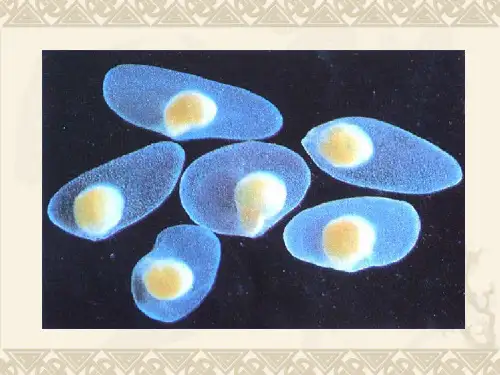

植物细胞学分析之组织切片技术一、试剂(1)卡诺氏固定液:无水乙醇与冰醋酸按体积比为3:1混合配制。
(2)1mol/L盐酸溶液:取浓盐酸(比重1.19)82.5ml,加入蒸馏水917.5ml。
(3)醋酸洋红染液:4-5g洋红,冰醋酸45ml,蒸馏水55ml,先将冰醋酸加入蒸馏水中煮沸,然后将火移去,立刻加入洋红,用玻璃棒搅匀溶化,冷却后过滤即成。
(4)70%酒精;95%酒精。
二、细胞分析方法1.有丝分裂全过程的染色体制片方法步骤:取材-预处理-固定-根尖解离1mol/L HCL-醋酸洋红染色-压片(1)发根挑选每份黑麦种子材料25粒,经流水冲洗,放于培养皿内温水浸泡24h。
置于25℃恒温箱中发根。
待根长到1~2cm时,于适宜时间用蒸馏水洗净,将水吸干,剪取根尖0.5~1cm进行预处理。
为获得尽可能多的分裂相,根尖以上午9~10时剪取为宜。
(2)预处理为了有利于有丝分裂中,染色体的观察和计数,通常要对材料进行不同的预处理。
预处理主要通过抑制和破坏纺锤丝的形成,来获得更多的中期分裂相,同时还可以改变细胞质的粘度,促使染色体缩短和分散,便于压片和观察。
将根尖浸于蒸馏水内,1-4℃低温处理24h。
(3)固定材料经预处理后,用流水冲洗2次,然后投入卡诺液(3份甲醇∶1份冰乙酸)中固定26h,用95%的乙醇洗两次,转入70%乙醇中保存备用(4℃)。
固定的目的是:①迅速防止细胞死亡后的变化,如自溶、腐败等,尽量保持生长状态结构。
②使细胞中的蛋白质、脂肪等成分转变为不溶性物质,以保持生前的形态。
③使组织内各种物质成分产生不同的折光率,便于观察和鉴定。
④使不同组织成分对染料有不同的亲和力,便于染色。
⑤防止细胞过度收缩或膨胀,失去原有的形态结构。
(4)解离常用酸解法:从70%乙醇中取出固定好的根尖,用蒸馏水冲洗后,吸水纸吸干,放入盛有1 mol/L的HCl的1.5ml离心管中,60℃水浴,恒温条件下解离10min。
植物细胞的细胞壁对细胞形态和结构起支撑和保护作用,分生组织的细胞壁结构将分生细胞结合成一个整体,因此在压片之前需要采用适当方法软化或部分分解细胞壁使细胞间易于分离,这一操作称为解离。

病理学中的组织切片技术病理学是医学领域中非常重要的一个学科,研究人体各个器官和组织的疾病变化及其发生、发展机制。
而组织切片技术是病理学中的基础操作,是为了观察和诊断疾病而必要的步骤之一。
本文将详细介绍组织切片技术的相关知识和方法。
一、组织切片技术的概述组织切片技术是指将人体组织切割成薄片并染色,以便于病理学家观察。
这项技术已经存在了很长时间,并且随着技术的发展和改进,已经成为了诊断和治疗疾病的重要手段之一。
组织切片技术可以被广泛应用于疾病的研究、诊断和治疗中。
二、组织切片技术的步骤组织切片技术的主要步骤包括取样、固定、脱水、包埋、切片和染色。
下面将对这些步骤进行详细的介绍:1. 取样组织切片的第一步是取样,即从人体组织中取出一小块,以便于后续的操作。
取样的方法根据不同的情况会有所不同,比如在手术中取样,就需要根据病变的部位和特点来选择取样点,而在活检中取样,就需要根据患者的症状和体征来确定取样点。
2. 固定取样后,需要用一种方法把组织中的细胞和结构固定住,以便于后续处理。
目前常用的固定剂是福尔马林,它可以迅速把组织中的蛋白质交联,使其不易变性,从而保持组织形态的完整。
3. 脱水在固定后,需要将组织逐渐从水中转移到酒精、乙醇等脱水剂中,以便于把组织中的水去除,使其硬化。
这是组织切片的关键步骤之一,如果脱水不彻底,切出的组织切片会变形或破损。
4. 包埋将脱水的组织置于熔蜡中,使其被包覆在蜡中。
这么做可以保持组织的形态,并使其更易于切割。
5. 切片蜡包埋后,组织需要被切成薄片。
切片可以使用手工或自动切片机完成,手工切片需要技巧和经验,而自动切片机可以更好地保证切片的厚度和质量。
6. 染色切片完成后,需要对组织进行染色,以便于病理学家对其进行观察。
目前常用的染色剂有血液学染色剂、组织学染色剂以及免疫组化染色剂等。
三、组织切片技术的应用组织切片技术在病理学中有广泛的应用,其中包括:1. 诊断和治疗疾病组织切片技术是病理学家进行诊断和治疗疾病的重要手段之一。

组织切片制备技术在生命科学领域中,组织切片制备技术是一项基本且重要的技术,它被用于组织学、解剖学、病理学和神经科学等诸多领域。
组织切片制备技术可以产生高质量的组织切片样本,以便进行研究和分析。
本文将探讨组织切片制备技术的具体步骤和注意事项。
1. 组织处理在进行组织切片制备之前,需要对样本进行处理。
处理的目的是保护组织结构和细胞形态,以便在组织切片过程中得到高质量的切片。
处理的方法包括固定、脱水和浸渍。
2. 组织固定组织固定是组织切片制备技术中的一个重要步骤,目的是停止组织活动并保护组织结构。
固定的方法包括乙醛、甲醇和布氏液等。
3. 组织切片组织切片是组织切片制备技术的核心步骤之一。
合适的切片厚度应该根据需要来决定。
切片的方法包括手工切片和机器切片。
机器切片可通过旋转式、滑动式或挤压式制备。
4. 切片染色切片染色是组织切片制备技术中的关键步骤,可使细胞和组织结构变得更明显。
切片染色的方法主要有荧光染色和显微镜染色。
5. 成像和分析成像和分析是组织切片制备技术的最后一步。
通过显微镜成像和分析,可以观察到细胞和组织结构的形态和分布。
这种方法还可以被用于研究细胞和组织中的基因,蛋白质和其他特定目标。
注意事项:- 操作中要注意安全,佩戴手套和眼镜等防护设备;- 操作环境要保持清洁,防止异物进入;- 操作材料要储存妥善,避免过期或者污染;- 操作流程要规范,避免操作过程中发生错误。
结论:组织切片制备技术是在生命科学领域中非常基本的技术。
制备高质量的组织切片样本是开展组织学、解剖学、病理学和神经科学等领域的基础工作。
研究人员在进行组织切片制备时,必须依据标准的步骤和注意事项,以确保所获得的数据是可靠且具备参考价值的。

组织切片技术第一章组织制片概述组织制片技术是观察细胞、组织的生理和病理形态变化的一种主要的方法。
组织化学技术和原位杂交技术都是以组织制片为基础的。
一、制片前的准备工作1.染色缸和标本瓶的清洗用毛刷沾去污粉将染色缸和标本瓶里外擦洗,自来水冲洗干净备用。
金属银或组织化学染色时,器皿更要彻底清洗。
先去污粉洗,再洗液浸泡过夜,再自来水和蒸馏水冲洗。
洗涤液的配制:重铬酸钾300克浓硫酸300毫升蒸馏水3000毫升2.载玻片和盖玻片及其清洗载玻片简称为玻片或载片,一般尺寸为76毫米×26毫米,厚度为1-1.5毫米。
盖玻片一般为正方形或长方形,厚度为0.15-0.5毫米。
最常用的规格为18×18毫米、20×20毫米,还有其它规格的。
煮沸洗涤法: 新旧玻片均可采用。
洗衣粉水浸没玻片,加热煮沸15-20分钟,冷却,自来水冲洗,干净的白棉布或纱布擦干,保存备用。
酒精浸泡擦拭:新的玻片或载片可直接用酒精浸泡、擦拭,保存备用。
洗液浸泡法:要求严格的玻片,可在洗液浸泡后在冲洗干净。
二、制片方法的种类(一)非切片法不用切片机、没有切片手续而制成切片的方法。
常用的有以下几种:1.整体封藏法待制作的材料一般很小或为一薄片状,如无脊椎动物的水螅和草履虫等,脊椎动物的鸡胚和蛙胚等。
这些材料取下后经固定、脱水和染色就可以封藏在玻片内。
2.涂片法主要是液体或半流动性的材料,如血液、精液、细胞学检查、微生物等,直接将材料涂在玻片上,再经固定和染色制成标本。
血液涂片的制作与染色:取一干净载玻片,用左手拇指和食指夹住,然后取一小滴动物血置于载玻片右端,再取另一张边缘光滑的载玻片, 斜置于血滴左侧, 先向右稍移动轻轻触及血滴,使血液沿玻片端展开成线状, 两玻片的角度以30~40°为宜(角度过大血膜较厚,角度小则血膜薄), 轻轻将载玻片向左推进,即涂成血液薄膜,推进时速度要一致,否则血膜成波浪形,厚薄不匀. 待涂片在空气中完全干燥后,将血涂片靠近中央部分的两边(与载玻片短边平行的边)用玻璃铅笔圈上并平放在染色架上进行染色。

---------------------------------------------------------------最新资料推荐------------------------------------------------------组织切片技术(精品)组织切片技术第一章组织制片概述组织制片技术是观察细胞、组织的生理和病理形态变化的一种主要的方法。
组织化学技术和原位杂交技术都是以组织制片为基础的。
一、制片前的准备工作 1.染色缸和标本瓶的清洗用毛刷沾去污粉将染色缸和标本瓶里外擦洗,自来水冲洗干净备用。
金属银或组织化学染色时,器皿更要彻底清洗。
先去污粉洗,再洗液浸泡过夜,再自来水和蒸馏水冲洗。
洗涤液的配制:重铬酸钾 300 克浓硫酸 300 毫升蒸馏水 3000 毫升 2.载玻片和盖玻片及其清洗载玻片简称为玻片或载片,一般尺寸为76 毫米26 毫米,厚度为 1-1. 5 毫米。
盖玻片一般为正方形或长方形,厚度为 0. 15-0. 5 毫米。
最常用的规格为 1818 毫米、 2020 毫米,还有其它规格的。
煮沸洗涤法: 新旧玻片均可采用。
洗衣粉水浸没玻片,加热煮沸 15-20 分钟,冷却,自来水冲洗,干净的白棉布或纱布擦干,保存备用。
酒精浸泡擦拭:新的玻片或载片可直接用酒精浸泡、擦拭,保存备用。
洗液浸泡法:要求严格的玻片,可在洗液浸泡后在冲洗干净。
1/ 16二、制片方法的种类(一)非切片法不用切片机、没有切片手续而制成切片的方法。
常用的有以下几种:1.整体封藏法待制作的材料一般很小或为一薄片状,如无脊椎动物的水螅和草履虫等,脊椎动物的鸡胚和蛙胚等。
这些材料取下后经固定、脱水和染色就可以封藏在玻片内。
2.涂片法主要是液体或半流动性的材料,如血液、精液、细胞学检查、微生物等,直接将材料涂在玻片上,再经固定和染色制成标本。
血液涂片的制作与染色:取一干净载玻片,用左手拇指和食指夹住,然后取一小滴动物血置于载玻片右端,再取另一张边缘光滑的载玻片, 斜置于血滴左侧, 先向右稍移动轻轻触及血滴,使血液沿玻片端展开成线状, 两玻片的角度以 30~40 为宜(角度过大血膜较厚,角度小则血膜薄), 轻轻将载玻片向左推进,即涂成血液薄膜,推进时速度要一致,否则血膜成波浪形,厚薄不匀. 待涂片在空气中完全干燥后,将血涂片靠近中央部分的两边(与载玻片短边平行的边)用玻璃铅笔圈上并平放在染色架上进行染色。


血液科病理组织切片与染色技术血液科病理组织切片与染色技术是现代医学领域中非常重要的研究和诊断手段。
通过对血液科病理组织进行切片和染色,可以帮助医生准确诊断疾病,了解病理变化,制定科学的治疗方案。
在本文中,我们将详细介绍血液科病理组织切片与染色技术的原理、方法和应用。
一、病理组织切片技术的原理与方法1. 原理病理组织切片技术是将组织标本切割成非常薄的切片,使其可以在显微镜下观察。
病理组织切片是病理诊断的重要步骤之一,通过对组织细胞的形态、结构和功能进行观察和分析,可以发现异常变化并鉴定疾病。
2. 方法a. 标本处理:将取得的血液科病理组织进行固定、包埋和切片的预处理。
首先,将组织标本固定在适当的固定液中,以保持其形态和结构。
然后,将固定的组织标本进行包埋,使其可以被切割成所需的薄片。
最后,用切片机将包埋的组织标本切割成薄片。
b. 切片染色:将切下的组织标本放在载玻片上,并进行染色处理。
染色是为了增强组织细胞的对比度,使其更易于观察和分析。
染色方法有很多种,常用的包括血液科染色、组织染色以及免疫组化染色等。
c. 封片处理:将染色后的组织切片放在载玻片上,并加入封片剂进行封片处理。
封片处理是为了保护切片和染色剂,使其可以长期保存,并方便后续的观察和分析。
二、染色技术的原理与方法1. 原理染色技术是为了使细胞或组织中的某些结构、成分或代谢产物显现出特殊颜色,以便于观察、分析和诊断。
不同的染色方法可以突出或改变细胞或组织中特定成分的性质和形态,从而帮助医生进行病理分析和诊断。
2. 方法a. 血液科染色:血液科染色是将血液样本涂在玻片上,然后通过染色剂的作用,使不同的细胞成分显现出不同的颜色。
b. 组织染色:组织染色是将切片样本经过一系列染色处理,使不同的组织结构和成分显现出不同的颜色。
常见的组织染色方法有苏木精-伊红染色和光学显微镜下依据染色结果进行分析。
c. 免疫组化染色:免疫组化染色是一种用于检测特定蛋白质和抗原的方法,通过使用特异性抗体与目标物质结合,然后用染色剂标记抗体,将目标物质显现出来。

病理组织切片制作技术病理组织切片常用的制作方法有三种。
即石蜡切片法,冰冻切片法和火棉胶切片法。
以石蜡切片法为代表,切片的基本制作过程是:组织取材T固定T冲洗T脱水T透明T浸蜡T组织包埋T组织切片T展片附贴T切片脱蜡T染色T脱水T染片透明T封固。
以上基本过程是互相联系的,任何一环节出现问题,都将使整个切片制作归于失败。
因此应细致、耐心、认真负责,并事先做好计划安排。
一、取材采取病料,要刀剪锐利,剪切时不可挤压,扯拉病料,以防人为损伤。
切取的工具要清洁。
采取病料越新鲜越好,一般不超过死后24 小时。
应选择病变部与可疑病变部切取,切取时要由表及里,有浅入深并包括周围正常组织一部分。
特殊病料应根据器官的结构特点切取。
管状,囊状和皮肤组织应注意垂直切取(横切)。
带有薄膜的组织,要防止切时薄膜分离和脱落。
切取组织块大小,以 1.5X 1.5X 0.3厘米为宜,最厚不宜超过0.5厘米。
组织块病变一面应平整光滑,另一面可不平整,以便包埋时辨认。
切取后,放入事先准备好的装有固定液的磨口玻璃广口瓶中,并做好标记。
二、固定固定的目的是迅速将组织细胞杀死,使细胞中的蛋白质,糖,脂肪等凝固,从而保持与活组织相似的结构状态。
材料取下后,应迅速固定。
固定液数量应为病理组织块的5到20倍。
由于一般把组织块浸入固定液后数小时,固定液渗入组织液的深度只达2到3厘米。
因此,可以放置冰箱内固定,使组织内酶失去作用,细菌也能停止滋生。
最常用的固定液是10%的福尔马林溶液:使用时,用40%的甲醛饱和水溶液10毫升,加水90 毫升配成。
三、冲洗固定后的组织块,应将固定液洗去。
一般均用流水(自来水)冲洗12到24小时左右。
及时冲洗尚有停止固定的作用,防止固定过度,有利于制片染色。
冲洗时如不方便用流水冲洗,也可用较大容器盛装水浸洗,每隔相当时间换水一次。
整个浸洗时间比流水冲洗应稍长一些。
酒精固定的组织材料不需冲洗。
四、脱水经过固定的组织,冲洗后要进行脱水。

组织切片技术在现代科技发展的背景下,组织切片技术作为一项先进的生物医学研究方法,在细胞学、组织学以及疾病研究等方面发挥着重要作用。
本文将介绍组织切片技术的原理、应用以及未来的发展前景。
一、原理组织切片技术是一种将组织样本切成极薄的切片,以便进行显微镜观察和进一步分析的方法。
它主要包括取样、固定、包埋、切片和染色等步骤。
首先,需要从组织样本中取得足够的细胞或组织。
然后,将样本进行固定,以保持其结构和形态的稳定性。
接下来,将固定的样本进行包埋处理,即将组织样本置于固定液中进行浸渍,再置于石蜡或树脂中固化。
之后,利用显微刀、显微镜或电子显微镜等工具将组织样本切成极薄的切片。
最后,对切片进行染色,以便观察和分析细胞和组织的结构、功能及病理变化。
二、应用组织切片技术在生物医学研究中有着广泛的应用。
主要包括以下几个方面:1. 组织学研究:组织切片技术被广泛应用于组织学研究领域,可以观察和研究各种组织和器官的结构、形态、功能以及病理变化,从而促进对生物体结构和功能的深入了解。
2. 病理诊断:组织切片技术在病理学中扮演着重要的角色。
医生可以通过观察组织切片来诊断疾病,并对患者进行治疗和预后评估。
3. 药物研发:组织切片技术可以用于药物研发中的毒性评估和药物吸收、分布、代谢和排泄等研究。
通过观察组织切片的变化,研究人员可以评估药物对组织和细胞的损伤程度,从而指导药物研发和临床应用。
4. 种植技术:组织切片技术在植物研究中也有广泛应用。
通过观察植物组织切片,可以研究植物的器官结构、细胞构成以及代谢活性等方面的信息,有助于植物遗传改良和种植技术的改进。
三、未来发展随着科学技术的不断发展,组织切片技术也将迎来更广阔的应用前景。
以下几个方面值得关注:1. 自动化和高通量技术:随着自动化和高通量技术的发展,组织切片的速度和效率将大大提高,为更快速地获取更多的组织信息提供了可能。
2. 多重标记技术:利用多重标记技术,可以对组织切片进行多种染色,从而同时观察多个细胞和结构的分布和互动,揭示更深层次的生物过程。
组织切片技术操作规范1.引言本文档旨在规范组织切片技术的操作流程,确保操作的准确性和安全性,保护组织样本的完整性和质量。
2.术语定义组织切片:将组织样本切割成薄片,便于显微镜下观察和分析。
操作流程:执行组织切片技术的步骤和方法。
完整性:组织切片的完整程度,即样本是否受损或缺失。
3.操作准备在进行组织切片技术之前,需要完成以下准备工作:准备必要的器材和材料,包括组织样本、切片刀、显微镜等。
清洁操作区域,并确保操作区域无尘、无杂质。
确保所有器材和材料都处于良好状态,并进行必要的清洁和消毒。
4.操作步骤组织切片技术的操作步骤如下:1.取出组织样本并将其放置在切片刀上。
2.用切片刀将组织样本切割成薄片,保证切面的平整度和均匀度。
3.将切下的组织切片放置在显微镜载玻片上。
4.优化组织切片的染色和固定步骤,使得切片能够清晰可见。
5.将载玻片上的组织切片盖上盖片,并用胶带或其它方式密封。
6.在显微镜下观察组织切片的结构和细胞形态。
5.操作注意事项在进行组织切片技术操作时,请注意以下事项:操作过程中要保持手部和操作区域的清洁,避免污染组织样本。
切片刀要保持锋利,并在使用前进行必要的消毒处理。
操作过程中,切片要小心处理,避免切碎或损坏。
注意使用显微镜时的聚焦和调节,确保能够清晰观察组织切片。
6.技术风险和安全措施组织切片技术操作具有一定的风险性,为保证操作的安全性,请注意以下安全措施:在操作过程中佩戴手套和防护眼镜,避免直接接触切片刀和组织样本。
使用器材和材料时,遵守相应的操作规范和安全操作指南。
在操作区域设置警示标志,并保持清晰的紧急通道。
7.总结本文档阐述了组织切片技术的操作规范,包括操作准备、操作步骤、注意事项和安全措施。
按照本文档的要求执行操作,能够确保组织切片技术的准确性、安全性和有效性。
oct组织切片用途
OCT(Optimal Cutting Temperature)组织切片技术是一种在低温下进行组织切片的方法,主要用于观察和研究生物组织的结构和功能。
OCT组织切片技术可以保持组织样本的形态结构和生物分子活性,并且可直接观察细胞核、细胞质、细胞器等细胞结构。
在生物医学研究中,OCT组织切片技术广泛应用于病理学、细胞生物学、神经科学等领域。
例如,在肿瘤学研究中,OCT组织切片技术可以用于观察肿瘤细胞的形态和结构,以便更好地了解肿瘤的发生和发展过程。
在神经科学研究中,OCT组织切片技术可以用于研究大脑的结构和功能,以及神经细胞的形态和分布情况。
此外,OCT组织切片技术还可以与其他技术相结合,如免疫组化技术、荧光标记技术等,以提高组织样本的分辨率和特异性。
这些技术的结合可以帮助研究者更好地了解生物组织的结构和功能,为疾病诊断和治疗提供重要的依据。
生物解剖学实验中的组织切片技术在生物解剖学实验中,组织切片技术是一项重要的技术手段。
通过组织切片,可以将生物体的组织结构进行细致观察和研究。
下面将介绍组织切片技术的步骤和注意事项。
一、材料准备在进行组织切片实验的时候,需要准备以下材料:1. 组织样本:可以是动物组织、植物组织或人体组织。
要确保样本新鲜且保存良好。
2. 切片刀:选择合适的切片刀能够提高切片的质量。
3. 碘酒:用于消毒和标记切片。
4. 显微镜:用于观察切片的显微结构。
5. 切片贴片:用于固定和保存组织切片。
二、切片步骤1. 样本固定:将组织样本放入含有适当浓度的缓冲液中进行固定。
固定能够保持组织结构的完整性,同时防止样本中的酶活性继续进行。
常用的固定液有福尔马林和氯乙酸。
2. 组织处理:在固定后的组织中,需要去除多余的水分,并使组织透明化。
可以使用甲醛、丙酮等试剂来进行处理。
3. 组织切片:将透明化后的组织放置在切片刀上,用切片刀沿着想要切片的方向进行切割。
要注意刀的角度和切割的速度,以保证切片的质量。
4. 切片贴片:将切好的组织切片用镊子取出,轻轻放在切片贴片上。
要避免切片的叠加和重叠,确保切片的平整和清晰。
5. 切片染色:切片染色是为了增强切片的对比度,使组织结构更加清晰可见。
可使用常见的组织染色剂,如伊红、伊红苏木、溴化乙锐等。
6. 保存和贮存:将染色好的切片放在切片贴片上,用封条封住,放置在保存盒中。
要放置在阴凉干燥的地方,避免阳光直射和湿气的侵蚀。
三、注意事项1. 操作前要熟悉实验步骤,并严格按照操作规程进行。
2. 对于有毒或易燃易爆的试剂,要注意安全操作,避免事故发生。
3. 在操作过程中要保持实验台面的清洁,避免污染样本。
4. 切片刀要保持锋利,切割时可以用适量的甘油润滑刀片。
5. 观察切片时,要调整显微镜的焦距和光线,以获得最佳的观察效果。
通过组织切片技术,可以观察和研究生物体的组织结构,进而了解其功能和生理特征。
这项技术在生物解剖学领域的应用广泛,并且在医学研究、病理诊断等领域也起到了重要的作用。
植物组织切片方法简介植物是地球上最重要的生命体之一,它们不仅可以提供人类所需的食物和纤维,还可以提供药物和其他重要的化学物质。
研究植物的结构和功能对于我们了解植物的生长、发育和适应环境的能力至关重要。
而植物组织切片技术是研究植物结构和功能的基础,它可以帮助我们观察和分析植物细胞、组织和器官的结构和组成。
植物组织切片方法是将植物样品切成薄片,然后在显微镜下观察。
这种方法可以用于研究植物的各个方面,包括根、茎、叶、花和果实等。
在进行植物组织切片之前,需要采集植物样品并进行处理。
处理的方式取决于要研究的组织类型和目的。
以下是一些常用的植物组织切片方法:1. 剥离法剥离法是一种简单的植物组织切片方法,适用于研究表皮、叶片和茎皮等表层组织。
首先,将植物样品放入一些蒸馏水中,使其软化。
然后,用镊子或刀片轻轻地将表皮或皮层剥离下来,再将其放在载玻片上,用显微镜观察。
2. 横切法横切法是一种常用的植物组织切片方法,适用于研究茎、根和叶等器官的内部组织结构。
首先,将植物样品固定在一些化学试剂中,如福尔马林或乙醛等。
然后,用刀片将样品切成横截面,将切片放在载玻片上,进行染色和显微镜观察。
3. 纵切法纵切法是一种用于研究植物器官内部结构的方法,适用于研究茎、根和叶等器官。
首先,将植物样品固定在一些化学试剂中,然后用刀片将样品切成纵截面,将切片放在载玻片上,进行染色和显微镜观察。
4. 整体染色法整体染色法是一种将整个植物器官染色的方法,适用于研究植物器官的形态和结构。
将植物样品浸泡在一些染料中,如苏木精和伊红等,然后用酒精和二甲苯等溶剂进行脱水和透明处理,最后将样品置于载玻片上进行显微镜观察。
总之,植物组织切片方法是研究植物结构和功能的基础,它可以帮助我们观察和分析植物细胞、组织和器官的结构和组成。
不同的组织类型和目的需要采用不同的处理方法和切片方法。
因此,在进行植物组织切片之前,需要仔细选择合适的方法和技术,并遵循正确的操作步骤和安全措施,以确保得到准确、可靠和有意义的结果。