热统第三章
- 格式:ppt
- 大小:1.00 MB
- 文档页数:44

§3.1 热动平衡判据当均匀系统与外界达到平衡时,系统的热力学参量必须满足一定的条件,称为系统的平衡条件。
这些条件可以利用一些热力学函数作为平衡判据而求出。
下面先介绍几种常用的平衡判据。
oisd一、平衡判据1、熵判据熵增加原理,表示当孤立系统达到平衡态时,它的熵增加到极大值,也就是说,如果一个孤立系统达到了熵极大的状态,系统就达到了平衡态。
于是,我们就能利用熵函数的这一性质来判定孤立系统是否处于平衡态,这称为熵判据。
孤立系统是完全隔绝的,与其他物体既没有热量的交换,也没有功的交换。
如果只有体积变化功,孤立系条件相当与体积不变和内能不变。
因此熵判据可以表述如下:一个系统在体积和内能不变的情形下,对于各种可能的虚变动,平衡态的熵最大。
在数学上这相当于在保持体积和内能不变的条件下通过对熵函数求微分而求熵的极大值。
如果将熵函数作泰勒展开,准确到二级有d因此孤立系统处在稳定平衡态的充分必要条件为既围绕某一状态发生的各种可能的虚变动引起的熵变,该状态的熵就具有极大值,是稳定的平衡状态。
如果熵函数有几个可能的极大值,则其中最大的极大相应于稳定平衡,其它较小的极大相应于亚稳平衡。
亚稳平衡是这样一种平衡,对于无穷小的变动是稳定是,对于有限大的变动是不稳定的。
如果对于某些变动,熵函数的数值不变,,这相当于中性平衡了。
熵判据是基本的平衡判据,它虽然只适用于孤立系统,但是要把参与变化的全部物体都包括在系统之内,原则上可以对各种热动平衡问题作出回答。
不过在实际应用上,对于某些经常遇到的物理条件,引入其它判据是方便的,以下将讨论其它判据。
2、自由能判据表示在等温等容条件下,系统的自由能永不增加。
这就是说,处在等温等容条件下的系统,如果达到了自由能为极小的状态,系统就达到了平衡态。
我们可以利用函数的这一性质来判定等温等容系统是否处于平衡态,其判据是:系统在等温等容条件下,对于各种可能的变动,平衡态的自由能最小。
这一判据称为自由能判据。









第三章 单元系的相变习题3.2试由0>v C 及0)(<∂∂T V p 证明0>p C 及0)(<∂∂S Vp 。
证: 由式(2.2.1) T C C V p =-⇒V T p ⎪⎭⎫ ⎝⎛∂∂ pT V ⎪⎭⎫ ⎝⎛∂∂ =P C p T H ⎪⎭⎫ ⎝⎛∂∂=pT S T ⎪⎭⎫ ⎝⎛∂∂;=V C V T U ⎪⎭⎫ ⎝⎛∂∂V T S T ⎪⎭⎫ ⎝⎛∂∂= =dp dV V p T ⎪⎭⎫ ⎝⎛∂∂dT T p V⎪⎭⎫ ⎝⎛∂∂+ =dp +⎪⎭⎫ ⎝⎛∂∂dV V p S dS S p V⎪⎭⎫ ⎝⎛∂∂ =+⎪⎭⎫ ⎝⎛∂∂dV V p S VS p ⎪⎭⎫ ⎝⎛∂∂⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂dT T S dV V S V T ⇒=⎪⎭⎫ ⎝⎛∂∂T V p VS p ⎪⎭⎫ ⎝⎛∂∂T V S ⎪⎭⎫ ⎝⎛∂∂+S V p ⎪⎭⎫ ⎝⎛∂∂ (1) =⎪⎭⎫ ⎝⎛∂∂V T p V S p ⎪⎭⎫ ⎝⎛∂∂TT S ⎪⎭⎫ ⎝⎛∂∂ (2) 由麦氏关系(2.2.3)代入(1)式中 ⇒=⎪⎭⎫ ⎝⎛∂∂S V T -VS p ⎪⎭⎫ ⎝⎛∂∂ ⇒=⎪⎭⎫ ⎝⎛∂∂T V p -⎪⎭⎫ ⎝⎛∂∂S V p S V T ⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂T V S -⎪⎭⎫ ⎝⎛∂∂SV p ()()⋅∂∂S V S T ,,()()T V T S ,,∂∂ =+⎪⎭⎫ ⎝⎛∂∂S V p ()()⋅∂∂T V S T ,,()()⋅∂∂S V T V ,,()()T V S T ,,∂∂ =+⎪⎭⎫ ⎝⎛∂∂S V p ()()⋅∂∂S V T V ,,()()2,,⎥⎦⎤⎢⎣⎡∂∂T V S T =+⎪⎭⎫ ⎝⎛∂∂S V p V S T ⎪⎭⎫ ⎝⎛∂∂()()2,,⎥⎦⎤⎢⎣⎡∂∂T V S T 由式(2.2.5) ⇒V C V T S T ⎪⎭⎫ ⎝⎛∂∂=;即0>=⎪⎭⎫ ⎝⎛∂∂V V C T S T .于是: 0>=⎪⎭⎫ ⎝⎛∂∂T V p +⎪⎭⎫ ⎝⎛∂∂SV p 正数 于是: SV p ⎪⎭⎫ ⎝⎛∂∂<0 =P C P T S T ⎪⎭⎫ ⎝⎛∂∂()()=∂∂=p T p S T ,,()()⋅∂∂V S p S T ,,()()=∂∂p T V S ,,⋅⎪⎭⎫ ⎝⎛∂∂S V p T ()()p T V S ,,∂∂ ⋅⎪⎭⎫ ⎝⎛∂∂=S V p T ()()⋅∂∂V T V S ,,()()=∂∂p T V T ,,⋅⎪⎭⎫ ⎝⎛∂∂S V p T VT S ⎪⎭⎫ ⎝⎛∂∂Tp V ⎪⎪⎭⎫ ⎝⎛∂∂⋅ ⋅⎪⎭⎫ ⎝⎛∂∂=S V p V TC p V ⋅⎪⎪⎭⎫ ⎝⎛∂∂ 0>V C ; 因而0>P C 习题3.4 求证:(1)-=⎪⎭⎫ ⎝⎛∂∂n V T ,μV T n S ,⎪⎭⎫ ⎝⎛∂∂;(2)-=⎪⎪⎭⎫ ⎝⎛∂∂nT p ,μp T n V ,⎪⎭⎫ ⎝⎛∂∂ 证: (1) 开系吉布斯自由能dn Vdp SdT dG μ++-= , ),(T V p p = ⇒dn dT T p dV V p V SdT dG V Tμ+⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂+-= dn dV V P V dT T P V S n T n V μ+⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+-= ⇒V S T G n V +-=⎪⎭⎫ ⎝⎛∂∂,VT p ⎪⎭⎫ ⎝⎛∂∂ ① V V G nT =⎪⎭⎫ ⎝⎛∂∂,T V p ⎪⎭⎫ ⎝⎛∂∂ ② μ=⎪⎭⎫ ⎝⎛∂∂VT n G , ③ 由式 ① ⇒n V n V T G T p V S ,⎪⎭⎫ ⎝⎛∂∂-⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂=V T n S ,⎪⎭⎫ ⎝⎛∂∂⇒VT n V n T G ,,⎪⎪⎪⎪⎪⎭⎫ ⎝⎛∂⎥⎥⎦⎤⎢⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂∂-=V n T G ⎪⎪⎭⎫ ⎝⎛∂∂∂-=2V T n G ⎪⎪⎭⎫ ⎝⎛∂∂∂-=2 VT n S ,⎪⎭⎫ ⎝⎛∂∂n V T ,⎪⎭⎫ ⎝⎛∂∂-=μ 第(1)式得证。
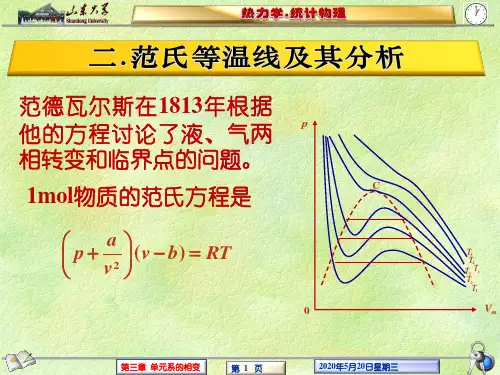
第三章 单元复相系总结组别:第二组 组长:胡娟秀 组员:仓荣琴、宋莹珊、字艳美 汇报人:仓荣琴3.1热动平衡的判据1、热动平衡判据 (1)熵判据等v 等u 条件下,孤立系统处在稳定平衡状态的充要条件:0<∆s 平衡条件: 稳定平衡条件:02<S δ (2)自由能判据等v 等T 条件下,孤立系统处在稳定平衡状态的充要条件:0>∆F平衡条件:0=F δ 稳定平衡条件:02>F δ (3)吉布斯函数等T 等P 条件下,孤立系统处在稳定平衡状态的充要条件:0>∆G平衡条件:0=G δ 稳定条件:02>G δ0=S δ3.2开系的热力学基本方程1、开系的五个热力学方程dU TdS PdV dn dH TdS VdP dn dF SdT PdV dn dG SdT VdP dn dJ SdT PdV nd μμμμμ=-+=++=--+=-++=--- 2、化学势,m T PG G n μ∂⎛⎫==⎪∂⎝⎭ 3、巨热力势 定义式:J F n μ=-全微分是:dJ SdT PdV nd μ=---3.3单元系的复相平衡条件1、单元二相系的平衡条件平衡条件为:,,T T P P αβαβαβμμ=== 2、单元复相系的平衡条件 热学平衡条件:T T T αβγ==力学平衡条件:P P P αβγ==化学平衡条件(相平衡条件):αβγμμμ==3、利用熵增加原理对孤立系统各相之间趋于平衡的过程进行分析 (1)若热平衡条件未达条件到,T T αβ>,0U αδ<,Q 从αβ→ (2)若热平衡条件达到,力学平衡条件未达到,当P P αβ>,0V αδ>,α相体积膨胀,β相体积被压缩。
(3)若热平衡条件达到,化学平衡条件未达到,0U U n TT αβααβδ⎛⎫--> ⎪⎝⎭,U U αβ>,0n αδ<物质由αβ→(α相0n α<,β相0n βδ>)3.4复相系的平衡性质1、单元复相系的平衡汽化曲线:μL =μG熔化曲线:μS =μL 升华曲线:μS =μG ⇒三相平衡:μL =μS =μG2、相图的热力学解释(1)在一定温度和压强下,系统的平衡状态---化学势最小 (2)若在某一温度和压强范围内,α相的化学势低于其他相的化学势,那么系统以α相单独存在(3)单元系两相平衡共存时,两相平衡曲线方程 T α=T β=TP α=P β=P μα=μβ=μ3、克拉珀龙方程dp dT =L T (V mβ−V m α)物理意义:给出两相平衡曲线的斜率dpdT<0冰的熔点随压强的变化dp>0水的沸点随压强的变化3.5 临界点和气液两相的转变1.范德瓦耳斯气体物态方程:(2)()m m ap V b RT V +-= 2.c T ,c p ,mc V 的确定 等温线上极大值点N 点, ()0T m pV ∂=∂,22()0T m P V ∂<∂极小值点J 点,()0T m pV ∂=∂,22()0T mP V ∂>∂当温度升高,N 和J 逐渐靠近;温度继续升高,c T T =时,N 和J 重合,形成拐点,则()0T m p V ∂=∂,22()0T m P V ∂=∂ 利用范氏方程,可得827c a T Rb =,227c ap b =,3mc V b = c T ,c p ,mc V 的关系:83c c mc RT p V =3.7 相变的分类1、一级相变及其特点:(1)相变点两相的化学势连续),(),(P T U P T U βα=(2)相变点两相的化学势的一阶偏导发生突变TT ∂∂≠∂∂)()(βαμμ, pp ∂∂≠∂∂)()(βαμμ 特点:(1)两相存在各自的非奇异化学势函数,在相变点两相的化学势相等;(2)在相变点两相平衡共存;(3)在相变点两相化学势的一级偏导不相等,存在相变潜热和体积突变;(4)在相变点两侧,化学势低的是稳定相,较高的为亚稳相。