第四章多组分系统热力学习题
- 格式:ppt
- 大小:628.50 KB
- 文档页数:24
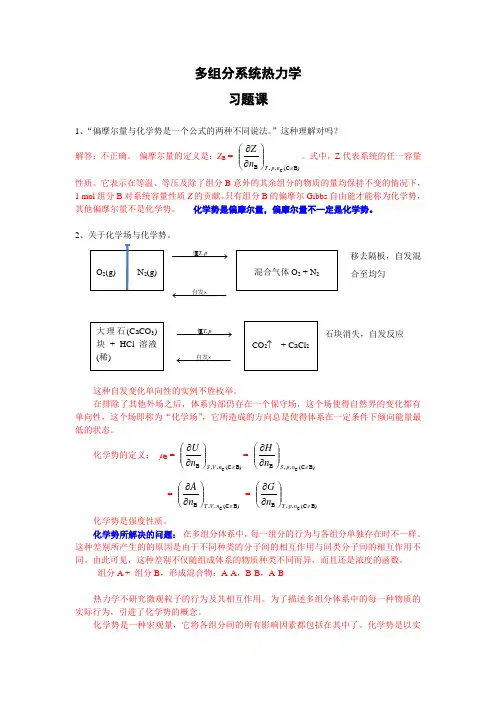
多组分系统热力学习题课1、“偏摩尔量与化学势是一个公式的两种不同说法。
”这种理解对吗? 解答:不正确。
偏摩尔量的定义是:Z B = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n Z 。
式中,Z 代表系统的任一容量性质。
它表示在等温、等压及除了组分B 意外的其余组分的物质的量均保持不变的情况下,1 mol 组分B 对系统容量性质Z 的贡献。
只有组分B 的偏摩尔Gibbs 自由能才能称为化学势,其他偏摩尔量不是化学势。
化学势是偏摩尔量,偏摩尔量不一定是化学势。
2、关于化学场与化学势。
−−−−→−pT,恒 移去隔板,自发混合至均匀−−−−−←⨯自发−−−−→−pT,恒 石块消失,自发反应 −−−−−←⨯自发这种自发变化单向性的实例不胜枚举。
在排除了其他外场之后,体系内部仍存在一个保守场,这个场使得自然界的变化都有单向性,这个场即称为“化学场”,它所造成的方向总是使得体系在一定条件下倾向能量最低的状态。
化学势的定义: μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV S n U = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np S n H= B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV T n A = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G化学势是强度性质。
化学势所解决的问题: 在多组分体系中,每一组分的行为与各组分单独存在时不一样。
这种差别所产生的的原因是由于不同种类的分子间的相互作用与同类分子间的相互作用不同。
由此可见,这种差别不仅随组成体系的物质种类不同而异,而且还是浓度的函数。
组分A + 组分B ,形成混合物:A-A ,B-B ,A-B热力学不研究微观粒子的行为及其相互作用。
为了描述多组分体系中的每一种物质的实际行为,引进了化学势的概念。
化学势是一种宏观量,它将各组分间的所有影响因素都包括在其中了。
化学势是以实际应用为背景引入的一个概念,有很强的实践性。
化学势的物理意义:μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G = 偏摩尔Gibbs 自由能G B它表示在T 、p 和其他组分的含量不变的条件下,增加1 mol 组分B 对于体系总Gibbs自由能的贡献。

二、概念题 题号 1 2 3 4 5 6 7 8 选项 C A B C B D B B 题号 9 10 11 12 13 14 15 选项B DC A A C D1. 2 mol A 物质和3 mol B 物质在等温、等压下,混合形成理想液态混合物,该系统中A 和B 的偏摩尔体积分别为1.79×10-5 m 3⋅mol -1,2.15×10-5 m 3⋅mol -1 ,则混合物的总体积为( )。
(A )9.67×10-5 m 3 (B )9.85×10-5 m 3 (C )1.003×10-4 m 3 (D )8.95×10-5 m 3 答:(C )运用偏摩尔量的集合公式(B B A A V n V n V+=)。
2. 下列偏微分中,能称为偏摩尔量的是( )。
(A )()C B C B T p n V n ≠⎛⎞∂⎜⎟∂⎝⎠,,(B )()C B C B S p n H n ≠⎛⎞∂⎜⎟∂⎝⎠,, (C )()CB C B p V nG n ≠⎛⎞∂⎜⎟∂⎝⎠,, (D )()CB C B T H nS n ≠⎛⎞∂⎜⎟∂⎝⎠,,答:(A )偏摩尔量定义。
()C B C B T p n X X n ≠⎛⎞∂=⎜⎟∂⎝⎠,, 3. 下列偏微分中,不是化学势的是( )。
(A )C ,,(C B)B ()S V n Un ≠∂∂ (B )()CB C B T p nH n ≠⎛⎞∂⎜⎟∂⎝⎠,,(C )C ,,(C B)B()T p n G n ≠∂∂ (D )C ,,(C B)B (T V n A n ≠∂∂答:(B )广义的化学式:C C C C B ,,(C B),,(C B),,(C B),,(C B)B B B B()()()()S V n S p n T V n T p n U H A Gn n n n μ≠≠≠≠∂∂∂∂====∂∂∂∂4. 已知373 K 时,液体A 的饱和蒸气压为133.24 kPa ,液体B 的饱和蒸气压为66.62 kPa 。



第四章多组分体系热力学一、选择题1. 在298K时,A和B两种气体单独溶解在某一溶剂中,均遵守亨利定律,亨利常数分别为kА和k B,且知kА> k B,则当A和B的平衡压力相同时,在一定量的该溶剂中所溶解的关系为( ) (A) A 的量大于 B 的量;(B) A 的量小于 B 的量;(C) A 的量等于 B 的量;(D) A 的量与 B 的量无法比较。
2. 在恒温抽空的玻璃罩中封入二杯液面相同的糖水 (A) 和纯水 (B)。
经历若干时间后,二杯液面的高度将是:( )(A) A 杯高于 B 杯; (B) A 杯等于 B 杯; (C) A 杯低于 B 杯;(D) 视温度而定。
3. 在温度T时,纯液体A的饱和蒸气压为P A*,化学势为μA*,并且已知在P⊖压力下的凝固点为T f*,当A 中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为P、μA、T f则( ) (A) P < P,μA*<μA ,T f*< T f(B) P A*> P A ,μA*<μA ,T f*< T f(C) P < P,μA*<μA ,T f*> T f(D) P A*> P A ,μA*>μA , T f*> T f4.已知在 373K 时液体A 的饱和蒸气压为66662Pa,液体B的饱和蒸气压为1.01325×105 Pa,设 A 和 B 构成理想液体混合物,则当A在溶液中的物质的量分数为0.5 时,气相 A 的物质的量分数应为:( )(A) 0.200 (B) 0.300 (C) 0.397 (D) 0.6035. 对于理想液体混合物,下列偏微商小于零的是:(A) [∂(△mix F m)/ ∂T]p(B) [∂(△mix S m)/ ∂T]p(C) [∂ (△mix G m)/T]/ ∂T]p(D) [∂ (△mix G m)/ ∂P]T6. 假设A、B 二组分混合可以形成理想液体混合物,则下列叙述中不正确的是:( )(A)A、B 分子之间的作用力很微弱;(B) A、B 都遵守拉乌尔定律;(C) 液体混合物的蒸气压介于A、B 的蒸气压之间;(D) 可以用重复蒸馏的方法使A、B 完全分离。

第四章多组分系统热力学练习1 题及答案.第四章多组分系统热力学练习1题及答案.第四章多组分系统热力学练习题及答案1.20 C下HCl溶于苯中达平衡,气相中HCl的分压为101.325 kPa时,溶液中HCl的摩尔分数为0.0425。
已知20 ?C时苯的饱和蒸气压为10.0 kPa,若20?C 时HCl和苯蒸气总压为101.325 kPa,求100 g笨中溶解多少克HCl。
解:设HCl在苯中的溶解符合Henry定律2.60 ?C时甲醇的饱和蒸气压是84.4 kPa,乙醇的饱和蒸气压是47.0 kPa。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60 ?C 时此混合物的平衡蒸气组成,以摩尔分数表示。
解:质量分数与摩尔分数的关系为求得甲醇的摩尔分数为根据Raoult定律3.80 ?C是纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80 ?C时气相中苯的摩尔分数,求液相的组成。
解:根据Raoult定律t时纯AB,两液体能形成理想液态混合物。
已知在温度的饱和蒸气压A4.。
的饱和蒸气压B,纯t下,于气缸中将组成为的A, B(1)在温度混合气体恒温缓慢压缩,求凝结出第一滴微小液滴时系统的总压及该液滴的组成(以摩尔分数表示)为多少?t下开始沸腾,,温度两液体混合,并使此混合物在100 kPa2)若将A, B(求该液态混合物的组成及沸腾时饱和蒸气的组成(摩尔分数)。
解:1. 由于形成理想液态混合物,每个组分均符合Raoult定律; 2. 凝结出第t一滴微小液滴时气相组成不变。
因此在温度t 100 kPa,温度下开始沸腾,要求混合物在5. 已知101.325kPa下,纯苯(A)的正常沸点和摩尔蒸发焓分别为353.3K和?1,纯甲苯(B)的正常沸点和摩尔30762J·mol蒸发焓分别为383.7K和?1。

第四章,多组分系统热力学一、选择题1. 在 298K 时,A 和 B 两种气体单独在某一溶剂中溶解,遵守亨利定律,亨利常数分别为 kA 和 KB,且知 KA>KB,则当 A 和 B 压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为 ( ) B (A) A 的量大于 B 的量 (B) A 的量小于 B 的量(C) A 的量等于 B 的量 (D) A 的量与 B 的量无法比较2. 在 400K 时,液体 A 的蒸气压为 4×104Pa,液体 B 的蒸气压为 6×104Pa,两者组成理想液体混合物,平衡时,溶液中 A 的物质的量分数为 0.6,则气相中 B 的物质的量分数为: ( ) B(A) 0.60 (B) 0.50 (C) 0.40 (D) 0.313. 已知挥发性纯溶质 A 液体的蒸气压为 67 Pa,纯溶剂 B 的蒸气压为 26665Pa,该溶质在此溶剂的饱和溶液的物质的量分数为 0.02,则此饱和溶液(假设为理想液体混合物)的蒸气压为:( ) C(A) 600 Pa (B) 26198 Pa (C) 26133 Pa (D) 599 Pa4. 已知 373.2K 时,液体 A 的饱和蒸气压为 133.32 kPa,另一液体 B 可与 A构成理想液体混合物。
当 A 在溶液中的物质的量分数为 0.5 时,A 在气相中的物质量分数为 2/3 时,则在 373.2K时,液体 B 的饱和蒸气压应为: ( ) A(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa5. 已知 373K 时液体 A 的饱和蒸气压为 133.24kPa,液体 B 的饱和蒸气压为66.62kPa。
设 A 和 B形成理想溶液,当 A 在溶液中的摩尔分数为 0.5 时,在气相中 A 的摩尔分数为: ( ) D(A) 1 (B) 1/2 (C) 1/3 (D) 2/36. 关于亨利系数,下列说法中正确的是: ( ) D(A) 其值与温度、浓度和压力有关(B) 其值与温度、溶剂性质和浓度有关(C) 其值与温度、溶质性质和浓度有关(D) 其值与温度、溶质和溶剂性质及浓度的标度有关7. 已知 373K 时,液体 A 的饱和蒸气压为 5×104 Pa,液体 B 的饱和蒸气压为 105Pa,A 和 B构成理想液体混合物,当 A 在溶液中的物质的量分数为 0.5时,气相中 B 的物质的量分数为:( ) A(A) 1/1.5 (B) 1/2 (C) 1/2.5 (D) 1/38.2molA物质和3molB物质在等温、等压下,混合形成理想液态混合物,该系统中A和B的偏摩尔体积分别为1.79×10-5m3×mol-1,2.15×10-5m3×mol-1,则混合物的总体积为:() C(A)9.67×10-5m3 (B)9.85×10-5m3(C)1.003×10-4m3 (D)8.95×10-5m39.298K,标准压力下,苯和甲苯形成理想液态混合物。

第四章多组分系统热力学选择题1. 在和101325Pa•下水的化学势与水蒸气化学位的关系为(A) μ(水)=μ(汽) (B) μ(水)<μ(汽)(C) μ(水)>μ(汽) (D) 无法确定答案:A。
两相平衡,化学势相等。
2.下列哪种现象不属于稀溶液的依数性(A) 凝固点降低(B)沸点升高(C) 渗透压(D)蒸气压升高^答案:D。
稀溶液的依数性之一为蒸气压下降。
3.98K时,A、B两种气体在水中的亨利常数分别为k1和k2,且k1>k2,则当P1=P2时,A、B在水中的溶解量C1 和C2 的关系为(A) C1>C2 (B) C1<C2 (C) C1=C2 (D) 不能确定答案:B4.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起(A) 沸点升高(B) 熔点升高(C) 蒸气压升高(D) 都不对答案:A。
稀溶液的依数性包括沸点升高、凝固点下降、蒸气压下降和渗透压。
5. 涉及纯物质标准状态的下列说法中不正确的是(A) 纯理想气体的标准状态就是标准压力P(100KPa)下的状态(B) 纯液体物质的标准状态就是标准压力P(100KPa)下的纯液体—(C) 纯固体物质的标准状态就是标准压力P(100KPa)下的纯固体(D) 不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同答案:D6. 稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它们有关,其中正确的是(A) 只有溶质不挥发的稀溶液才有这些依数性(B) 所有依数性都与溶液中溶质的浓度成正比(C) 所有依数性都与溶剂的性质无关(D) 所有依数性都与溶质的性质有关答案:B7. 关于亨利系数, 下面的说法中正确的是!(A) 其值与温度、浓度和压力有关(B) 其值只与温度、溶质性质和浓度标度有关(C) 其值与溶剂性质、温度和浓度大小有关(D) 其值与温度、溶剂和溶质的性质及浓度标度等因素都有关答案:D8. 定义偏摩尔量时规定的条件是(A) 等温等压 (B) 等熵等压(C) 等温, 溶液浓度不变 (D) 等温等压, 溶液浓度不变答案:D9. 关于偏摩尔量, 下面的说法中正确的是~(A) 偏摩尔量的绝对值都可求算(B) 系统的容量性质才有偏摩尔量(C) 同一系统的各个偏摩尔量之间彼此无关(D) 没有热力学过程就没有偏摩尔量答案:B10. 关于偏摩尔量, 下面的叙述中不正确的是(A) 偏摩尔量是状态函数, 其值与物质的数量无关(B) 系统的强度性质无偏摩尔量(C) 纯物质的偏摩尔量等于它的摩尔量(D) 偏摩尔量的数值只能为整数或零-答案:D11. 影响沸点升高常数和凝固点降低常数值的主要因素是(A) 溶剂本性 (B) 温度和压力 (C )溶质本性(D) 温度和溶剂本性答案:A 。

第四章多组分系统热力学及其在溶液中的应用一、选择题1.已知373K时液体A的饱和蒸气压为105Pa,液体B的饱和蒸气压为0.5⨯105Pa。
设A和B构成理想溶液,则当A在溶液中的摩尔分数为0.5时,在气相中A的摩尔分数为()。
(a)1 (b)1/2 (c)2/3 (d)1/32.273.15K,101325Pa下,1dm3水中能溶解49mol氧或23.5mol氮,在标准情况下,1dm3水中能溶解的空气的量为()。
(a)25.5mol (b)28.6mol (c)96mol (d)72.5mol3.一封闭钟罩中放一杯纯水A和一杯糖水B,静置足够长时间后发现()。
(a)A杯水减少,B杯水满后不再变化(b)A杯水减少至空杯,B杯水满后溢出(c) B杯水减少,A杯水满后不再变化(d) B杯水减少至空杯,A杯水满后溢出4.在某温度下,当B溶解于A中形成溶液时,若纯B的摩尔体积大于溶液中B的偏摩尔体积时,(设B的偏摩尔体积大于零),若增加压力则B在A中的溶解度将( ):(a) 增大(b)减小(c) 不变(d)不确定5.温度为273K,压力为1⨯106Pa下液态水和固态水的化学势μ(l)和μ(s)之间的关系为()。
(a)μ(l)>μ(s)(b)μ(l)=μ(s)(c)μ(l)<μ(s)(d)无确定关系6.在等温、等压下,溶剂A和溶质B形成一定浓度的稀溶液,采用不同浓度表示的话,则()。
(a)溶液中A和B的活度不变(b)溶液中A和B的标准化学势不变(c)溶液中A和B的活度因子不变(d)溶液中A和B的化学势值不变7.有一稀溶液质量摩尔浓度为m,沸点升高值为∆T b,凝固点降低值为∆T f,则()。
(a)∆T f >∆T b(b)∆T f =∆T b(c)∆T f <∆T b(d)无确定关系8.有四杯含不同溶质相同质量摩尔浓度(m=1mol⋅kg-1)的水溶液,分别测定其沸点,沸点升高最多的是()。


第四章 多组分系统热力学及其在溶液中的应用自测题和答案Ⅰ. 选择题1. 恒温时,在A -B 双液系中,若增加A 组分使其分压p A 上升,则B 组分在气相中的分压p A 将( b )。
(a )上升 (b )下降 (c )不变 (d )不确定 2. 一直 373 K 时液体A 的饱和蒸汽压为105 Pa ,液体B 的饱和蒸汽压为 0.5×105Pa 。
设A 和B 构成理想溶液,则当A 在溶液中的摩尔分数为0.5时,在气相中A 的摩尔分数为( c )。
(a )1 (b )12 (c )23 (d )133. 273.15 K ,101 325 Pa 下,1 dm 3 水中能溶解49 mol 氧或23.5 mol 氮,在标准情况下,1 dm 3 水中能溶解的空气的量为( b )(a )25.5 mol (b )28.6 mol (c )96 mol (d )72.5 mol4. 一封闭钟罩中放一杯纯水A 和一杯糖水B,静置足够长时间后发现( b )。
(a )A 杯水减少,B 杯水满后不再变化 (b )A 杯水减少至空杯,B 杯水满后溢出 (c )B 杯水减少,A 杯水满后不再变化 (d )B 杯水减少至空杯,A 杯水满后溢出5. 保持压力不变,在稀溶液中溶剂的化学势μ随温度降低而( c )。
(a )降低 (b )不变 (c )增大 (d )不确定 6. 温度为273 K ,压力为1×106 Pa 下液态水和固态水的化学势(l)μ和(s)μ之间的关系为( c )。
(a )(l)(s)μμ> (b )(l)=(s)μμ (c )(l)(s)μμ< (d ) 无确定关系7. 在等温、等压下,溶剂A 和溶质B 形成一定浓度的稀溶液,采用不同浓度表示的话,则( d )。
(a )溶液中A 和B 的活度不变(b )溶液中A 和B 的标准化学势不变 (c )溶液中A 和B 的活度因子不变 (d )溶液中A 和B 的化学势值不变 8. 有一稀溶液质量摩尔浓度为m ,沸点升高为b T ∆,凝固点降低值为f T ∆,则( a )。
第四章 多组分系统热力学及其在溶液中的作用一、选择题1、对于偏摩尔量,指出下列说法错误者( )(1)偏摩尔量必须有恒温恒压条件;(2)偏摩尔量不随各组分浓度的变化而变化;(3)偏摩尔量不随温度T 和压力p 的变化而变化;(4)偏摩尔量不但随温度T 、压力p 的变化而变化,而且也随各组分浓度变化而变化。
(A) (2) (4) (B) (3) (4) (C) (2) (3) (D) (1) (4)2、1 mol A 与n mol B 组成的溶液,体积为0.65dm 3,当x B = 0.8时,A 的偏摩尔体积 V A = 0.090dm 3·mol -1,那么B 的偏摩尔V B 为:( )(A) 0.140 dm 3·mol -1 (B) 0.072 dm 3·mol -1(C) 0.028 dm 3·mol -1 (D) 0.010 dm 3·mol -13、在恒温恒压下形成理想液体混合物的混合吉布斯自由能Δmix G ≠ 0,恒温下Δmix G 对温度T 进行微商,则: ( )(A) (∂Δmix G/∂T)T < 0 (B) (∂Δmix G/∂T)T > 0(C) (∂Δmix G/∂T)T = 0 (D) (∂Δmix G/∂T)T ≠ 04、在恒定温度与压力p 下,理想气体A 与B 混合后,说法中正确的是( )(1)A 气体的标准态化学势不变;(2)B 气体的化学势不变 ;(3)当A 气体的分压为p A 时,其化学势的改变量为ΔμA =RTln(p A /p ø);(4)当B 气体的分压为p B 时,其化学势的改变量为ΔμB =-RTln(p B /p*)。
(A) (B) (1) (2) (B) (1) (3) (C) (2) (4) (D) (3) (4)5、下列各式中哪个是化学势( )(A) ()j n ,V ,T i n U/∂∂ (B)()j n ,V ,T i n H/∂∂(C) ()j n ,V ,T i n A/∂∂ (D) ()j n ,V ,T i n G/∂∂6、在293K 时,从一组成为NH 3·19/2 H 2O 的大量溶液中取出1molNH 3往另一组成为NH 3·21H 2O 的溶液中转移,此过程的Δμ的表达式为: ( )(A)Δμ=RTln(2/19) (B)Δμ=RTln(1/22)(C)Δμ=RTln(21/44) (D)Δμ=RTln(44/21)7、已知水的两种状态A(373K ,101.3kPa ,g),B(373K ,101.3kPa ,l),则与的关系为: ( )(A)μA=μB(B)μA>μB(C)(D)μA<μB(D)两者不能比较8、过饱和溶液中溶剂的化学势比纯溶剂的化学势()(A)高(B)低(C)(D)相等(D)0.569、关于亨利定律,下面的表述中不正确的是:( )(A)若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分B必遵从亨利定律(B)温度越高、压力越低,亨利定律越正确(C)因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律(D)温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关10、下列气体溶于水溶剂中,哪个气体不能用亨利定律:()(A)N2 (B)O2 (C)NO2 (D)CO11、溶剂服从拉乌尔定律及溶质服从亨利定律的二元溶液是( )(A)理想混合物(B)实际溶液(C)理想稀溶液(D)胶体溶液12、当不挥发的溶质溶于溶剂形成溶液后,溶液的蒸气压( )(A)升高(B)不变(C)降低(D)升高、降低不一定13、在一定温度下,若等物质的量的A、B两液体形成理想液体混合物,且纯A的饱和蒸气压p A*大于纯B的饱和蒸气压p B*,则( )(A)y A<x A(B)y A>x A(C)y A=x A(D)无法确定y A、x A的大小14、拉乌尔定律适用于( )(A)非理想溶液中的溶剂(B)稀溶液中的溶质;(C)稀溶液中的溶剂(D)稀溶液中的溶剂及溶质15、在恒温抽空的玻璃罩中封入两杯液面相同的糖水(A) 和纯水(B)。
第四章多组分系统热力学2物化习题一判断题1、在101.3Kpa下,往纯水中加入少量NaCl,与纯水比较,此稀溶液沸点升高。
()2、偏摩尔量集合公式Z=∑nBzB,m适用条件是恒温过程。
()恒温恒压过程3、Henry系数K某,B只与溶剂溶质性质有关,而与温度无关。
()温度不同,亨利系数不同。
温度升高,系数升高。
4、沸点升高系数Kb的数值与溶剂、溶质的性质有关,且与温度有关。
()Kb的量仅与溶剂的性质有关5.、若A分子和B分子之间的相互作用力,与A,B各自处于纯态时分子之间的相处作用力相同,混合后,则有⊿Hmin=0.()6、标准就态是认为规定的某些特定状态。
()7、理想溶液中,各种微粒间的相互作用力可忽略不计。
()处于凝聚态的分子,其分子间的距离很小,分子间的相互作用力和分子的体积均不能忽略。
8、一切纯物质的凝固点都随外压的增大而上升。
()9、稀溶液的非典一定比纯溶剂的沸点高。
()在同一外压条件下10、在相同温度和压力下,相同质量摩尔浓度的葡萄糖和食盐水的渗透压不相同。
()Ⅱ=CbRT,溶液的渗透压的大小只由溶液中的溶质的浓度决定,而与溶质的本性无关。
11、摩尔分数和质量摩尔浓度与温度无关,而物质的量浓度与温度有关()12、在相平衡中,若各相中均有组分B,则组分B在个相中的化学势一定相等。
()系统处于相平衡,由于系统任一组分B在其存在的每个相中的化学势相等。
13、溶剂中融入挥发性溶质,肯定会引起溶液的蒸汽压升高。
()14、二组分理想液态混合物的总蒸汽压大于任一组分的蒸汽压。
()处于中间态。
15、只有广度性质才有偏摩尔量。
()16、凡是自由能降低的过程一定都是自发过程。
()17、拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。
()18、偏摩尔量因为与浓度有关,因此它不是一个强度性质。
()19、某一体系达平衡时,熵最大,自由能最小。
()20、在一个多组分溶液中,只有溶质才有偏摩尔量。
()21、封闭系统中,由状态1经定温、定压过程变化到状态2,非体积功W′>△G和△G﹤0,则此过程一定能发生。
第四章多组分系统热力学练习题及答案课件习题:333K时苯胺(A)和水(B)的蒸气压分别为0.760和19.9kPa,在此温度苯胺和水部分互溶形成两相,苯胺在两相中的摩尔分数分别为0.732(苯胺层中)和为0.088(水层中)。
试求苯胺和水的亨利常数。
假设每一相中溶剂遵守拉乌尔定律,溶质遵守亨利定律。
1.20 ︒C下HCl溶于苯中达平衡,气相中HCl的分压为101.325 kPa时,溶液中HCl的摩尔分数为0.0425。
已知20 ︒C时苯的饱和蒸气压为10.0 kPa,若20︒C 时HCl和苯蒸气总压为101.325 kPa,求100 g笨中溶解多少克HCl。
2.60 ︒C时甲醇的饱和蒸气压是84.4 kPa,乙醇的饱和蒸气压是47.0 kPa。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60 ︒C 时此混合物的平衡蒸气组成,以摩尔分数表示。
3.80 ︒C是纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80 ︒C时气相中苯的摩尔分数,求液相的组成。
4. A,B两液体能形成理想液态混合物。
已知在温度t时纯A的饱和蒸气压,纯B的饱和蒸气压。
(1)在温度t下,于气缸中将组成为的A, B混合气体恒温缓慢压缩,求凝结出第一滴微小液滴时系统的总压及该液滴的组成(以摩尔分数表示)为多少?(2)若将A, B两液体混合,并使此混合物在100 kPa,温度t下开始沸腾,求该液态混合物的组成及沸腾时饱和蒸气的组成(摩尔分数)。
5. 已知101.325kPa下,纯苯(A)的正常沸点和摩尔蒸发焓分别为353.3K和30762J·mol-1,纯甲苯(B)的正常沸点和摩尔蒸发焓分别为383.7K和31999J·mol-1。
苯和甲苯形成理想液态混合物,若有该种液态混合物在101.325kPa,373.1K沸腾,计算混合物的液相组成。
第四章多组分体系统热力学一.选择题1. 当某溶质溶于某溶剂形成一定的溶液时,若采用不同的浓标,则下列描述溶质的各说法中正确的是()A. 浓度数据相同B. 活度数据相同C. 活度因子相同D. 化学势相同2. 恒温时在A和B的二元液系中,若增加A组分使其分压p A上升,则B组分在气相中的分压p B将( )A. 上升B. 不变C. 下降D. 不确定3. 沸点升高,说明在溶剂中加入非挥发性溶质后,该溶剂的化学势与加入前比较将()A. 升高B. 不变C. 降低D. 无法确定4. 在α,β相中均含有A和B两种物质,达到相平衡时,下列各式正确的是()A. B. C. D.5. 在298.15K时0.01m ol.dm-3葡萄糖水溶液的渗透压π1,0.01m ol.dm-3硫酸钾水溶液的渗透压π2 ,下列各项正确的是( )A. B. C. D. 不能确定6. 组分B从a相扩散入β相中,则以下说法正确的有()A. 总是从浓度高的相扩散入浓度低的相B. 总是从浓度低的相扩散到浓度高的相C. 平衡时两相浓度相等D. 总是从高化学势移向底化学势7. 在363,15K,101.325kP a时水和水蒸气构成两相平衡,两相化学势的关系为()A. B. C. D. 不能确定8. 在298.15K,A和B两种气体在某种溶剂中的亨利系数分别为k A和k B并有k A>k B当A和B具有相同的分压力时,二者的浓度关系是( )A. B. C. D. 不能确定9. 对非理想液体中的溶质,当选假想的,符合亨利定律的,的状态为标准态时,下列结果正确的是( )时,时,时,时,,10. A和B形成理想溶液,已知373K时纯A的蒸气压为133.3kP a,纯 B的蒸气压为166.66kP a,与此二元溶液成平衡的气相中的摩尔分数为2/3时,溶液中A的摩尔分数为( )A.1B.2/3C. 1/2D.1/411.在298.15K,P a时某溶液中溶剂A的蒸气压为p A,化学势为u A,凝固点为T A,上述三者与纯溶剂的相比,有()12.下列活度与标准态的关系表述正确的是( )A. 活度等于1的状态必为标准态B. 活度等于1的状态与标准态的化学势相等C. 标准态的活度并不一定等于1D. 活度与标准态的选择无关13.下列关于亨利系数讨论中,不正确的是( )A. 其值因溶液组成表示方法不同而异B. 其值与温度有关C. 其值与溶剂的性质均有关D. 其值与溶质的活度有关14..对A,B二组分理想液态混合物系统中,下列说法不正确的是()A. A,B 在全部组成范围内均服从拉乌尔定律B. 该系统的沸点-组成图,液相线为直线C. 任一组分的化学势表示为D. 对任一组分均有15.在讨论稀溶液的蒸气压下降的规律时,溶质必须是()A. 挥发性溶质B.气体物质C.非挥发性溶质D. 电解质16.溶剂服从拉乌尔定律同时溶质服从亨利定律的二元溶液()A.理想稀溶液B.理想溶液C.实际溶液D.共轭溶液17..由水(1)和甲醇(2)组成的二元溶液,下列各式不是甲醇在此溶液中化学势的是()A B C18.下列关于稀溶液依数性的讨论中,不正确的是( )A. 在依数性中最灵敏的性质是渗透压B. 在依数性公式的推导中,都应用了拉乌尔定律C. 依数性都可以用来测知溶剂的不纯性D. 在依数性公式的热力学推倒中没有任何近似假定,是十分严格的19.对于二元溶液,其组分的平衡分压与组成的关系为杜亥姆- 马居尔公式:,其适用的条件为( )A. 温度和总压恒定B. 温度恒定,气相为理想气体C. 恒温D. 温度和总压恒定,并且气相为理想气体20.在298.15K时,纯丙酮的蒸气压为43kP a,在氯仿的摩尔分数为0.30的丙酮- 氯仿二元溶液上丙酮的蒸气压为26.77k P a,则此溶液( )A.为理想溶液B.对丙酮为正偏差C.对丙酮为负偏差D.以上都不对21. 1 mol A与n mol B组成的溶液,体积为0.65dm3,当x B = 0.8时,A的偏摩尔体积V A = 0.090dm3·mol-1,那么B的偏摩尔V B 为:(A) 0.140 dm3·mol-1;(B) 0.072 dm3·mol-1;(C) 0.028 dm3·mol-1;(D) 0.010 dm3·mol-1。
第四章 多组分体系统热力学一. 选择题1. 当某溶质溶于某溶剂形成一定的溶液时,若采用不同的浓标,则下列描述溶质的各说法中正确的是( )A. 浓度数据相同B. 活度数据相同C. 活度因子相同D. 化学势相同2. 恒温时在A 和B 的二元液系中,若增加A 组分使其分压p A 上升,则B 组分在气相中的分压p B 将( )A. 上升B. 不变C. 下降D. 不确定3. 沸点升高,说明在溶剂中加入非挥发性溶质后,该溶剂的化学势与加入前比较将( )A. 升高B. 不变C. 降低D. 无法确定4. 在α,β相中均含有A 和B 两种物质,达到相平衡时,下列各式正确的是( )A. B. C. D.5. 在298.15K 时0.01m ol.dm -3葡萄糖水溶液的渗透压π1,0.01m ol.dm -3 硫酸钾水溶液的渗透压π2 ,下列各项正确的是( )A. B. C. D. 不能确定6. 组分B 从a 相扩散入β相中,则以下说法正确的有( )A. 总是从浓度高的相扩散入浓度低的相B. 总是从浓度低的相扩散到浓度高的相C. 平衡时两相浓度相等D. 总是从高化学势移向底化学势7. 在363,15K ,101.325kP a 时水和水蒸气构成两相平衡,两相化学势的关系为( )A. B. C. D. 不能确定8. 在298.15K,A 和B 两种气体在某种溶剂中的亨利系数分别为k A 和k B 并有k A >k B 当A 和B 具有相同的分压力时,二者的浓度关系是( )A. B. C. D. 不能确定9. 对非理想液体中的溶质,当选假想的,符合亨利定律的,的状态为标准态时,下列结果正确的是( )时,时,时,时,,10. A和B形成理想溶液,已知373K时纯A的蒸气压为133.3kP a,纯 B的蒸气压为166.66kP a,与此二元溶液成平衡的气相中的摩尔分数为2/3时,溶液中A的摩尔分数为( )A.1B.2/3C. 1/2D.1/411.在298.15K,101325P a时某溶液中溶剂A的蒸气压为p A,化学势为u A,凝固点为T A,上述三者与纯溶剂的相比,有( )12.下列活度与标准态的关系表述正确的是( )A. 活度等于1的状态必为标准态B. 活度等于1的状态与标准态的化学势相等C. 标准态的活度并不一定等于1D. 活度与标准态的选择无关13.下列关于亨利系数讨论中,不正确的是( )A. 其值因溶液组成表示方法不同而异B. 其值与温度有关C. 其值与溶剂的性质均有关D. 其值与溶质的活度有关14..对A,B二组分理想液态混合物系统中,下列说法不正确的是()A. A,B 在全部组成范围内均服从拉乌尔定律B. 该系统的沸点-组成图,液相线为直线C. 任一组分的化学势表示为D. 对任一组分均有15.在讨论稀溶液的蒸气压下降的规律时,溶质必须是()A. 挥发性溶质B.气体物质C.非挥发性溶质D. 电解质16.溶剂服从拉乌尔定律同时溶质服从亨利定律的二元溶液()A.理想稀溶液B.理想溶液C.实际溶液D.共轭溶液17..由水(1)和甲醇(2)组成的二元溶液,下列各式不是甲醇在此溶液中化学势的是()A B C18.下列关于稀溶液依数性的讨论中,不正确的是( )A. 在依数性中最灵敏的性质是渗透压B. 在依数性公式的推导中,都应用了拉乌尔定律C. 依数性都可以用来测知溶剂的不纯性D. 在依数性公式的热力学推倒中没有任何近似假定,是十分严格的19.对于二元溶液,其组分的平衡分压与组成的关系为杜亥姆- 马居尔公式:,其适用的条件为( )A. 温度和总压恒定B. 温度恒定,气相为理想气体C. 恒温D. 温度和总压恒定,并且气相为理想气体20.在298.15K时,纯丙酮的蒸气压为43kP a,在氯仿的摩尔分数为0.30的丙酮- 氯仿二元溶液上丙酮的蒸气压为26.77k P a,则此溶液( )A.为理想溶液B.对丙酮为正偏差C.对丙酮为负偏差D.以上都不对21. 1 mol A与n mol B组成的溶液,体积为0.65dm3,当x B = 0.8时,A的偏摩尔体积V A = 0.090dm3·mol-1,那么B的偏摩尔V B 为:(A) 0.140 dm3·mol-1;(B) 0.072 dm3·mol-1;(C) 0.028 dm3·mol-1;(D) 0.010 dm3·mol-1。