工程热力学经典例题-第四章_secret
- 格式:docx
- 大小:74.60 KB
- 文档页数:12

第四章4-1试用热力学第二定律证明,在p-v图上,两条可逆绝热线不可能相交。
4-2 (1) 可逆机从热源T1吸热Q1,在热源T1与环境(温度为T0)之间工作,能作出多少功?(2) 根据卡诺定理降低冷源温度可以提高热效率,有人设想用一可逆制冷机造成一个冷源T2(T2<T0),另可逆热机在T1与T2间工作,你认为此法是否有效?为什么?4-3温度为T1,T2的两个热源间有两个卡诺机A与B串联工作(即中间热源接受A 机的放热同时向B机供给等量热)。
试证这种串联工作的卡诺热机总效率与工作于同一T1,T2热源间的单个卡诺机效率相同。
4-4 如图4-26所示的循环,试判断下列情况哪些是可逆的?哪些是不可逆的?哪些是不可能的?图4-26a. Q L=1000kJ,W=250kJb. Q L=2000kJ,Q H=2400kJc. Q H=3000kJ,W=250kJ4-5 试判断如图4-27所示的可逆循环中Q3的大小与方向、Q2的方向及循环净功W 的大小与方向。
4-6若封闭系统经历一过程,熵增为25kJ/K,从300K的恒温热源吸热8000kJ,此过程可逆?不可逆?还是不可能?4-8空气在轴流压气机中被绝热压缩,增压比为4.2,初、终态温度分别为20℃和200℃,求空气在压缩过程中熵的变化。
14-10 将5kg 0℃的冰投入盛有25kg 温度为50℃水的绝热容器中,求冰完全融化且与水的温度均匀一致时系统的熵的变化。
已知冰的融解热为333kJ/kg 。
4-11 在有活塞的气缸装置中,将1kmol 理想气体在400K 下从100kPa 缓慢地定温压缩到1000kPa ,计算下列三种情况下,此过程的气体熵变、热源熵变及总熵变:a. 若过程中无摩擦损耗,而热源的温度也为400K ;b. 过程中无摩擦损耗,热源温度为300K ;c .过程中有摩擦损耗,比可逆压缩多消耗20%的功,热源温度为300K 。
4-13 一个绝热容器被一导热的活塞分隔成两部分。



第四章 习题解答4-1 多变指数:()()2112ln ln 0.1250.9ln ln 0.1p p n v v ===()210.9 1.4110.91v n n q c T T u u n n κκ---=-=∆=∆---∴11408 kJ/kg 55u q ∆==⨯=40832 kJ/kg w q u =-∆=-=()21 1.4811.2 kJ/kg p h c T T u κ∆=-=⋅∆=⨯= 4011.228.8 kJ/kg s w q h =-∆=-=2211ln ln 1.01ln100.732ln 0.1250.822 kJ/kg Kp v v ps c c v p ∆=+=⨯+⨯=⋅ 4-2 ⑴1 1.4112 1.410.287423110.21 1.41 111.9 kJ/kg RT p w p κκκ--⎡⎤⎛⎫⎛⎫⨯⎢⎥=-=- ⎪ ⎪⎢⎥--⎝⎭⎝⎭⎢⎥⎣⎦= 0s ∆=⑵ ()()120.72342330088.25v w u c T T =-∆=-=⨯-=kJ/kg22113000.1lnln 1.0045ln 0.287ln 4230.5 0.117 kJ kg p T p s c R T p ∆=-=⋅-⋅=⑶1120.5ln 0.287ln195.4 kJ kg 0.2p w RT p ==⋅= 120.5ln 0.287ln 0.462 kJ kg K 0.2p s R p ∆==⨯=⋅⑷1112210.287423110.267.1121n n RT p w n p -⎡⎤⎡⎤⎛⎫⨯⎢⎥=-=-= ⎪⎢⎥⎢⎥--⎝⎭⎣⎦⎢⎥⎣⎦kJ/kg2221ln ln 1.005ln 0.723ln 0.20.35 kJ kg Kp v v ps c c v p ∆=+==-⋅4-3 ⑴ 21ln8.314373ln107140.6 kJ kmol v w RT v ==⨯= 21ln8.314ln1019.14 kJ K v s R v ∆==⨯=⋅ ⑵ 0w =21ln8.314ln1019.14 kJ K v s R v ∆==⨯=⋅ 4-4 210.12ln 50.2598ln 2.091 kJ K 0.6v S mR v ∆==⨯=-()303 2.091633.6 kJ Q W T S ==∆=⨯-=-0, 0H U ∆=∆=4-5 2211201.3286568.3 K 101.3p T T p ⎛⎫==⨯= ⎪⎝⎭()()210.287568.3286202.6 kJ kg 1.41v u c T T ∆=-=-=-()()21 1.40.287568.3286283.6 kJ kg 1.41p h c T T ⨯∆=-=-=-210.287586.3ln ln 0.493 kJ kg K 1.41286v T s c T ∆===⋅-4-6 ⑴ 21303 K T T ==120.3ln 60.287303ln 573.2 kJ 0.1p Q W mRT p ===⨯⨯⨯=⑵ 1 1.411.422110.1303221.4 K 0.3p T T p κκ--⎛⎫⎛⎫==⨯= ⎪ ⎪⎝⎭⎝⎭ , 0Q = ()()120.2876303221.4351.3 kJ 1 1.41R W m T T κ=-=⨯-=--⑶ 1 1.211.222110.1303252.3 K 0.3n np T T p --⎛⎫⎛⎫==⨯= ⎪ ⎪⎝⎭⎝⎭()()120.2876303252.3436.5 kJ 1 1.21R W m T T n =-=⨯-=--()()21 1.2 1.40.2876252.33031 1.21 1.41 218.3 kJv n Q m c T T n κ--=-=⨯⨯⨯----=4-7 ()()()()1221ln ln 0.60.12 1.30ln ln 0.8150.236p p n v v ===1116000.236493.4 K 0.287p v T R ⨯===2221200.815340.8 K 0.287p v T R ⨯===()()120.287493.4340.8146 kJ 1 1.31R w T T n =-=-=--()()21 1.3 1.40.287340.8493.411 1.31 1.4136.5 kJ/kgn R q T T n κκ--=⋅-=⋅⋅-----= ()()210.723340.8493.8109.5 kJ kg v u c T T ∆=-=⨯-=- ()()21 1.01340.8493.4154.1 kJ kg p h c T T ∆=-=⨯-=-22120.8150.12ln ln 1.01ln 0.723ln0.2360.6 0.089 kJ kg Kp v v p s c c v p ∆=+=⋅+⋅=⋅4-8 40200160 kJ kg u q w ∆=-=-=-211600.533 kJ kg K 373673v u c T T ∆-===⋅--()()()()()2121122112ln ln ln 16 1.491673ln ln ln 6373p p p p n v v p T p T ====⎛⎫⋅ ⎪⎝⎭()()121 1.4912000.327 kJ/kg K 673373n w R T T --⨯===⋅-- 0.5330.3270.86 kJ kg K p v c c R =+=+=⋅4-9 10.412122933454.7 K v T T v κ-⎛⎫==⨯= ⎪⎝⎭()()1120.287293454.7116 kJ 1 1.41R w T T κ=-=-=---2221ln 0.287454.7ln 3143.4 kJ vw RT v ==⨯⨯=12116143.427.4 kJ w w w =+=-+=4-10 ⑴ 333100 1.73583 K 0.2968p v T R ⨯=== 11.413232 1.735831265 K 0.25v T T v κ--⎛⎫⎛⎫=== ⎪ ⎪⎝⎭⎝⎭22120.296812651.5 MPa 0.25RT p p v ⨯====11227730.250.153 MPa 1265T v v T ==⨯=⑵ 定压过程:()()210.29681265773365 kJ kg 1 1.41R u T T κ∆=-=-=--()()210.29681265773146 kJ kg w R T T =-=⨯-=定熵过程:()()320.29685831265506 kJ kg 1 1.41R u T T κ∆=-=-=---506 kJ kg w u =-∆=4-11 ⑴ 31110.2875730.274 m 600RT v p ⨯===321330.2740.822 m kg v v ==⨯=11.4112121573369 K 3v T T v κ--⎛⎫⎛⎫=== ⎪ ⎪⎝⎭⎝⎭2220.2873690.129 MPa 0.822RT p v ⨯===310.274 v v ==3m kg223330.1290.387 MPa p v p v ==⨯= 32369T T ==K⑵ ()()1120.287573369146.41 1.41R w T T κ=-=-=--kJ kg32221ln 0.287369ln 116.43v w RT v ==⨯⨯=-kJ kg()1.293146.4116.438.8 kJ W mw ==⨯-=4-12 1112101.3ln101.3150ln 59250 kJ 5000p Q pV p ==⨯⨯=- 4-13 101.3256000.21550.2872733600pV mRT ⨯===⨯⨯ kg/s 1,120.1ln 0.21550.287293ln 37.8 kW 0.8s T p W mRTp ==⨯⨯=- 112,1 1.411.4111.40.2872930.8 0.2155151.3 kW 1.410.1s SRT p W m p κκκκ--⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=-⎪⎢⎥-⎝⎭⎣⎦4-14 1600 kg/h kg/s 6m== ⑴定温压缩11210.1ln 0.287293ln 25.1 kW 60.6s T p W mRTp ⋅==⨯⨯=- ⑵定熵压缩112,1 1.411.4111 1.40.2872930.6 132.8 kW 6 1.410.1s SRT p W m p κκκκ--⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=-⎪⎢⎥-⎝⎭⎣⎦⑶多变压缩 112,1 1.2211.22111 1.220.2872930.6 129.6 kW 6 1.2210.1n n s nnRT p W m n p --⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=- ⎪⎢⎥-⎝⎭⎣⎦4-15 压缩比2160.160p p ==,应采用二级压缩20.775 MPa p == ∵13322n nT p T p -⎛⎫= ⎪⎝⎭,2120T T '==℃ (冷却至初温)∴1 1.2511.2533226293441.90.775n np T T p --'⎛⎫⎛⎫==⨯= ⎪⎪⎝⎭⎝⎭K3168.8t =℃ 4-16 ()()()()()2121122112ln ln ln 0.50.1 1.130.5289ln ln ln 0.1348p p p p n v v p T p T ====⎛⎫⋅ ⎪⎝⎭111100400482.3 kg/min 8.04 kg/s 0.287289p V mRT ⨯====⨯ ()()12 1.130.2878.042893481 1.1311183 kWs nR W mnwm T T n ⨯==-=⨯---=- ()()21 1.13 1.48.040.7233482891 1.131 712.3 kW 42738 kJ/minv n Q m c T T n κ--=-=⨯⨯⨯---=-= 4-17 12111v p c p λ⎡⎤⎛⎫⎢⎥=-- ⎪⎢⎥⎝⎭⎣⎦⑴ n =1.4,11.40.510.0610.870.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦⑵ n =1.25,11.250.510.0610.840.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦ ⑶ n =1.0,11.00.510.0610.760.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦4-18 ()21w pw a n m c t m c T T ∆=--111100250297.3 kg/h 0.08258 kg/s 0.287293a p V m RT ⨯====⨯ ()()()2112 4.186846514297.3293423 0.705 kJ/kg Kw pw w pw n a a m c t m c t c m T T m T T ∆∆⨯⨯=-==--⨯-=-⋅111n v n n Rc c n n κκκ--==--- 1.40.2870.7051.411 1.200.2870.7051 1.41nn Rc n R c κκκ⨯+---===-+--1.211.2122114230.10.905 MPa 293n n T p p T --⎛⎫⎛⎫==⨯= ⎪⎪⎝⎭⎝⎭()()1211.20.2870.0825829342318.48 kW1.21s a s a anRW m w m nw m T T n ===--⨯=⨯-=-。

第四章 理想气体热力过程一、选择题1.在定容过程中,理想气体的内能变化Δu =D A .⎰21dT c p B .⎰21pdvC .⎰21vdpD .⎰21dT c v2.在定熵过程中,理想气体的内能变化Δu =BDA .⎰21dT c p B .-⎰21pdv C .-⎰21vdp D .⎰21dT c v3. 在定压过程中,理想气体的内能变化Δu =D A .⎰21dT c p B .⎰21pdvC .⎰21vdpD .⎰21dT c v4.在定熵过程中,理想气体的焓的变化Δh =AC A .⎰21dT c p B .⎰21pdvC .⎰21vdpD .⎰21dT c v5.理想气体定容过程中,焓的变化Δh =B A .c v ΔT B .c p ΔT C .u+pv D .w t6.理想气体定温过程的热量q 等于BCD A .c n ΔT B .w t C .T Δs D .w 7.理想气体等温过程中,q ,w ,w t 间的关系为DA .q> w t >wB .q=w< w tC .q>w= w tD .q=w= w t8.理想气体绝热过程初终态温度,压力的关系为A A .12T T =κκ112-⎪⎪⎭⎫ ⎝⎛p pB . 21T T = κκ112-⎪⎪⎭⎫ ⎝⎛p pC .12p p = κκ112-⎪⎪⎭⎫ ⎝⎛T T D .21p p = κκ112-⎪⎪⎭⎫⎝⎛T T9.理想气体多变过程内能变化Δu 等于B A .c n ΔT B .c v ΔT C .c p ΔT D .R ΔT 10.理想气体多变过程焓的变化Δh 等于C A .c n ΔT B .c v ΔT C .c p ΔTD .R ΔT二、填空题1.Rg=0.297kJ/(kgK)的1kg 双原子理想气体在定压下吸热3349kJ ,其内能变化Δu = 。
2.Rg=0.26kJ/(kgK)、温度为T =500K 的1kg 理想气体在定容下吸热3349kJ ,其熵变Δs = 。


习题提示与答案 第四章 理想气体的热力过程4-1 设气缸中有0.1 kg 二氧化碳,其压力为0.1 MPa 、温度为27 ℃。
如进行一个定压过程,气体对外作功3 kJ 。
设比热容为定值,试求过程中气体热力学能和熵的变化以及气体吸收的热量。
提示:理想气体;Q =ΔU +W ;ΔU =mc V 0ΔT ;12120ln lnp pR T T c s p g Δ−=。
答案:ΔU =10.5 kJ ,ΔS =0.036 11 kJ/K ,Q =13.5 kJ 。
4-2 有一气缸,其中氮气的压力为0.15 MPa 、温度为300 K 。
如果按两种不同的过程变化:(1)在定压下温度变化到450 K ;(2)在定温下压力下降到0.1 MPa 。
然后在定容下变化到0.15 MPa 及450 K 。
设比热容为定值,试求两种过程中热力学能和熵的变化以及从外界吸收的热量。
提示:略。
答案:(1)=111.15 kJ/kg ,=0.421 kJ/(kg ·K),q u Δs Δ1-2=155.7 kJ/kg 。
(2)=111.15 kJ/kg ,=0.421kJ/(kg ·K),q u Δs Δ1-3-2=147.25 kJ/kg 。
4-3 设气缸中空气的压力为0.5 MPa 、温度为600 K ,若经绝热过程膨胀到0.1 MPa ,试求膨胀终了的温度及比体积:(1)按定值比热容计算;(2)按空气的热力性质表进行计算。
提示:(2) 1200ln 12p p R S S g T T +=;依,由热力性质表确定T 02T S 2 及v r2。
答案:(1) T 2=378.8 K ,v 2=1.089 m 3/kg ;(2) T 2=382.6 K ,v 2=1.10 m 3/kg 。
4-4 柴油机吸气终了时气缸中空气的温度为60 ℃、压力为0.1 MPa 。
为使压缩终了时空气温度超过柴油的自燃温度以使其着火,故要求压缩终了的温度至少为720 ℃。

第四章4-1 1kg 空气在可逆多变过程中吸热40kJ ,其容积增大为1102v v =,压力降低为8/12p p =,设比热为定值,求过程中内能的变化、膨胀功、轴功以及焓和熵的变化。
解:热力系是1kg 空气 过程特征:多变过程)10/1ln()8/1ln()2/1ln()1/2ln(==v v p p n =0.9 因为 T c q n ∆=内能变化为R c v 25==717.5)/(K kg J • v p c R c 5727===1004.5)/(K kg J • =n c ==--v v c n k n c 51=3587.5)/(K kg J • n v v c qc T c u /=∆=∆=8×103J膨胀功:u q w ∆-==32 ×103J轴功:==nw w s 28.8 ×103J 焓变:u k T c h p ∆=∆=∆=1.4×8=11.2 ×103J 熵变:12ln 12lnp p c v v c s v p +=∆=0.82×103)/(K kg J •4-2 有1kg 空气、初始状态为MPa p 5.01=,1501=t ℃,进行下列过程:(1)可逆绝热膨胀到MPa p 1.02=;(2)不可逆绝热膨胀到MPa p 1.02=,K T 3002=;(3)可逆等温膨胀到MPa p 1.02=;(4)可逆多变膨胀到MPa p 1.02=,多变指数2=n ;试求上述各过程中的膨胀功及熵的变化,并将各过程的相对位置画在同一张v p -图和s T -图上解:热力系1kg 空气(1) 膨胀功:])12(1[111k k p p k RT w ---==111.9×103J熵变为0 (2))21(T T c u w v -=∆-==88.3×103J 12ln 12ln p p R T T c s p -=∆=116.8)/(K kg J • (3)21ln1p p RT w ==195.4×103)/(K kg J • 21ln p p R s =∆=0.462×103)/(K kg J • (4)])12(1[111n n p p n RT w ---==67.1×103J n n p p T T 1)12(12-==189.2K 12ln 12ln p p R T T c s p -=∆=-346.4)/(K kg J •4-3 具有1kmol 空气的闭口系统,其初始容积为1m 3,终态容积为10 m 3,当初态和终态温度均100℃时,试计算该闭口系统对外所作的功及熵的变化。

工程热力学第四章答案【篇一:工程热力学答案(第四版严家騄著含第六章)】考题1、如果容器中气体压力保持不变,那么压力表的读数一定也保持不变,对吗?答:不对。
因为压力表的读书取决于容器中气体的压力和压力表所处环境的大气压力两个因素。
因此即使容器中的气体压力保持不变,当大气压力变化时,压力表的读数也会随之变化,而不能保持不变。
2、“平衡”和“均匀”有什么区别和联系答:平衡(状态)值的是热力系在没有外界作用(意即热力、系与外界没有能、质交换,但不排除有恒定的外场如重力场作用)的情况下,宏观性质不随时间变化,即热力系在没有外界作用时的时间特征-与时间无关。
所以两者是不同的。
如对气-液两相平衡的状态,尽管气-液两相的温度,压力都相同,但两者的密度差别很大,是非均匀系。
反之,均匀系也不一定处于平衡态。
但是在某些特殊情况下,“平衡”与“均匀”又可能是统一的。
如对于处于平衡状态下的单相流体(气体或者液体)如果忽略重力的影响,又没有其他外场(电、磁场等)作用,那么内部各处的各种性质都是均匀一致的。
3、“平衡”和“过程”是矛盾的还是统一的?答:“平衡”意味着宏观静止,无变化,而“过程”意味着变化运动,意味着平衡被破坏,所以二者是有矛盾的。
对一个热力系来说,或是平衡,静止不动,或是运动,变化,二者必居其一。
但是二者也有结合点,内部平衡过程恰恰将这两个矛盾的东西有条件地统一在一起了。
这个条件就是:在内部平衡过程中,当外界对热力系的作用缓慢得足以使热力系内部能量及时恢复不断被破坏的平衡。
4、“过程量”和“状态量”有什么不同?答:状态量是热力状态的单值函数,其数学特性是点函数,状态量的微分可以改成全微分,这个全微分的循环积分恒为零;而过程量不是热力状态的单值函数,即使在初、终态完全相同的情况下,过程量的大小与其中间经历的具体路径有关,过程量的微分不能写成全微分。
因此它的循环积分不是零而是一个确定的数值。
习题1-1 一立方形刚性容器,每边长 1 m,将其中气体的压力抽至 1000 pa,问其真空度为多少毫米汞柱?容器每面受力多少牛顿?已知大气压力为 0.1mpa。

第四章 热力学第二定律例 题例4-1 先用电热器使 20 kg 、温度t 0=20 ℃的凉水加热到t 1=80 ℃,然后再与40 kg 、温度为 20 ℃的凉水混合。
求混合后的水温以及电加热和混合这两个过程各自造成的熵产。
水的比定压热容为 4.187 kJ/(kg·K );水的膨胀性可忽略。
[编题意图] 实际过程中熵产的计算是本章的重点和难点之一,本题的目的在于检测和练习电热器加热造成的熵产和不等温水混合过程中的熵产的分析计算。
[解题思路] 电加热水过程引起熵产是由于电功转变为热产,水吸收这个热后其自身温度逐渐上升,这是一个不断积累过程,需通过微元热产量g Q δ与水变化的水温T 之比这个微元熵产的积分求得。
要求凉水与热水混合造成的熵产,必须先求出20kg80℃的水放热的熵减与20℃的凉水吸热的熵增,这种内热流造成的熵产也是个逐渐积累的过程,也需积分求得。
整个加热混合造成的总熵产由二者相加得到。
[求解步骤]设混合后的温度为t ,则可写出下列能量方程:()()1120p p m c t t m c t t -=-即 ()()2041878040418720kg kJ /(kg C)C kg kJ /(kg C)C o o o o ⨯⋅⨯-=⨯⋅⨯-..t t 从而解得 t = 40 ℃ (T = 313.15 K ) 电加热过程引起的熵产为1g 0g11g 10d lnT Qp p T Q m c T T S m c TTT δ===⎰⎰353.15K 20kg 4.187kJ/(kg K)ln =⨯⋅⨯=15.593 kJ / K 混合过程造成的熵产为i 1012ig 1210d d ln lnTT p p Q p p T T m c T m c T Q T T S m c m c T T T T T δ==+=+⎰⎰⎰313.15K20kg 4.187kJ/(kg K)ln353.15K313.15K40kg 4.187kJ/(kg K)ln293.15K10.966kJ/K 11.053kJ/K 0.987kJ/K=⨯⋅⨯+⨯⋅⨯=-+= 总的熵产S S S QQ g g g g ikJ /K kJ /K kJ /K =+=+=15593098716580...由于本例中无熵流(将使用电热器加热水看作水内部摩擦生热),根据式(4-12)可知,熵产应等于热力系的熵增。
热工基础第四章习题答案热工基础第四章习题答案热工基础是热能科学的基础学科,是热能工程学、热力学和热工学的基础。
在学习热工基础的过程中,习题是非常重要的一部分,通过做习题可以巩固理论知识,提高解题能力。
本文将为大家提供热工基础第四章习题的详细解答。
1. 问题描述:一个理想气体在等温过程中,体积从V1变为V2,压强由P1变为P2。
求气体对外做功。
解答:根据理想气体的状态方程PV=nRT,我们可以得到P1V1=P2V2。
由于等温过程,气体的温度保持不变,因此气体的内能也不变。
根据热力学第一定律,等温过程中气体对外做功等于热量的负值。
所以,气体对外做功为W=-Q。
由于内能不变,所以热量Q=0。
因此,气体对外做功W=0。
2. 问题描述:一个理想气体在绝热过程中,体积从V1变为V2,压强由P1变为P2。
求气体对外做功。
解答:绝热过程中,气体与外界没有热量交换,所以热量Q=0。
根据热力学第一定律,气体对外做功等于热量的负值,即W=-Q。
所以,气体对外做功W=0。
3. 问题描述:一个理想气体在等容过程中,温度从T1变为T2,压强由P1变为P2。
求气体对外做功。
解答:等容过程中,气体的体积保持不变,所以体积的改变量为ΔV=0。
根据理想气体的状态方程PV=nRT,我们可以得到P1V1=P2V2。
由于等容过程,气体的体积不变,所以V1=V2,所以P1=P2。
根据热力学第一定律,等容过程中气体对外做功等于热量的负值。
所以,气体对外做功W=-Q。
根据理想气体的内能公式U=CvΔT,其中Cv为等容热容量,ΔT为温度变化量。
所以,热量Q=CvΔT。
因此,气体对外做功W=-CvΔT。
4. 问题描述:一个理想气体在等压过程中,温度从T1变为T2,体积由V1变为V2。
求气体对外做功。
解答:等压过程中,气体的压强保持不变,所以压强的改变量为ΔP=0。
根据理想气体的状态方程PV=nRT,我们可以得到P1V1=P2V2。
由于等压过程,气体的压强不变,所以P1=P2。
4.4 典型例题精解4.4.1 判断过程的方向性,求极值例题 4-1 欲设计一热机,使之能从温度为973K 的高温热源吸热2000kJ ,并向温度为303K 的冷源放热800kJ 。
(1)问此循环能否实现?(2)若把此热机当制冷机用,从冷源吸热800K ,能否可能向热源放热2000kJ ?欲使之从冷源吸热800kJ,至少需耗多少功?解 (1)方法1:利用克劳修斯积分式来判断循环是否可行。
如图4-5a 所示。
12r12||||2000kJ 800kJ-=-0.585kJ/K <0973K 303KQQ Q T T T δ=-=⎰所以此循环能实现,且为不可逆循环。
方法2:利用孤立系统熵增原理来判断循环是否可行。
如图4-5a 所示,孤立系由热源、冷源及热机组成,因此iso H L E E 0S S S S S ∆=∆+∆+∆∆= (a )式中:和分别为热源及冷源的熵变;为循环的熵变,即工质的熵变。
因为工质经循环恢复到原来状态,所以E 0S ∆= (b ) 而热源放热,所以 1H 1||2000kJ2.055kJ/K 973KQ S T ∆=-=-=- (c ) 冷源吸热,则 2L 2||800kJ 2.640kJ/K 303KQ S T ∆=== (d ) 将式(b )、(c )、(d )代入式(a ),得( 2.055 2.6400)kJ/K 0sio S ∆=-++> 所以此循环能实现。
方法3:利用卡诺定理来判断循环是否可行。
若在1T 和2T 之间是一卡诺循环,则循环效率为2c 1303K 1168.9%973KT T η=-=-= 而欲设计循环的热效率为12t 11||||||||W Q Q Q Q η-== c 800kJ160%2000kJη=-=<即欲设计循环的热效率比同温度限间卡诺循环的低,所以循环可行。
(2)若将此热机当制冷机用,使其逆行,显然不可能进行,因为根据上面的分析,此热机循环是不可逆循环。
第四章 气体和蒸汽的热力过程4-1 有 2.3kg 的CO ,初态11477K 0.32MPa T p ==,,经可逆定容加热,终温2600K T =,设CO 为理想气体,求U Δ、H Δ、S Δ,求过程功及过程热量。
(1)比热容为定值;(2)比热容为变值,按气体性质表计算。
解 (1)定值比热容2211600K 0.32MPa 0.4025MPa477KT p p T ==×=由附表328.0110kg/mol M −=×,g 38.3145J/(mol K)296.8J(kg K)28.0110kg/molR R M−⋅===⋅×。
g 55296.8J/(kg K)742.1J/(kg K)22V c R ==×⋅=⋅g 77296.8J/(kg K)1038.94J/(kg K)22p c R ==×⋅=⋅21() 2.3kg 742.1J/(kg K)(600477)K 209.94kJ V U mc T T Δ=−=×⋅−=21Δ() 2.3kg 1038.94J/(kg K)(600477)K 293.92kJp H mc T T =−=×⋅−=21600K ln2.3kg 742.1ln0.3916kJ/K477KV T S mc T Δ==×=0W =,209.94JQ U =Δ=(2)变比热容由附表查得 1477K T =时m,113921.704J/mol H =,0m,1211.312J/(mol K)S =⋅2600K T =时m,217612.7J/mol H =,0m,2218.217J/(mol K)S =⋅ m,1m,1113921.704J/mol 8.3145J/(mol K)477K 9955.69J/molU H RT =−=−⋅×=m,2m,2217612.7J/mol 8.3145J/(mol K)600K 12624.0J/mol U H RT =−=−⋅×=3m 32.3kg (12624.09955.69)J/mol219.1010J 28.0110kg/molm U U M−×−Δ=Δ==××3m 32.3kg (17612.713921.704)J/mol303.0810J28.0110kg/mol m H H M−×−Δ=Δ==××000022m,2m,1m,2m,11133lnln600K 2.3kg [218.317211.312]J/(mol K)8.3145J/(mol K)ln 477K 28.0110kg/mol0.418610J/K p T m S n S S R S S R p M T −Δ=−−=−−×−⋅−⋅×=×=×⎛⎞⎛⎞⎜⎟⎜⎟⎝⎠⎝⎠⎛⎞⎜⎟⎝⎠0W =,219.10kJQ U =Δ=4-2 甲烷4CH 的初始状态10.47MPa p =、1393K T =,经可逆定压冷却对外放出热量4110.76J/mol ,试确定其终温及41molCH 的热力学能变化量m U Δ、焓变化量m H Δ。
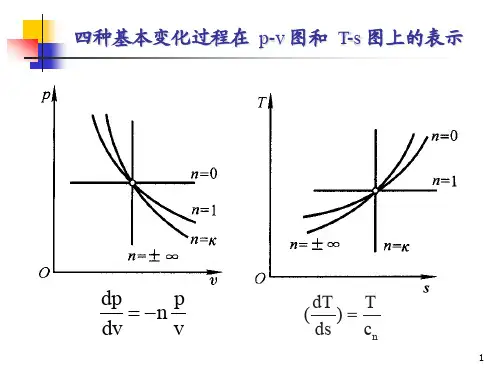
工程热力学思考题参考答案,第四章Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】第四章气体和蒸汽的基本热力过程 试以理想气体的定温过程为例,归纳气体的热力过程要解决的问题及使用方法解决。
答:主要解决的问题及方法:(1) 根据过程特点(及状态方程)——确定过程方程(2) 根据过程方程——确定始、终状态参数之间的关系(3) 由热力学的一些基本定律——计算,,,,,t q w w u h s ∆∆∆(4) 分析能量转换关系(P —V 图及T —S 图)(根据需要可以定性也可以定量)例:1)过程方程式:T =常数(特征)PV =常数(方程)2)始、终状态参数之间的关系:12p p =21v v 3)计算各量:u ∆=0、h ∆=0、s ∆=21p RInp -=21v RIn v 4)PV 图,TS 图上工质状态参数的变化规律及能量转换情况对于理想气体的任何一种过程,下列两组公式是否都适用答:不是都适用。
第一组公式适用于任何一种过程。
第二组公式21()v q u c t t =∆=-适于定容过程,21()p q h c t t =∆=-适用于定压过程。
在定容过程和定压过程中,气体的热量可根据过程中气体的比热容乘以温差来计算。
定温过程气体的温度不变,在定温过程中是否需对气体加入热量如果加入的话应如何计算答:定温过程对气体应加入的热量过程热量q 和过程功w 都是过程量,都和过程的途径有关。
由理想气体可逆定温过程热量公式2111v q p v In v =可知,故只要状态参数1p 、1v 和2v 确定了,q 的数值也确定了,是否q 与途径无关 答:对于一个定温过程,过程途径就已经确定了。
所以说理想气体可逆过程q 是与途径有关的。
在闭口热力系的定容过程中,外界对系统施以搅拌功w δ,问这v Q mc dT δ=是否成立答:成立。
这可以由热力学第一定律知,由于是定容过2211v v dv w pdv pvpvIn RTIn v v v ====⎰⎰为零。
冷源吸热,则S sio ( 2.055 2.640 0)kJ/K 0所以此循环能实现。
效率为c1 T2 1 303K 68.9%cT 1 973K而欲设计循环的热效率为800kJ1 60% c 2000 kJ c 即欲设计循环的热效率比同温度限间卡诺循环的低,所以循环可行。
(2)若将此热机当制冷机用,使其逆行,显然不可能进行,因为根据上面的分析,此 热机循环是不可逆循环。
当然也可再用上述3种方法中的任一种,重新判断。
欲使制冷循环能从冷源吸热 800kJ ,假设至少耗功 W min ,4. 4 典型例题精解 4.4 .1 判断过程的方向性,求极值 例题 4-1 欲设计一热机, 使之能从温度为 973K 的高温热源吸热 2000kJ ,并向温 度为 303K 的冷源放热 800kJ 。
(1)问此循环能否实现?(2)若把此热机当制冷机用,从 冷源吸热 800K ,能否可能向热源放热 2000kJ ?欲使之从冷源吸热 800kJ,至少需耗多少功? 解 (1)方法1:利用克劳修斯积分式来判断循环是否可行。
如图4- 5a 所示。
Q |Q 1| |Q 2| 2000kJ -800kJ = -0.585kJ/K <0T r T 1 T 2 973K 303K 所以此循环能实现,且为不可逆循环。
方法2:利用孤立系统熵增原理来判断循环是否可行。
如图4- 源、冷源及热机组成,因此 5a 所示,孤立系由热 S iso S H S L S E S E 0 a ) 式中: 和分别为热源及冷源的熵变; 原来状态,所以 为循环的熵变,即工质的熵变。
因为工质经循环恢复到而热源放热,所以 S Eb )S H|Q 1 | T 12000kJ2. 055 k J/ K973Kc )SL|Q 2 |T2800kJ2. 640kJ/K303Kd )将式( b )、( c )、(d ) 代入式( a ),得方法3:利用卡诺定理来判断循环是否可行。
若在T 1和T 2 之间是一卡诺循环,则循环W t|Q 1 ||Q 1 | |Q 2| |Q 1|根据孤立系统熵增原理,此时,S iso 0 参见图4-5bS iso S H S L S R|Q1| |Q2 |0iso H L RT1 T2|Q| W mi n |Q |2 800kJ+ W m i n800kJT1 T2 973K 303K于是解得W min 1769kJ讨论(1)对于循环方向性的判断可用例题中3种方法的任一种。
但需注意的是:克劳修斯积分式适用于循环,即针对工质,所以热量、功的方向都一工质作为对象考虑;而熵增原理适用于孤立系统,所以计算熵的变化时,热量的方向以构成孤立系统的有关物体为对象,它们吸热为正,放热为负。
千万不要把方向搞错,以免得出相反的结论。
(2)在例题所列的3种方法中,建议重点掌握孤立系熵增原理方法,因为该方法无论对循环还是对过程都适用。
而克劳修斯积分式和卡诺定理仅适用于循环方向性的判断。
例题4-2已知A、B、C3个热源的温度分别为500K 、400K 和300K ,有可逆机在这3个热源间工作。
若可逆机从A热源净吸入3000kJ 热量,输出净功400kJ,试求可逆机与B、C两热源的换热量,并指明其方向。
分析:由于在A、B、C间工作一可逆机,则根据孤立系熵增原理有等式S iso 0 成立;又根据热力学第一定律可列出能量平衡式。
可见2个未知数有2个方程,故该题有定解。
关于可逆机于B、C 两热源的换热方向,可先假设为如图4-6所示的方向,若求出的求知量的值为正,说明实际换热方向与假设一致,若为负,则实际换热方向与假设相反。
解根据以上分析,有一下等式成立.Q A Q B Q c WSiso Q A Q B Q cS iso TA TB T c即3000kJ Q B Q c 400kJ3000kJ Q B Q c 0500K 400K 300K 0解得Q B 3200kJQ C 600kJ即可逆机向B热源放热3200kJ,从C热源吸热600kJ。
例题4-3图4-7所示为用于生产冷空气的设计方案,问生产1kg 冷空气至少要给装置多少热量Q H,min 。
空气可视为理想气体,其比定压热容c P 1kJ/(kg K) 。
解方法1见图4-7,由热力学第一定律的开口系的能量平衡式为Q H mc P T3 Q L mc P T4Q L Q H mc P(T3 T4 )由热力学第二定律,当开口系统内进行的过程为可逆过程时,可得S iso S H S L S air 0QH,min QH,minmcP(T3T4)T4mc P ln 4 0T1 T2T3Q H,min Q H,min 1kg 1kJ/(kg K) (313- 278) K1500K 300 K278K1kg 1kJ/(kg K)ln 0313K1kg 冷空气至少要加给装置的热量为Q H,min 0.718kJ方法2参见图4-8,可将装置分解为一可逆热机和一可逆制冷机的组合。
对于可逆制冷机Q1 W Q2Q1 Q2T H T3由此得系统对外作功为W (TH 1) Q2(TH 1)mc p dT3 T3T3空气自T3 313K 变化到T4 278K 时W T4(TH 1)mc p d T3c p T H ln T4142.87 kJ可求得Q'H TH |W | 1500K142.87 kJ 178.59kJH T H T2 1500K-300KQ1 |W | Q2 |W | mc P (T3 T4)142.87kJ 1kg 1kJ/(kg K) (313- 278)K 177.87kJ 解得生产于是,生产1kg 冷空气至少要加给装置的热量为Q H,min Q'H Q1 (178.59 177.87)kJ = 0.72kJ例题4-4 5kg 的水起初与温度为295K 的大气处于热平衡状态。
用一制冷机在这5kg 水与大气之间工作,使水定压冷却到280K ,求所需的最少功是多少?解方法1根据题意画出示意图如图4-9所示,由大气、水、制冷机、功源组成了孤立系,则熵变SisoSHSLSRSW其中S R 0, S W 0280K Q2280K mcdT2280KS L mclnL 295K T2295K T2295K280K5kg 4180 J/(kg K)ln 1090.7 J/KQ1 |Q2| |W |SSH T0 T05kg 4180 J/(kg K)(295 280)K |W |295K313500 J + |W |295K于是313500 J |W |S iso 10970.7 J/K+ +iso 295K 295K因可逆时所需的功最小,所以令S iso 0 ,可解得|W min |= 8256J = 8.256kJ 方法2制冷机为一可逆机时需功最小,由卡诺定理得Q2 T2W T0 T2即W Q2(T0 T2)T0 T2mcdT2280 K T 0 mc ln - mc(280 - 295)K295K5kg 4180J/(kg K)(280 295) K 8251.2 J = -8.251kJ例题4-5 图4- 10 为一烟气余热回收方案,设烟气比热容c p 1.4kJ/(kg K) ,c V 1kJ/(kg K) 。
试求:(1)烟气流经换热器时传给热机工质的热量; (2)热机放给大气的最小热量 Q 2 ; (3)热机输出的最大功 w 。
解 (1)烟气放热为Q 1 mc p (t 2 t 1)6kg 1.4kJ/(kg K) (527 37) ?K 4116 103 4116kJ(2)方法1:若使 Q 2 最小,则热机必须是可逆循环,由孤立系熵增原理得6kg 1.4kJ/(kg K)ln 37.964 103J/KS E 0S iso7.964 103J/K 30Q 02K 0Q 2 2389.2kJT2T 1mc ppcm2T 2lnT 2S LQ2Q2(27 273) K 300K280K 295K dT 2T 0mc 0 T 2 280K 295Kmc dT 2295K 5kg 4180 J/(kg K)ln280 K 295K(37 273)K (527 273) K解得方法2:热机为可逆机时Q2最小,由卡诺定理得Q2TT1T22Q2 T T0mc p T0mc p ln 2T1T T1= 300 K 6 kg 1. 4 kJ/(k(g37K ) l2n7K3 )2389. 2 kJ( 5 2 7 2 7K3 )(3)输出的最大功为W Q1 Q2 (4116 2389.2)kJ =1726.8kJ讨论例题4-4、4-5都涉及到变温热源的问题,应利用式(4-30b)积分求得。
对于热力学第二定律应用于循环的问题,可利用熵增原理,也可利用克劳修斯不等式,还可利用卡诺定理求解,读者不妨自己试一试。
建议初学者重点掌握孤立系熵增原理的方法。
例题4-6两个质量相等、比热容相同且为定值的物体,A物体初温为T A,B物体初温为T B 用它们作可逆热机的有限热源和有限冷源,热机工作到两物体温度相等时为止。
(1)证明平衡时的温度T m T A T B;(2)求热机作出的最大功量;(3)如果两物体直接接触进行热交换至温度相等时,求平衡温度及两物体总熵的变化量。
解(1)取A、B物体及热机、功源为孤立系,则S iso S A S B S W S E 0S E 0, S W 0S iso S A S B mc T TmdT mc T TmdT 0TATTBTmcln T TA m mcln T T m B 0t1Q2 T0Q1mc p d TT0mc T p dTdT0,T A T B1Q 1 mc(T A T m ), Q 2 mc(T m T B )热机为可逆热机时,其作功量最大,得W max Q 1 Q 2 mc(T A T m ) mc(T m T B ) mc(T A T B 2T m )3)平衡温度由能量平衡方程式求得,即mc(T A T m ) mc(T m T B )TAT BT mA2 B两物体组成系统的熵变化量为T m'dTT m'dTT AcmTT BcmT' ' 2mc(ln T TA m ln T T m B ) mcln (T 4A T T TA )B B例题 4-7 空气在初参数 p 1 0.6MPa ,t 1 21 C 的状态下,稳定地流入无运动不见 的绝热容器。
假定其中的一半变为 p 2'0.1MPa,t 2' 82 C 的热空气,另一半变为 p 2'' 0.1MPa,t 2''40 C 的冷空气,它们在这两状态下同时离开容器,如图4-11 所示。