工程热力学-第四章 习题
- 格式:ppt
- 大小:133.00 KB
- 文档页数:9

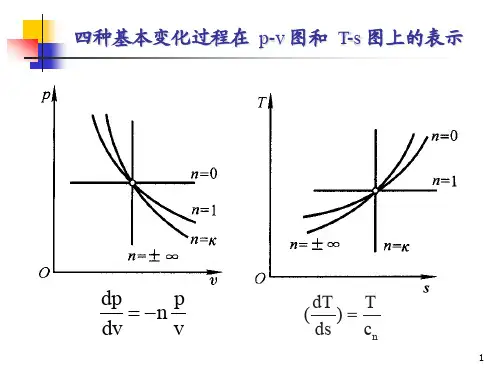
第4章 理想气体热力过程及气体压缩4.1 本章基本要求熟练掌握定容、定压、定温、绝热、多变过程中状态参数p 、v 、T 、∆u 、∆h 、∆s 的计算,过程量Q 、W 的计算,以及上述过程在p -v 、T -s 图上的表示。
4.2 本章重点结合热力学第一定律,计算四个基本热力过程、多变过程中的状态参数和过程参数及在p -v 、T -s 图上表示。
本章的学习应以多做练习题为主,并一定注意要在求出结果后,在p -v 、T -s 图上进行检验。
4.3 例 题例1.2kg 空气分别经过定温膨胀和绝热膨胀的可逆过程,如图4.1,从初态1p =9.807bar,1t =300C ο膨胀到终态容积为初态容积的5倍,试计算不同过程中空气的终态参数,对外所做的功和交换的热量以及过程中内能、焓、熵的变化量。
图4.1解:将空气取作闭口系对可逆定温过程1-2,由过程中的参数关系,得bar v v p p 961.151807.92112=⨯==按理想气体状态方程,得111p RT v ==0.1677kg m /3 125v v ==0.8385kg m /312T T ==573K 2t =300C ο气体对外作的膨胀功及交换的热量为1211lnV V V p Q W T T ===529.4kJ 过程中内能、焓、熵的变化量为12U ∆=0 12H ∆=0 12S ∆=1T Q T=0.9239kJ /K 或12S ∆=mRln12V V =0.9238kJ /K 对可逆绝热过程1-2′, 由可逆绝热过程参数间关系可得kv v p p )(211'2= 其中22'v v ==0.8385kg m /3 故 4.12)51(807.9'=p =1.03barRv p T '''222==301K '2t =28C ο气体对外所做的功及交换的热量为)(11)(11'212211T T mR k V p V p k W s --=--==390.3kJ 0'=s Q过程中内能、焓、熵的变化量为kJ T T mc U v 1.390)(1212''-=-=∆或kJ W U 3.390212'-=-=∆kJ T T mc H p 2.546)(1212''-=-=∆ '12S ∆=0例2. 1kg 空气多变过程中吸取41.87kJ 的热量时,将使其容积增大10倍,压力降低8倍,求:过程中空气的内能变化量,空气对外所做的膨胀功及技术功。



第四章 习题解答4-1 多变指数:()()2112ln ln 0.1250.9ln ln 0.1p p n v v ===()210.9 1.4110.91v n n q c T T u u n n κκ---=-=∆=∆---∴11408 kJ/kg 55u q ∆==⨯=40832 kJ/kg w q u =-∆=-=()21 1.4811.2 kJ/kg p h c T T u κ∆=-=⋅∆=⨯= 4011.228.8 kJ/kg s w q h =-∆=-=2211ln ln 1.01ln100.732ln 0.1250.822 kJ/kg Kp v v ps c c v p ∆=+=⨯+⨯=⋅ 4-2 ⑴1 1.4112 1.410.287423110.21 1.41 111.9 kJ/kg RT p w p κκκ--⎡⎤⎛⎫⎛⎫⨯⎢⎥=-=- ⎪ ⎪⎢⎥--⎝⎭⎝⎭⎢⎥⎣⎦= 0s ∆=⑵ ()()120.72342330088.25v w u c T T =-∆=-=⨯-=kJ/kg22113000.1lnln 1.0045ln 0.287ln 4230.5 0.117 kJ kg p T p s c R T p ∆=-=⋅-⋅=⑶1120.5ln 0.287ln195.4 kJ kg 0.2p w RT p ==⋅= 120.5ln 0.287ln 0.462 kJ kg K 0.2p s R p ∆==⨯=⋅⑷1112210.287423110.267.1121n n RT p w n p -⎡⎤⎡⎤⎛⎫⨯⎢⎥=-=-= ⎪⎢⎥⎢⎥--⎝⎭⎣⎦⎢⎥⎣⎦kJ/kg2221ln ln 1.005ln 0.723ln 0.20.35 kJ kg Kp v v ps c c v p ∆=+==-⋅4-3 ⑴ 21ln8.314373ln107140.6 kJ kmol v w RT v ==⨯= 21ln8.314ln1019.14 kJ K v s R v ∆==⨯=⋅ ⑵ 0w =21ln8.314ln1019.14 kJ K v s R v ∆==⨯=⋅ 4-4 210.12ln 50.2598ln 2.091 kJ K 0.6v S mR v ∆==⨯=-()303 2.091633.6 kJ Q W T S ==∆=⨯-=-0, 0H U ∆=∆=4-5 2211201.3286568.3 K 101.3p T T p ⎛⎫==⨯= ⎪⎝⎭()()210.287568.3286202.6 kJ kg 1.41v u c T T ∆=-=-=-()()21 1.40.287568.3286283.6 kJ kg 1.41p h c T T ⨯∆=-=-=-210.287586.3ln ln 0.493 kJ kg K 1.41286v T s c T ∆===⋅-4-6 ⑴ 21303 K T T ==120.3ln 60.287303ln 573.2 kJ 0.1p Q W mRT p ===⨯⨯⨯=⑵ 1 1.411.422110.1303221.4 K 0.3p T T p κκ--⎛⎫⎛⎫==⨯= ⎪ ⎪⎝⎭⎝⎭ , 0Q = ()()120.2876303221.4351.3 kJ 1 1.41R W m T T κ=-=⨯-=--⑶ 1 1.211.222110.1303252.3 K 0.3n np T T p --⎛⎫⎛⎫==⨯= ⎪ ⎪⎝⎭⎝⎭()()120.2876303252.3436.5 kJ 1 1.21R W m T T n =-=⨯-=--()()21 1.2 1.40.2876252.33031 1.21 1.41 218.3 kJv n Q m c T T n κ--=-=⨯⨯⨯----=4-7 ()()()()1221ln ln 0.60.12 1.30ln ln 0.8150.236p p n v v ===1116000.236493.4 K 0.287p v T R ⨯===2221200.815340.8 K 0.287p v T R ⨯===()()120.287493.4340.8146 kJ 1 1.31R w T T n =-=-=--()()21 1.3 1.40.287340.8493.411 1.31 1.4136.5 kJ/kgn R q T T n κκ--=⋅-=⋅⋅-----= ()()210.723340.8493.8109.5 kJ kg v u c T T ∆=-=⨯-=- ()()21 1.01340.8493.4154.1 kJ kg p h c T T ∆=-=⨯-=-22120.8150.12ln ln 1.01ln 0.723ln0.2360.6 0.089 kJ kg Kp v v p s c c v p ∆=+=⋅+⋅=⋅4-8 40200160 kJ kg u q w ∆=-=-=-211600.533 kJ kg K 373673v u c T T ∆-===⋅--()()()()()2121122112ln ln ln 16 1.491673ln ln ln 6373p p p p n v v p T p T ====⎛⎫⋅ ⎪⎝⎭()()121 1.4912000.327 kJ/kg K 673373n w R T T --⨯===⋅-- 0.5330.3270.86 kJ kg K p v c c R =+=+=⋅4-9 10.412122933454.7 K v T T v κ-⎛⎫==⨯= ⎪⎝⎭()()1120.287293454.7116 kJ 1 1.41R w T T κ=-=-=---2221ln 0.287454.7ln 3143.4 kJ vw RT v ==⨯⨯=12116143.427.4 kJ w w w =+=-+=4-10 ⑴ 333100 1.73583 K 0.2968p v T R ⨯=== 11.413232 1.735831265 K 0.25v T T v κ--⎛⎫⎛⎫=== ⎪ ⎪⎝⎭⎝⎭22120.296812651.5 MPa 0.25RT p p v ⨯====11227730.250.153 MPa 1265T v v T ==⨯=⑵ 定压过程:()()210.29681265773365 kJ kg 1 1.41R u T T κ∆=-=-=--()()210.29681265773146 kJ kg w R T T =-=⨯-=定熵过程:()()320.29685831265506 kJ kg 1 1.41R u T T κ∆=-=-=---506 kJ kg w u =-∆=4-11 ⑴ 31110.2875730.274 m 600RT v p ⨯===321330.2740.822 m kg v v ==⨯=11.4112121573369 K 3v T T v κ--⎛⎫⎛⎫=== ⎪ ⎪⎝⎭⎝⎭2220.2873690.129 MPa 0.822RT p v ⨯===310.274 v v ==3m kg223330.1290.387 MPa p v p v ==⨯= 32369T T ==K⑵ ()()1120.287573369146.41 1.41R w T T κ=-=-=--kJ kg32221ln 0.287369ln 116.43v w RT v ==⨯⨯=-kJ kg()1.293146.4116.438.8 kJ W mw ==⨯-=4-12 1112101.3ln101.3150ln 59250 kJ 5000p Q pV p ==⨯⨯=- 4-13 101.3256000.21550.2872733600pV mRT ⨯===⨯⨯ kg/s 1,120.1ln 0.21550.287293ln 37.8 kW 0.8s T p W mRTp ==⨯⨯=- 112,1 1.411.4111.40.2872930.8 0.2155151.3 kW 1.410.1s SRT p W m p κκκκ--⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=-⎪⎢⎥-⎝⎭⎣⎦4-14 1600 kg/h kg/s 6m== ⑴定温压缩11210.1ln 0.287293ln 25.1 kW 60.6s T p W mRTp ⋅==⨯⨯=- ⑵定熵压缩112,1 1.411.4111 1.40.2872930.6 132.8 kW 6 1.410.1s SRT p W m p κκκκ--⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=-⎪⎢⎥-⎝⎭⎣⎦⑶多变压缩 112,1 1.2211.22111 1.220.2872930.6 129.6 kW 6 1.2210.1n n s nnRT p W m n p --⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=- ⎪⎢⎥-⎝⎭⎣⎦4-15 压缩比2160.160p p ==,应采用二级压缩20.775 MPa p == ∵13322n nT p T p -⎛⎫= ⎪⎝⎭,2120T T '==℃ (冷却至初温)∴1 1.2511.2533226293441.90.775n np T T p --'⎛⎫⎛⎫==⨯= ⎪⎪⎝⎭⎝⎭K3168.8t =℃ 4-16 ()()()()()2121122112ln ln ln 0.50.1 1.130.5289ln ln ln 0.1348p p p p n v v p T p T ====⎛⎫⋅ ⎪⎝⎭111100400482.3 kg/min 8.04 kg/s 0.287289p V mRT ⨯====⨯ ()()12 1.130.2878.042893481 1.1311183 kWs nR W mnwm T T n ⨯==-=⨯---=- ()()21 1.13 1.48.040.7233482891 1.131 712.3 kW 42738 kJ/minv n Q m c T T n κ--=-=⨯⨯⨯---=-= 4-17 12111v p c p λ⎡⎤⎛⎫⎢⎥=-- ⎪⎢⎥⎝⎭⎣⎦⑴ n =1.4,11.40.510.0610.870.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦⑵ n =1.25,11.250.510.0610.840.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦ ⑶ n =1.0,11.00.510.0610.760.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦4-18 ()21w pw a n m c t m c T T ∆=--111100250297.3 kg/h 0.08258 kg/s 0.287293a p V m RT ⨯====⨯ ()()()2112 4.186846514297.3293423 0.705 kJ/kg Kw pw w pw n a a m c t m c t c m T T m T T ∆∆⨯⨯=-==--⨯-=-⋅111n v n n Rc c n n κκκ--==--- 1.40.2870.7051.411 1.200.2870.7051 1.41nn Rc n R c κκκ⨯+---===-+--1.211.2122114230.10.905 MPa 293n n T p p T --⎛⎫⎛⎫==⨯= ⎪⎪⎝⎭⎝⎭()()1211.20.2870.0825829342318.48 kW1.21s a s a anRW m w m nw m T T n ===--⨯=⨯-=-。

第四章 理想气体热力过程一、选择题1.在定容过程中,理想气体的内能变化Δu =D A .⎰21dT c p B .⎰21pdvC .⎰21vdpD .⎰21dT c v2.在定熵过程中,理想气体的内能变化Δu =BDA .⎰21dT c p B .-⎰21pdv C .-⎰21vdp D .⎰21dT c v3. 在定压过程中,理想气体的内能变化Δu =D A .⎰21dT c p B .⎰21pdvC .⎰21vdpD .⎰21dT c v4.在定熵过程中,理想气体的焓的变化Δh =AC A .⎰21dT c p B .⎰21pdvC .⎰21vdpD .⎰21dT c v5.理想气体定容过程中,焓的变化Δh =B A .c v ΔT B .c p ΔT C .u+pv D .w t6.理想气体定温过程的热量q 等于BCD A .c n ΔT B .w t C .T Δs D .w 7.理想气体等温过程中,q ,w ,w t 间的关系为DA .q> w t >wB .q=w< w tC .q>w= w tD .q=w= w t8.理想气体绝热过程初终态温度,压力的关系为A A .12T T =κκ112-⎪⎪⎭⎫ ⎝⎛p pB . 21T T = κκ112-⎪⎪⎭⎫ ⎝⎛p pC .12p p = κκ112-⎪⎪⎭⎫ ⎝⎛T T D .21p p = κκ112-⎪⎪⎭⎫⎝⎛T T9.理想气体多变过程内能变化Δu 等于B A .c n ΔT B .c v ΔT C .c p ΔT D .R ΔT 10.理想气体多变过程焓的变化Δh 等于C A .c n ΔT B .c v ΔT C .c p ΔTD .R ΔT二、填空题1.Rg=0.297kJ/(kgK)的1kg 双原子理想气体在定压下吸热3349kJ ,其内能变化Δu = 。
2.Rg=0.26kJ/(kgK)、温度为T =500K 的1kg 理想气体在定容下吸热3349kJ ,其熵变Δs = 。


第4章 理想气体热力过程及气体压缩4.1 本章基本要求熟练掌握定容、定压、定温、绝热、多变过程中状态参数p 、v 、T 、∆u 、∆h 、∆s 的计算,过程量Q 、W 的计算,以及上述过程在p -v 、T -s 图上的表示。
4.2 本章重点结合热力学第一定律,计算四个基本热力过程、多变过程中的状态参数和过程参数及在p -v 、T -s 图上表示。
本章的学习应以多做练习题为主,并一定注意要在求出结果后,在p -v 、T -s 图上进行检验。
4.3 例 题例1.2kg 空气分别经过定温膨胀和绝热膨胀的可逆过程,如图4.1,从初态1p =9.807bar,1t =300C 膨胀到终态容积为初态容积的5倍,试计算不同过程中空气的终态参数,对外所做的功和交换的热量以及过程中内能、焓、熵的变化量。
图4.1解:将空气取作闭口系对可逆定温过程1-2,由过程中的参数关系,得bar v v p p 961.151807.92112=⨯== 按理想气体状态方程,得111p RT v ==0.1677kg m /3125v v ==0.8385kg m /312T T ==573K 2t =300C气体对外作的膨胀功及交换的热量为1211lnV V V p Q W T T ===529.4kJ 过程中内能、焓、熵的变化量为12U ∆=0 12H ∆=0 12S ∆=1T Q T=0.9239kJ /K 或12S ∆=mRln12V V =0.9238kJ /K 对可逆绝热过程1-2′, 由可逆绝热过程参数间关系可得kv v p p )(211'2= 其中22'v v ==0.8385kg m /3 故 4.12)51(807.9'=p =1.03barRv p T '''222==301K '2t =28C气体对外所做的功及交换的热量为)(11)(11'212211T T mR k V p V p k W s --=--==390.3kJ 0'=s Q过程中内能、焓、熵的变化量为kJ T T mc U v 1.390)(1212''-=-=∆或kJ W U 3.390212'-=-=∆kJ T T mc H p 2.546)(1212''-=-=∆ '12S ∆=0例2. 1kg 空气多变过程中吸取41.87kJ 的热量时,将使其容积增大10倍,压力降低8倍,求:过程中空气的内能变化量,空气对外所做的膨胀功及技术功。

冷源吸热,则S sio ( 2.055 2.640 0)kJ/K 0所以此循环能实现。
效率为c1 T2 1 303K 68.9%cT 1 973K而欲设计循环的热效率为800kJ1 60% c 2000 kJ c 即欲设计循环的热效率比同温度限间卡诺循环的低,所以循环可行。
(2)若将此热机当制冷机用,使其逆行,显然不可能进行,因为根据上面的分析,此 热机循环是不可逆循环。
当然也可再用上述3种方法中的任一种,重新判断。
欲使制冷循环能从冷源吸热 800kJ ,假设至少耗功 W min ,4. 4 典型例题精解 4.4 .1 判断过程的方向性,求极值 例题 4-1 欲设计一热机, 使之能从温度为 973K 的高温热源吸热 2000kJ ,并向温 度为 303K 的冷源放热 800kJ 。
(1)问此循环能否实现?(2)若把此热机当制冷机用,从 冷源吸热 800K ,能否可能向热源放热 2000kJ ?欲使之从冷源吸热 800kJ,至少需耗多少功? 解 (1)方法1:利用克劳修斯积分式来判断循环是否可行。
如图4- 5a 所示。
Q |Q 1| |Q 2| 2000kJ -800kJ = -0.585kJ/K <0T r T 1 T 2 973K 303K 所以此循环能实现,且为不可逆循环。
方法2:利用孤立系统熵增原理来判断循环是否可行。
如图4- 源、冷源及热机组成,因此 5a 所示,孤立系由热 S iso S H S L S E S E 0 a ) 式中: 和分别为热源及冷源的熵变; 原来状态,所以 为循环的熵变,即工质的熵变。
因为工质经循环恢复到而热源放热,所以 S Eb )S H|Q 1 | T 12000kJ2. 055 k J/ K973Kc )SL|Q 2 |T2800kJ2. 640kJ/K303Kd )将式( b )、( c )、(d ) 代入式( a ),得方法3:利用卡诺定理来判断循环是否可行。


工程热力学习题答案第四章-第四章4-1 1kg 空气在可逆多变过程中吸热40kJ ,其容积增大为1102v v =,压力降低为8/12p p =,设比热为定值,求过程中内能的变化、膨胀功、轴功以及焓和熵的变化。
解:热力系是1kg 空气过程特征:多变过程)10/1ln()8/1ln()2/1ln()1/2ln(==v v p p n =0.9 因为T c q n ?=内能变化为R c v 25==717.5)/(K kg J ? v p c R c 5727===1004.5)/(K kg J ?=n c ==--v vc n kn c 51=3587.5)/(K kg J ? n v v c qc T c u /=?=?=8×103J膨胀功:u q w ?-==32 ×103J 轴功:==nw w s 28.8 ×103J焓变:u k T c h p ?=?=?=1.4×8=11.2 ×103J熵变:12ln 12ln p p c v v c s v p +=?=0.82×103)/(K kg J ? 4-2有1kg 空气、初始状态为MPa p 5.01=,1501=t ℃,进行下列过程:(1)可逆绝热膨胀到MPa p 1.02=;(2)不可逆绝热膨胀到MPa p 1.02=,K T 3002=;(3)可逆等温膨胀到MPa p 1.02=;(4)可逆多变膨胀到MPa p 1.02=,多变指数2=n ;试求上述各过程中的膨胀功及熵的变化,并将各过程的相对位置画在同一张v p -图和s T -图上解:热力系1kg 空气(1)膨胀功:])12(1[111kk p p k RT w ---==111.9×103J熵变为0(2))21(T T c u w v -=?-==88.3×103J12ln12lnp p R T T c s p -=?=116.8)/(K kg J ? (3)21ln1p p RT w ==195.4×103)/(K kg J ? 21lnp p R s =?=0.462×103)/(K kg J ? (4)])12(1[111nn p p n RT w ---==67.1×103Jnn p p T T 1)12(12-==189.2K12ln 12lnp p R T T c s p -=?=-346.4)/(K kg J ?4-3 具有1kmol 空气的闭口系统,其初始容积为1m 3,终态容积为10 m 3,当初态和终态温度均100℃时,试计算该闭口系统对外所作的功及熵的变化。
第四章思考题4-1 容器被闸板分割为A 、B 两部分。
A 中气体参数为P A 、T A ,B 为真空。
现将隔板抽去,气体作绝热自由膨胀,终压将为P 2,试问终了温度T 2是否可用下式计算?为什么?122()k k A Ap T T p -=答:气体作绝热自由膨胀是不可逆绝热过程,因此终了温度T 2不可用上式计算。
4-2 今有任意两过程a-b ,b-c ,b 、c 两点在同一定熵线上,如图所示。
试问:Δuab 、Δuac 哪个大?再设b 、c 两点在同一条定温线上,结果又如何?答:由题可知,因b 、c 两点在同一定熵线上T b >T c , ub >uc . Δuab >Δuac 。
若b 、c 两点在同一条定温线上,T b =T c , ub =uc . Δuab =Δuac 。
4-3将满足下列要求的多变过程表示在p-v 图和T-s 图上(工质为空气)。
(1)工质又升压、又升温、又放热; (2)工质又膨胀、又降温、又放热;(3)n=1.6的膨胀过程,判断q ,w ,Δu 的正负;答:n=1.6的压缩过程在p-v 图和T-s 图上表示为1→2过程。
在此过程中q>0, w<0,Δu>0(4)n=1.3的压缩过程,判断q ,w ,Δu 的正负。
答:n=1.3的压缩过程在p-v 图和T-s 图上表示为1→2过程。
在此过程中q<0,w<0,Δu>04-4将p-v 图表示的循环,如图所示,表示在T -s 图上。
图中:2-3,5-1,为定容过程;1-2,4-5为定熵过程;3-4为定压过程。
答:T-s 图如图所示4-5 以空气为工质进行的某过程中,加热量的一半转变为功,试问过程的多变指数n 为多少?试在p-v 图和T-s 图上画出该过程的大概位置(比热容比可视为定值)。
答:多变过程中,遵循热力学第一定律q u w =∆+,由题可知12q u =∆,由于v 21()1n -k q c T T n =--,所以()v 21v 21()()21n -k c T T c T T n -=--即:()121n -k n =-,0.6n =4-6如果采用了有效的冷却方法后,使气体在压气机汽缸中实现了定温压缩,这时是否还需要采用多级压缩?为什么?(6分) 答:还需要采用多级压缩,由余隙效率可知,12111n v p c p λ⎡⎤⎛⎫⎢⎥=-- ⎪⎢⎥⎝⎭⎢⎥⎣⎦,余隙使一部分气缸容积不能被有效利用,压力比越大越不利。
工程热力学04章习题提示与答案习题提示与答案第四章理想气体的热力过程kg二氧化碳,其压力为0.1MPa、温度为274-1设气缸中有0.1℃。
如进行一个定压过程,气体对外kJ。
设比热容为定值,试求过程中气体热力学能和熵的变化以及气体吸收的热量。
作功3提示:理想气体;Q=ΔU+W;ΔU=mcV0ΔT;Δcp0lnT2pRgln2。
T1p1答案:ΔU=10.5kJ,ΔS=0.03611kJ/K,Q=13.5kJ。
4-2有一气缸,其中氮气的压力为0.15MPa、温度为300K。
如果按两种不同的过程变化:(1)在定压K;(2)在定温下压力下降到0.1MPa。
下温度变化到450然后在定容下变化到0.15MPa及450K。
设比热容为定值,试求两种过程中热力学能和熵的变化以及从外界吸收的热量。
提示:略。
答案:(1)Δu=111.15kJ/kg,Δ=0.421kJ/(kg·K),q1-2=155.7kJ/kg。
(2)Δu=111.15kJ/kg,=0.421kJ/(kg·K),q1-3-2=147.25kJ/kg。
4-3设气缸中空气的压力为0.5MPa、温度为600K,若经绝热过程膨胀到0.1MPa,试求膨胀终了的温度及比体积:(1)按定值比热容计算;(2)按空气的热力性质表进行计算。
00提示:(2)STSTRgln21p20,由热力性质表确定T及v。
;依ST2r2 2p1答案:(1)T2=378.8K,v2=1.089m3/kg;(2)T2=382.6K,v2=1.10m3/kg。
MPa。
为使压缩终了时空气温度超过柴4-4柴油机吸气终了时气缸中空气的温度为60℃、压力为0.1油的自燃温度以使其着火,故要求压缩终了的温度至少为720℃。
设比热容为定值及压缩过程的多变指数为1.45,试求柴油机的压缩比(即压缩过程初始容积和终了容积之比)及压缩终了的压力。
提示:ε=v1/v2。
答案:ε=11.33,p2=3.378MPa。
第四章 气体和蒸汽的热力过程4-1 有 2.3kg 的CO ,初态11477K 0.32MPa T p ==,,经可逆定容加热,终温2600K T =,设CO 为理想气体,求U Δ、H Δ、S Δ,求过程功及过程热量。
(1)比热容为定值;(2)比热容为变值,按气体性质表计算。
解 (1)定值比热容2211600K 0.32MPa 0.4025MPa477KT p p T ==×=由附表328.0110kg/mol M −=×,g 38.3145J/(mol K)296.8J(kg K)28.0110kg/molR R M−⋅===⋅×。
g 55296.8J/(kg K)742.1J/(kg K)22V c R ==×⋅=⋅g 77296.8J/(kg K)1038.94J/(kg K)22p c R ==×⋅=⋅21() 2.3kg 742.1J/(kg K)(600477)K 209.94kJ V U mc T T Δ=−=×⋅−=21Δ() 2.3kg 1038.94J/(kg K)(600477)K 293.92kJp H mc T T =−=×⋅−=21600K ln2.3kg 742.1ln0.3916kJ/K477KV T S mc T Δ==×=0W =,209.94JQ U =Δ=(2)变比热容由附表查得 1477K T =时m,113921.704J/mol H =,0m,1211.312J/(mol K)S =⋅2600K T =时m,217612.7J/mol H =,0m,2218.217J/(mol K)S =⋅ m,1m,1113921.704J/mol 8.3145J/(mol K)477K 9955.69J/molU H RT =−=−⋅×=m,2m,2217612.7J/mol 8.3145J/(mol K)600K 12624.0J/mol U H RT =−=−⋅×=3m 32.3kg (12624.09955.69)J/mol219.1010J 28.0110kg/molm U U M−×−Δ=Δ==××3m 32.3kg (17612.713921.704)J/mol303.0810J28.0110kg/mol m H H M−×−Δ=Δ==××000022m,2m,1m,2m,11133lnln600K 2.3kg [218.317211.312]J/(mol K)8.3145J/(mol K)ln 477K 28.0110kg/mol0.418610J/K p T m S n S S R S S R p M T −Δ=−−=−−×−⋅−⋅×=×=×⎛⎞⎛⎞⎜⎟⎜⎟⎝⎠⎝⎠⎛⎞⎜⎟⎝⎠0W =,219.10kJQ U =Δ=4-2 甲烷4CH 的初始状态10.47MPa p =、1393K T =,经可逆定压冷却对外放出热量4110.76J/mol ,试确定其终温及41molCH 的热力学能变化量m U Δ、焓变化量m H Δ。
工程热力学思考题参考答案,第四章Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】第四章气体和蒸汽的基本热力过程 试以理想气体的定温过程为例,归纳气体的热力过程要解决的问题及使用方法解决。
答:主要解决的问题及方法:(1) 根据过程特点(及状态方程)——确定过程方程(2) 根据过程方程——确定始、终状态参数之间的关系(3) 由热力学的一些基本定律——计算,,,,,t q w w u h s ∆∆∆(4) 分析能量转换关系(P —V 图及T —S 图)(根据需要可以定性也可以定量)例:1)过程方程式:T =常数(特征)PV =常数(方程)2)始、终状态参数之间的关系:12p p =21v v 3)计算各量:u ∆=0、h ∆=0、s ∆=21p RInp -=21v RIn v 4)PV 图,TS 图上工质状态参数的变化规律及能量转换情况对于理想气体的任何一种过程,下列两组公式是否都适用答:不是都适用。
第一组公式适用于任何一种过程。
第二组公式21()v q u c t t =∆=-适于定容过程,21()p q h c t t =∆=-适用于定压过程。
在定容过程和定压过程中,气体的热量可根据过程中气体的比热容乘以温差来计算。
定温过程气体的温度不变,在定温过程中是否需对气体加入热量如果加入的话应如何计算答:定温过程对气体应加入的热量过程热量q 和过程功w 都是过程量,都和过程的途径有关。
由理想气体可逆定温过程热量公式2111v q p v In v =可知,故只要状态参数1p 、1v 和2v 确定了,q 的数值也确定了,是否q 与途径无关 答:对于一个定温过程,过程途径就已经确定了。
所以说理想气体可逆过程q 是与途径有关的。
在闭口热力系的定容过程中,外界对系统施以搅拌功w δ,问这v Q mc dT δ=是否成立答:成立。
这可以由热力学第一定律知,由于是定容过2211v v dv w pdv pvpvIn RTIn v v v ====⎰⎰为零。