酶学基础及应用复习提纲
- 格式:doc
- 大小:56.50 KB
- 文档页数:9


复习提纲第一章绪论一、酶工程:酶工程是酶制剂的大批量生产和应用的技术,是将酶学理论与化工技术结合,从应用的目的出发研究酶,并利用酶的催化作用进行物质转化,生产人们所需产品的一项高新技术。
二、酶工程的研究内容(一)化学酶工程:指酶的筛选、制备、化学修饰酶、固定化酶及化学人工酶的研究和应用(二)生物酶工程:酶学和以基因重组技术为主的现代分子生物学技术相结合的产物,主要包括3个方面:①用基因工程技术大量生产酶(克隆酶);②修怖酶基因产生遗传修饰酶(突变酶);③设计新的酶基因合成自然界不曾有的新酶;(三)其他1.酶的非水相催化;2.酶反应器:第三章酶的筛选一、酶的来源少数来自于动植物,多数(80%以上)来源于微生物;微生物作为酶源的优点:(1)种类繁多,凡是动植物体内有的酶几乎都能从微生物中找到.并可根据应用特点和要求,筛选出最佳的产酶菌株;(2)繁殖快,发酵周期短,培养简便,能通过控制培养条件大幅度提高酶的产量;(3)微生物具有较强的适应能力,可采用各种遗传变异手段,培育出新的、更理想菌株。
二、酶的寻找和发现1.反应过程的设计选择合适的反映底物或原料、合成的反应途径以及目标化合物的性质底物:价廉、易合成酶,活性、稳定性、是否易得。
工艺参数的考虑,反应温度、pH值、盐浓度。
反应介质。
资料查阅,是否有已确定的能转化该反应的或与该相似反应的酶2新酶的筛选获得新酶的方法⑴筛选新酶:在不同的自然环境中筛选酶⑵发现现有酶的非自然新活力⑶利用新的反应条件,如改变反应介质,或新的影响因素(如金属离子);⑷酶的改造,主要指利用基因工程技术,突变酶⑸人工酶,化学与非催化剂的组合以获得新的催化剂酶或产酶微生物的筛选(1)从商品酶库中筛选直接使用大量足够供应的市售酶,过程简单。
但只能提供少数的酶源。
(2)从已知菌种来源和菌种保藏中心筛选(3)从自然界发现和筛选产酶微生物(4)从基因库筛选分子筛选,基于序列的筛选。
基于基因的同源性,从已知酶蛋白出发,搜索数据库,PCR及southern杂交,无需酶活。


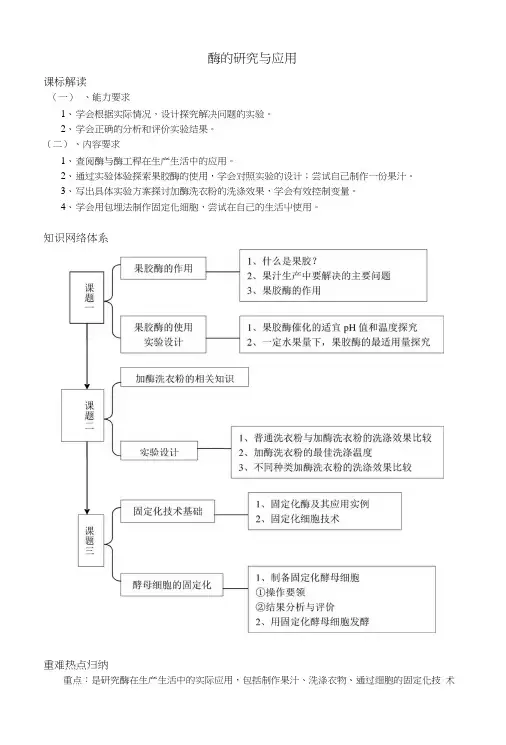
酶的研究与应用课标解读(一)、能力要求1、学会根据实际情况,设计探究解决问题的实验。
2、学会正确的分析和评价实验结果。
(二)、内容要求1、查阅酶与酶工稈在生产生活中的应用。
2、通过实验体验探索果胶酶的使用,学会对照实验的设计;尝试自己制作一份果汁。
3、写出具体实验方案探讨加酶洗衣粉的洗涤效果,学会有效控制变量。
4、学会用包埋法制作固定化细胞,尝试在自己的生活屮使用。
知识网络体系重难热点归纳重点:是研究酶在生产生活中的实际应用,包括制作果汁、洗涤衣物、通过细胞的固定化技术应用酶。
难点:1、如何正确确定实验变量,达到实验目的。
2、如何根据问题写出实验方案。
3、如何正确分析、评价实验结果。
4、固定化技术优势、制作固定化细胞的要领。
复习策略1、查阅酶与酶工程的应用,丰富知识内容2、阅读教材的相关实验和自己的实验设计、实验记录,体会实验设计方法,学写实验方案。
3、分析实验过程,学写分析评价报告。
4、习题训练。
经典例题剖析1.水果罐头盖上印有“如发现盖子鼓起,请勿选购”的字样,引起盖子鼓起的最可能原因是()A、好氧型细菌呼吸,产生CO2和H2OB、酵母菌呼吸,产生CO2和C2H5OHC、乳酸菌呼吸,产生CO2和C3H6O3D、酵母菌呼吸,产生CO2和H2O[解析]罐头是密封、杀菌的,但不排除有微生物的抱子等存活下来,只有进行无氧呼吸的微生物可以生存;罐头鼓胀是过期后微生物生活产气的结果,乳酸菌无氧呼吸产生乳酸,无气体产生;酵母菌既可以在有氧条件下生活,也可以在无氧条件下发酵产生酒精和二氧化碳。
[答案]B2.有人测定了A、B、C、D四种植物体内多种酶的活性与温度的关系,结果如下图所示。
根据图中的信息,你认为在25摄氏度条件下,竞争能力最强的生物和对温度适应范围最广的生物分别是()AB和D BB和C CB和A DA和C[解析]酶活性具有一定的温度范围和适宜温度,温度过高酶会失活,低温对酶活性抑制;在一定温度下,最适宜该温度的酶活性最强,该生物生活的也最好,竞争力就强;酶有活性的范围最大,生物的生存温度范围就越广。

第三章酶[教学目的与要求]一、掌握酶、酶活性中心、酶原及酶原激活、酶共价修饰和同工酶的概念。
二、熟悉酶的分子组成:全酶的组成、辅酶与辅基、金属离子的作用、维生素构成的辅酶与辅基。
三、掌握酶促反应的特点;掌握影响酶的反应动力学因素、Km 与Vm的意义、酶的最适温度、最适pH、可逆性抑制作用的概念、类型及其特点。
四、了解酶促反应的机制;酶浓度和激活剂对反应速度的影响、酶活性测定及酶活性单位;酶含量调节、酶的命名与分类、酶与医学的关系。
五、熟悉不可逆性抑制作用的概念、类型及其特点;酶原激活的机理、酶的变构调节、化学修饰调节的特点、乳酸脱氢酶同工酶的种类、分布、功能及临床意义。
[重点]1.酶、酶的活性中心、同工酶等的概念;2.酶促反应的特点;3.酶促反应的动力学特点:酶浓度温度,PH,底物浓度对反应速度的影响;4.竞争性,非竞争性抑制的特点。
[难点]1.酶促反应的作用机制;2.米-曼氏方程式的推导, 三种抑制作用的动力学特征;3.酶的活性调节。
[学时]:4学时第三章酶第一节酶的分子结构与功能一、酶的分子组成(一)酶的分子组成(图4-1)单纯酶结合酶全酶:指结合酶的酶蛋白和辅助因子结合后形成的复合物。
酶蛋白:指结合酶的蛋白质部份。
辅酶:指结合酶的非蛋白质部分,它与蛋白质结合的方式比较疏松。
辅基:也是结合酶的非蛋白质部分,它与酶蛋白结合比较牢固,不能用透析法或超滤法除去。
酶促反应的特异性及高效率取决于酶蛋白。
辅助因子则起对电子,原子或某些化学基团的传递作用(二)辅酶与辅基1.小分子有机化合物2.金属离子金属离子在酶促反应中的作用是什么?(1)催化作用:(2)氧化还原作用二、酶的活性中心与必需基因1.酶活性中心的定义2.必需基团(1)定义:酶分子上与酶活性有关的化学基团,称为酶的必需基团(essential group)。
(2)分类:结合基团(binding group):指在活性中心内能与作用物结合的必需基团。

酶考纲考点酶学概论酶的概念酶的催化特点酶的组成酶底物的专一性酶的命名与分类影响酶促反应的因素酶促反应速度的测定多种因素对酶促反应的影响酶的作用机理酶的活性中心酶与底物分子的结合影响酶催化效率的因素别构酶同工酶诱导酶基本知识点酶通论新陈代谢是生命活动的基础,是生命活动最重要的特征,而构成新城代谢的许多复杂而有规律的物质变化和能量变化,都是在酶催化下进行的。
生物的生长发育、繁殖、遗传、运动、神经传导等生命活动都与酶的催化过程紧密相关,可以说没有酶的参与,生命活动一刻也不能进行。
Payen和Persoz 首先发现了酶Fisher提出了酶和底物的“锁与钥匙”学说,可以解释酶作用的专一性Henri提出了酶与底物的中间复合物学说Northrop和Kunitz得到了胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶结晶,并用相应方法证明酶是一种蛋白质后,酶是蛋白质的属性才逐渐被人所接受。
Cech和Altman分别发现了具有催化功能的RNA-核酶,这一发现打破了人们对酶的传统观念。
酶与一般催化剂的比较酶作为生物催化剂和一般催化剂相比有其共同性,首先酶和其他催化剂一样,都能显著改善化学反应速率,使之加快达到平衡,但不能改变反应的反应常数,酶本身在反应前后也不发生变化。
在一个化学反应体系中个,因为各分子所含能量高低不同,每一瞬间并非全部反应物分子都能进行反应,只有那些具有高能量,处于活化态的分子即活化分子,反应中活化分子越多,则反映速率越快。
活化分子要比一般分子高出一定的能量称为活化能。
活化能定义:在一定温度下1摩尔底物全部进入活化态所需要的自由能反应所需活化能越高,相对的活化分子就越少,反应速率越慢。
在有催化剂存在时,由于催化剂能瞬时的与反应物结合成过渡态,因而降低了反应所需的活化能。
酶作为催化剂比一般催化剂更能显著得降低活化能,催化效率更高酶作为生物催化剂的特点1.酶易失活:酶是细胞产生的生物大分子,凡能使生物大分子变性的因素都能够使酶失去催化活性2.酶具有很高的催化效率:通常用酶的转换数(TN)来表示酶的催化效率,是指在一定条件下每个酶分子转换底物的分子数,3.酶具有高度专一性:所谓高度专一性是指酶对催化的反应和反应物有严格的选择性。

酶工程复习纲要题型及分值:1、名词解释15分,5个名词2、判断题15分,10小题3、填空题20-24分,每空1分或0.5分4、问答题31-35分,4小题5、计算题15分,2小题复习要点:第一章1、酶工程的概念及酶工程研究的内容。
2、酶学的发展史及标志酶的概念第二章1、简述酶的活性中心的特点、组成及酶的作用机理(重点共价催化与酸碱催化)。
2、简述酶的特性,并举例详述酶的专一性。
3、某酶的初提取液经过一次纯化后,经测定得到下列数据,试计算比活力,回收率及纯化倍数。
初提取液:体积120ml ,活力单位200 u/ml ,蛋白氮2.5mg/ml ;硫酸铵沉淀后:体积5ml ,活力单位810 u/ml ,蛋白氮1.5mg/ml4、酶的系统分类、酶的生产方法和分离纯化、酶活力的概念,比活力的概念5、盐析法,凝胶过滤法及离子交换法分离酶的原理6、米氏方程的意义7、酶的可逆抑制作用的类型及特点第三章1、什么是固定化技术?酶为什么要固定化?固定化酶与游离酶相比有什么优缺点?举例(2个)说明酶被固定后,产生的效果。
2、氨基酰化酶20mL固定化,反应后滤液及洗涤液共50mL。
若原酶活力1000u/mL,洗涤液活力20u/mL。
0.5g固定化酶活力为100u(共得50g固定化酶)。
问固定化酶的相对活力是多少?回收率及结合率是多少?3、酶的固定化法有哪些,各有什么优缺点?第五章1、什么是酶分子的修饰?为什么要进行酶分子的修饰?酶分子修饰后,酶的性质有有什么变化?2、解释酶的大分子修饰、酶的化学交联修饰,酶的亲和修饰的概念。
第六章:核酶1、核酶的定义2、核酶的种类第七章:抗体酶、模拟酶、印迹酶1、概念:抗体酶、模拟酶2、抗体酶的设计思路及制备方法(两种方法)。
4、模拟酶的定义及其分类。
5、什么是环糊精,简要说明是怎样用环糊精来模拟胰凝乳蛋白酶的?6、印迹技术、模板分子、印迹聚合物、印迹酶。
7、简述印迹聚合物的制备过程。
第八章:非水介质中酶催化反应1、何谓酶的非水相催化,非水相酶促反应的优势是什么?2、常见的有机介质反应体系的种类。

1.固定化定义:是通过物理的或化学的手段,将酶束缚于水不溶的载体上,或将酶束缚在一定的空间内,限制酶分子的自由流动,但能使酶充分发挥催化作用。
优点:易于与产物分离;可反复使用;可连续化生产;稳定性好。
2.酶的固定化方法:吸附法、共价偶联法、交联法、包埋法(网格型,微囊型)3.固定化酶的性质:①活性:酶活性↓,反应速度↓。
通常<天然酶。
②稳定性:固定化酶的稳定性一般比游离酶的稳定性好。
③最适温度:多数酶固定化后热稳定性↑,最适温度↑④最适pH :带负电荷载体:最适pH 向碱性偏移。
反之。
⑤动力学特征:固定化载体与底物电荷相反,固定化酶的表观Km值降低。
反之⑥作用专一性:大分子底物难于接近酶分子,导致酶的专一性发生改变。
4.盐析法:利用不同蛋白质在不同的盐浓度下溶解度不同的特性,在酶液中添加一定浓度的中性盐,使酶或杂质从溶液中析出沉淀,使酶与杂质分离。
有机溶剂沉淀法:利用酶与其它杂质在有机溶剂中的溶解度不同,通过添加一定量的某种有机溶剂,使酶或杂质沉淀析出,从而使酶与杂质分离。
膜分离技术:借助于一定孔径的高分子薄膜,将不同大小、不同形状和不同特性的物质颗粒或分子进行分离的技术称为。
5.凝胶层析:以各种多孔凝胶为固定相,利用流动相中所含各种组分的相对分子质量不同而达到物质分离亲和层析:利用生物分子与配基之间所具有的专一而又可逆的亲和力,使生物分子分离纯化电泳技术:是根据各种带电粒子在电场中迁移速度的不同而对物质进行分离的实验技术。
6.酶的总活力为样品的全部酶活力。
总活力= 酶活力×总体积(mL)或总质量g。
比活力:单位蛋白质(毫克蛋白质或毫克蛋白氮) 所含有的酶活力(单位/毫克蛋白) 。
回收率:指每一步所得的总活力与第一步总活力之比。
回收率=每次总活力/第一次总活力7.酶的制剂形式:固体:干燥(冰冻升华,喷雾干燥,真空干燥);液体酶的保存方法(1) 温度。
(2) pH与缓冲液。
(3) 酶蛋白浓度。

食品酶学第一章绪论1、酶学:是研究酶的结构、性质、作用原理和作用规律、生物学功能及应用的一门学科。
2、酶:由生物活细胞产生的,具有高效和专一的催化功能的生物大分子。
3、酶活:指酶催化某一化学反应的能力。
它表示样品中酶的有效含量。
(U)4、酶活单位:1min内催化1mol分子底物转化的酶量称该酶的一个活力单位。
(IU)5、酶总活力:样品的全部酶活力。
(总活力=酶活力*总体积)6、比活力:单位蛋白质所含有的酶活力。
是酶的纯度指标,与纯度成正比。
7、回收率:提纯后与提纯前的酶活力之比。
表示在提纯过程中酶的损失程度。
(回收率↑损失程度↓提纯倍数↓)8、提纯倍数:提纯前与提纯后的酶的比活力之比。
表示酶提纯过程中酶纯度提高的程度。
(提纯倍数↑提纯程度越↑提纯效果↑)9、酶活的测定方法:通过测定酶促反应过程中单位时间内反应物的减少量,或产物的生成量,即测定酶促反应的速率来确定的。
10、一般催化剂的共有特性(1)只改变反应的速率,不改变反应的性质、方向、平衡点(2)在反应过程中不消耗(3)降低反应的活化能11、生物催化剂的特性高效性、高度专一性、高度受控性、易变性、代谢相关性12、酶的命名方法:习惯命名法、系统命名法13、酶分六大类:水解酶、裂解酶、合成酶;转移酶、异构酶、氧化还原酶14、第二章酶的生产与分离纯化1、微生物酶源的优点(1)容易得到生产所需的酶类微生物种类繁多,来源广泛,理论上可利用微生物生产任何一种酶类(2)容易获得高产菌株通过菌种筛选和人工诱导,使微生物定向高产所需的酶类(3)生产周期短、成本低、不受季节的控制(4)易于分离提纯2、酶分离纯化的总原则:(1)明确原料的特性与数量(2)了解所分离酶的结构特点,及在细胞中的存在状态(3)建立一个可靠和快速的测定酶活和纯度的方法(4)了解各种方法的原理、特性、优缺点(5)各种方法的使用顺序要安排得当(6)时刻防止酶变性(7)充分考虑各种因子的影响和实际的试验条件3、酶的提取方法(1)机械法:高速组织捣碎机、匀浆器、研磨器①高速组织捣碎机:操作简便,破碎效果好;但易引起局部高温导致酶失效,使用时需考虑酶的特点谨慎使用②细胞匀浆器:细胞破碎程度比高速组织捣碎机要好,且机械切力小,不易破坏生物大分子;但处理量小③细胞研磨器:(2)物理法:冻融法、加压破碎法、冷热破壁法、超声波破壁法①冻融法:(-15℃冰冻,室温融化)反复冻融后细胞结构遭到破坏,大部分细胞可被破坏,适用于细胞壁比较脆弱的细胞②加压破碎法:③渗透压法:先高渗,再突然转入低渗或水溶液,适用于细胞壁比较脆弱的细胞④冷热破壁法:(沸水中90℃左右数分钟,再浸入冰水中迅速冷却,如此反复多次)(3)生物化学法:酶处理法、细胞自溶法、丙酮干粉法①酶处理法:外源的溶菌酶or各种细胞壁酶进行水解,使细胞内容物释放,成本高,且不利于后期酶的除杂②细胞自溶法:在一定pH和T下,利用组织细胞中自身的酶对细胞降解,历时较长,不易控制,成分复杂,可能破坏待分离酶。

酶复习理解
一、酶概念的理解:
1、来源:。
2、功能:。
3、化学本质:。
二、酶的作用:
作用及原因。
三、理解酶的特性:
1、理解掌握P78酶具有高效性实验
(1)、实验原理理解:。
(2)、实验思路。
(3)、自变量。
(4)、因变量。
(5)、无关变量。
(6)、观察的现象。
2、酶专一性实验的理解
根据所给材料分析思考提出该实验的依据的原理、方法思路及检测。
淀粉、蔗糖、淀粉酶、蔗糖酶、斐林试剂、碘液等其它实验一应用具。
(1)、实验原理。
(2)、实验思路。
(3)、主要掌控的无关变量:。
(4)、检验与观察的理解:。
3、探究不同温度、PH对酶活性的影响实验主要思路的理解
用淀粉、淀粉酶斐林试剂、碘液等其它实验一应用具。
(1)、实验思路:
(2)、过程掌控中主要注意点:(从操作顺序方向考虑)
(3)、检验与观察的注意与理解(从是否相同和不同考虑):
(4)、归纳温度、PH对酶活性的影响:
①。
②。
③。
④。
⑤。
⑥。
1.2.3.。
4.工业上最常用的是液体深层发酵5.酶的分离纯化方法根据酶和杂蛋白的性质差异,它们的分离方法可分为:(1)根据分子大小而设计的方法。
如离心分离法、筛膜分离法、凝胶过滤法等。
(2)根据溶解度大小分离的方法、如盐析法、有机溶剂沉淀法、共沉淀法、选择性沉淀法、等电点沉淀法等。
(3)按分子所带正负电荷多少分离的方法,如离子交换分离法、电泳分离法、聚焦层析法等。
(4)按稳定性差异建立的分离方法,如选择性热变性法、选择性酸碱变性法、选择性表面变性法等。
(5)按亲和作用的差异建立的分离方法,如亲和层析法、亲和电泳法等。
6.(1)凝胶过滤层析的原理a. 小分子由于扩散作用进入凝胶内部被截留;大分子被排阻在颗粒外,在颗粒间迅速通过。
b. 1.蛋白质混合物上柱,2. 洗脱开始,小分子扩散进入凝胶颗粒内大分子被排阻在颗粒外,3. 小分子被截留,大分子向下移动,大小分子分开,4. 大小分子完全分开,5. 大分子行程较短,已洗脱出层析柱,小分子尚在行进中。
7.酶活力:指酶催化反应的能力,它表示样品中酶的含量。
酶活力单位:即酶单位(U),是衡量酶活力的大小即酶含量的多少的指标。
在一定条件下,一定时间内将一定量的底物转化为产物所需的酶量。
(U/g或U/ml)比活力:指单位蛋白质(毫克蛋白质或毫克蛋白氮) 所含有的酶活力(单位/毫克蛋白) 。
比活力是酶纯度指标,比活力愈高表示酶愈纯,即表示单位蛋白质中酶催化反应的能力愈大8.影响酶保存期的因素(1) 温度(2) pH与缓冲液(3) 酶蛋白浓度(4) 氧(5)稳定剂9.固定化酶的定义:固定化酶(immobilized enzyme),是指在一定的空间范围内起催化作用,并能反复和连续使用的酶。
10.固定化酶的优点(1)同一批固定化酶能在工艺流程中重复多次地使用;(2)固定化后,和反应物分开,有利于控制生产过程,同时也省去了热处理使酶失活的步骤;(3)稳定性显著提高;(4)可长期使用,并可预测衰变的速度;(5)提供了研究酶动力学的良好模型。
(整理)酶⼯程复习提纲酶⼯程复习提纲第⼆章酶的定义、组成、特征及分类⼀、从化化学本质上讲酶到底是⼀种什么物质?⼆、⼀般催化剂的特性:1.只能进⾏热⼒学上允许进⾏的反应;2.可以缩短化学反应到达平衡的时间,⽽不改变反应的平衡点;3.通过降低活化能加快化学反应速度。
4.它本⾝的数量和化学性质在化学反应后不发⽣改变。
三、酶作为催化剂的显著特点:⾼效、专⼀、温和、可调节四、酶的分类(⼀)、酶的组成分类单纯酶:它们的组成为单⼀的蛋⽩质。
结合酶(全酶):蛋⽩质(酶蛋⽩)+辅因⼦酶蛋⽩决定反应的特异性,辅因⼦决定反应的类型与性质。
辅因⼦:辅酶:与酶蛋⽩结合疏松,可⽤透析或超滤的⽅法除去的辅因⼦。
辅基:与酶蛋⽩结合紧密,不能可⽤透析或超滤的⽅法除去的辅因⼦。
(⼆)、酶的结构分类(1)、单体酶(monomeric enzyme) :仅具有三级结构的酶,即只由⼀条肽链组成的酶。
(2)、寡聚酶(oligomeric enzyme):两个或两个以上的相同或不同亚基以共价键⽅式连接⽽形成的酶。
(3)、多酶复合体(多酶体系,multienzyme system):由⼏种功能不同的酶聚合在⼀起,分⼯合作。
共同催化⼀个⽣化反应过程。
(4)、多功能酶(multifunctional enzyme):⼀些多酶体系在进化的过程中由于基因融合,致使多种不同催化功能存在于⼀条多肽链上,这种⼀条肽链具有多种催化功能的酶叫多功能酶。
(三)、酶的功能组成—酶的活性中⼼酶的活性中⼼:与底物结合并进⾏催化反应的特殊的必需基团。
结合基团:决定酶的专⼀性活性中⼼内的必需基团必需基团:催化基团:决定酶的催化性质活性中⼼外的必需基团:维持酶的空间结构和催化功能所必需的基团五、酶的专⼀性;第三章酶的作⽤机理⼀、酶作⽤专⼀性的机制(⼀)“三点结合”的催化理论三点结合”的催化理论认为酶与底物的结合处⾄少有三个点,只有当三点完全结合的情况下。
催化作⽤才能实现,酶促反应才能进⾏。
酶考试大纲及考分预测酶的催化作用及活性中心。
酶的共价修饰及同工酶。
酶的分子结构和催化作用(一)酶的概念:酶是一类由活细胞产生的,对其特异底物具有高效催化作用的有机生物催化剂。
(二)酶的分子组成(三)酶的催化作用酶的活性中心:指酶分子能与底物结合并发生催化作用的局部空间结构。
凡具有活性的酶都具有活性中心。
1.活性中心内的必需集团:它包含两个集团(结合集团和催化集团),其特点是与催化作用直接相关,是酶发挥催化作用的关键部位。
2.活性中心外的必需集团:在活性中心外的区域,还有一些不与底物直接作用的必需基团,这些基团与维持整个酶分子的空间构象有关。
(四)酶促反应的特点酶不仅催化体内化学反应,而且在体外也能发挥催化作用。
1.有效地降低反应的活化能,具有极高的催化能力。
2.高度的专一性3.可调节性(这是与无机催化反应的不同点)4.不稳定性(五)酶-底物复合物酶促反应动力学(一)底物浓度对反应速度的影响米-曼氏方程式[S]:底物浓度。
V:反应速度。
V max:最大反应速度。
K m:等于酶促反应速度为最大反应速度一半时的底物浓度。
(二)最适pH:酶催化活性最大时的环境pH。
(三)最适温度:酶促反应速度最快时的环境温度。
(0-40℃)酶活性的调节1.变构调节2.共价修饰3.酶原激活4.同工酶(1)概念:是指催化相同的化学反应,而酶蛋白的分子结构、理化性质乃至免疫学性质不同的一组酶。
(2)举例:乳酸脱氢酶(LDH1~LDH5共5种同工酶)心、肾以LDH1为主;肺以LDH3和LDH4为主;骨骼肌以LDH5为主;肝以LDH5为主。
血清中LDH含量的顺序是LDH2>LDH1>LDH3>LDH4>LDH5。
核酶例题肝中较丰富的LDH同工酶是A.LDH1B.LDH2C.LDH3D.LDH4E.LDH5『正确答案』E『答案解析』肾以LDH1为主;肺以LDH3和LDH4为主;骨骼肌以LDH5为主;肝以LDH5为主。
酶学复习资料,大家参考好好复习重点内容一1、定义:酶学,食品酶学,酶工程,邻近效应,定向效应,亲核催化,亲电催化,酶的专一性,绝对专一性,相对专一性,立体异构专一性,单纯酶,结合酶,酶的活性中心,同工酶2、酶的一般特征3、酶作为生物催化剂的特点4、与酶的高效率催化有关的因素5、酶专一性学说6、活性中心的共同点7、酶制剂在食品工业中的应用具有显著的优越性8、控制酶活力的方法定义1酶学:是研究酶在细胞内生物合成机理、酶的发酵生产及调节控制、酶分离提纯、酶的作用特性和反应动力学、酶的催化作用机制、酶的固定化技术、酶的分子修饰、酶分子的蛋白质工程改性和酶的应用等内容。
2食品酶学:是以普通酶学为基础,重点研究酶在食品工业领域中的基础应用、酶源开发、酶固定化技术、酶的分子修饰及酶在食品加工及保藏中的应用等内容。
3酶工程:由酶学与化学工程技术、基因工程技术、微生物学技术相结合而产生的一门新的技术科学,亦即将酶或者细胞、细胞器等在一定的生物反应装置中,利用酶所具有的生物催化功能,借助工程手段将相应的原料转化成有用物质并应用于社会的一门科学。
酶工程分为:化学酶工程与生物酶工程。
4邻近效应:指底物的反应基团和酶活性部位的催化基团互相靠近,以及结合在酶活性部位上的两种底物分子之间的互相靠近。
5定向效应:指互相靠近的底物分子之间、底物分子与酶活性部位的催化基团之间形成正确的立体排列方向。
6亲核催化:酶活性中心的亲核催化基团提供一对电子,与底物分子中缺少电子、具有部分正电性的原子形成共价键,从而产生不稳定的共价中间物。
7亲电子催化:酶活性中心的亲电子催化基团,与底物分子的亲核原子形成共价键,从而产生不稳定的共价中间物。
8酶的专一性是指一种酶只能催化一种或一类结构相似的底物进行某种类型的酶反应。
9绝对专一性:指一种酶只能催化一种物质进行反应,这种高度的专一性称绝对专一性。
10相对专一性:一种酶能催化一类结构相似的物质进行某种相同类型的反应,这种专一性称相对专一性。
酶学基础及应用复习提纲酶工程:是将酶学理论与化工技术相结合,研究酶制剂的大规模生产和应用的技术。
包括酶制剂的制备,酶的固定化,酶的修饰与改造及酶反应器等方面内容.绪论一, 酶的化学本质新陈代谢是生命有机体最重要的特征之一,新陈代谢所包括的各种各样的物质变化和能量变化都是在酶的作用下进行的.酶的参与使得这些生物体内的化学反应以极高的效率协调地进行着.酶(enzyme)是一类由活细胞产生的,具有催化活性和高度专一性的生物大分子,是一类生物催化剂。
酶参与的化学反应称为酶促反应,被其作用发生化学变化的物质称为底物。
二, 酶的作用特点酶与一般催化剂的共同点:①能加速化学反应速率,用量少而催化效率高;②在反应过程中本身不被消耗;③只能催化热力学上允许进行的化学反应,降低反应的活化能;④只能缩短反应达到平衡所需的时间,不能改变平衡点;⑤对可逆反应的正反两个方向的催化作用相同。
酶作为生物催化剂的特性:①酶的催化反应条件温和,酶能在常温常压和pH近中性的条件下起催化作用,这是酶作为生物催化剂所必备的条件。
②酶具有很高的催化效率,酶的催化活性比一般催化剂高106~20倍。
③酶具有高度专一性。
酶只能作用于某种物质或某一类结构相似的物质,催化它们进行某种类型的反应,又称为酶作用的特异性。
酶的特异性又可分为绝对特异性、相对特异性、立体异构特异性。
绝对特异性是指一种酶只能作用于特定的底物,发生特定性质的反应,如:脲酶只能作用于尿素催化其进行水解反应,而对尿素的各种衍生物,一般均不起作用。
相对特异性是指一种酶能够催化一类具有相同化学键或相同化学基团的物质进行某种类型的反应。
立体异构特异性是指当底物含有不对称碳原子时,酶只作用于其立体异构体中的一种。
例如乳酸脱氢酶能催化L-乳酸脱氢变为丙酮酸,对D-乳酸则无作用。
D-氨基酸氧化酶能作用于各种D-氨基酸,催化其氧化脱氢,但对L-氨基酸则毫无作用。
④酶的催化活性在体内受到多种因素调节控制酶的调节方式包括抑制剂调节、共价修饰调节、反馈调节、酶原激活及激素控制等,这些方式的存在使得生物体的代谢过程有条不紊地进行。
⑤酶的催化活力与辅酶、辅基及金属离子有关。
.三、酶的分类和命名1955年,为避免酶的命名混乱,当时的国际生物化学协会(现发展为国际生物化学和分子生物学联合会,IUBMB)决定成立了国际酶学委员会(Enzyme Commission)以规范酶的命名。
酶学委员会提出以酶所催化的化学反应性质作为酶的分类和命名规则的主要依据,每一种酶都给以一个惯用名,一个系统名和一个数字编号。
惯用名不需要非常的精确,要求比较简短,使用方便,一般根据酶所作用的底物名称、催化的反应性质、酶的来源或其他特点来进行命名。
许多酶的惯用名是延用系统命名之前就使用的名称。
系统名要求能确切地表明底物的化学本质及酶的催化性质,酶的系统命名由两部分组成:1)酶所作用的底物的名称,若酶催化的反应中有两种底物起反应,则这两种底物均需表明,当中用“:”隔开;2)酶所催化的反应的类型例如:L-乳酸:NAD+氧化还原酶乳酸+ NAD+ 丙酮酸+ NADH + H+根据1961年国际酶学委员会(IEC)的分类法,通常将酶分为六大类:1.氧化还原酶类(oxidoreductases)2.转移酶类(transferases )3.水解酶类(hydrolases)4.裂解酶类(lyases)5.异构酶类( isomerases)6.合成酶类(ligases, synthetases)数字编号:每一种酶都有其对应一个系统编号----EC•*•*•*•*EC----表示国际酶学委员会第一个数字表示酶所属的大类(1-6大类)第二个数字表示酶在该大类中所属的亚类第三个数字表示酶所属的次亚类第四个数字表示酶在所属次亚类中的流水编号例如:EC•1•1•1•27乳酸脱氢酶:表示该酶为氧化还原酶类,底物上发生氧化的供体基团是醇基(亚类),氢的受体是NAD(次亚类),流水编号为27。
第二章酶的结构与功能蛋白酶的基本组成单位:氨基酸酶可根据其化学组成的不同,分为两类:单纯酶和全酶。
全酶= 酶蛋白+ 辅助因子,其中,酶蛋白---- 不能单独表现催化活性的蛋白质部分,与底物结合,决定反应的专一性和高效率。
辅助因子----结合酶中的非蛋白质部分。
辅助因子包括金属离子、辅基、辅酶等,其中有机辅助因子中辅酶与酶蛋白结合疏松,可用透析等方法除去,而辅基与酶蛋白结合紧密,透析等方法不易除去。
酶蛋白和辅助因子单独存在均无催化活性,只有二者结合为全酶才有催化活性。
一般来说,全酶中的辅助因子决定了酶所催化的类型(反应专一性),而酶蛋白则决定了所催化的底物类型(底物专一性)。
酶的结构:略根据酶的聚合状态,酶可分为三类:单体酶——酶蛋白由一个亚基构成的。
寡聚酶——酶蛋白是寡聚蛋白质,由几个至多个亚基组成,以非共价键连接,分子量3.5万~几百万。
多酶复合体——由几种酶通过非共价键形成复合体。
一般由在系列反应中功能相关的酶组成,有利于一系列反应的连续进行。
酶的活性中心:酶分子中直接与底物结合,并催化底物发生化学反应的地方,这种显示酶的催化活性的特殊部位就称为酶的活性中心。
酶的活性中心是由一些氨基酸残基的侧链基团组成,对于结合酶,活性中心常常就是辅酶因子。
活性中心在酶分子总体积中只占相当小的部分(约1%~2%),相当于2~3个氨基酸残基。
大多都是酶分子表面的一个凹穴,为非极性的微环境,有利于与底物结合。
在酶分子中,与酶活性有关的基团称为酶的必需基团,包括活性中心和非活性中心以外的必需基团。
而非必需基团是对酶的活性无明显作用,温和水解掉后,酶仍能表现活性。
可能在酶的调节、运输、降解、免疫等方面具有意义。
活性中心又包括结合基团和催化基团: 结合基团:能与底物结合的必需基团,底物在此与酶分子结合。
一个酶的结合部位又可以分为各种亚位点,分别与底物的不同部位结合。
催化基团:能促进底物发生化学变化的必需基团,底物的敏感键在此被打断或形成新的键,从而发生一定的化学反应。
一个酶的催化部位可以不止一个。
别构酶:有些酶的分子表面除了活性中心外,还具有重要的功能部位——调节中心。
调节中心可以与小分子的代谢物相结合,使酶分子的构象发生改变,从而影响酶的活性。
这种作用叫别构效应;具有别构效应的酶叫别构酶,引起别构的物质叫别构剂(调节物)。
诱导酶:有些酶在通常的情况下不合成或很少合成,当加入诱导物后就会大量合成,这样的酶叫诱导酶。
酶的结构与催化功能的关系酶原的激活:酶原:有些酶,特别是一些与消化作用有关的酶,在最初合成和分泌时,没有催化活性,这种没有催化活性的酶的前体称为酶原;酶原激活:酶原在一定的条件下经过适当的物质作用而转变为有活性的酶的过程,称为酶原的激活,实质上是酶活性部位形成或暴露的过程。
同工酶——高级结构与酶活性关系的典型。
同工酶是指在生物体内或组织中催化相同反应而具有不同分子形式(包括不同的氨基酸序列、空间结构等)的酶。
酶分子的修饰什么是酶分子修饰?酶分子修饰:通过各种方法使酶分子的结构发生某些改变,从而改变酶的某些特性和酶分子 非必需基团必需基团活性中心必需基团活性中心外必需基团结合基团催化基团非活性中心活性中心功能的技术过程称为酶分子修饰。
酶分子修饰的原因及意义由于酶具有反应专一性,催化效率高及反应条件温和等优点,因此在工业,农业,医药和环保等方面已经得到越来越多的应用.但总体还没有达到大规模应用的程度,其主要原因在于酶自身性质上的一些不足,如不稳定性,对pH的要求严格以及具有抗原性等等.因此,人们希望通过各种方法,按照需要定向地改造酶分子,甚至创造出自然界尚未发现的新酶,从而适合各行各业的需要。
酶分子修饰的意义在于:1. 研究酶的结构与功能的关系。
(50年代末)研究和了解酶分子中主链、侧链、组成单位、金属离子和各种物理因素对酶分子空间构象的影响2. 人为改变天然酶的某些性质,扩大酶的应用范围。
(70年代末之后)1)提高酶的生物活性(酶活力)。
2)增强酶的稳定性(热稳定性、体内半衰期)。
3)消除抗原性(针对特异性反应降低生物识别能力)4)产生新的催化能力。
酶分子修饰的设计要点(略)酶分子的修饰方法1、酶分子的主链修饰:利用酶分子主链的切断和连接,使酶分子的化学结构及空间结构发生某些改变,从而改变酶的特性和功能的方法。
2、酶分子的侧链基团修饰:采用一定的方法(一般为化学法)使酶蛋白的侧链基团发生改变,从而改变酶分子的特性和功能的修饰方法。
3、酶分子的组成单位置换修饰:利用基因操作技术、化学法或酶法对酶的一级结构进行改造,使酶的空间构象变得更为稳定,提高酶活力,改变酶的专一性。
4、酶分子的金属离子转换修饰:把酶分子中的金属离子换成另一种金属离子,使酶的特性和功能发生改变的修饰方法称为金属离子置换修饰。
5、酶分子的物理修饰:不改变酶的组成单位及其基团,酶分子中的共价键不发生改变,只是在物理因素的作用下,副键发生某些变化和重排。
可以了解不同物理条件下,特别是在极端条件下(高温、高压、高盐、极端pH值等)由于酶分子空间构象的改变而引起酶的特性和功能的变化情况。
酶修饰后的性质变化:1、热稳定性:一般来说,热稳定性有较大的提高。
2、抗原性:比较公认的是PEG和人血清白蛋白在消除酶的抗原性上效果比较明显。
3、各类失活因子的抵抗力:修饰酶对蛋白酶、抑制剂均有一定的抵抗能力,从而提高其稳定性。
4、半衰期:一般在体内的半衰期得到有效延长。
由于酶分子经修饰后,增强对热、蛋白酶、抑制剂等的稳定性,从而延长了在体内的半衰期。
5、最适pH:大部分酶经化学修饰后,酶的最适pH发生了变化,这种变化在应用研究上有时具有重要意义。
修饰酶最适pH更接近于生理环境,在临床应用上有较大意义。
6、Km的变化:大多数酶经修饰后,Vm没有明显变化,但有些酶经修饰后,Km值变大。
固定化技术游离酶酶对环境十分敏感,稳定性较差,反应过程中反应速度逐渐下降,反应后不能回收,产物的分离纯化较困难,对于现代工业来说并不是一种理想的催化剂。
因此,固定化技术于20世纪60年代迅速崛起,包括酶固定化技术和细胞固定化技术,成为酶工程研究中的一个广阔领域,前景光明固定化酶的定义与特点固定化酶即通过物理的或化学的方法,将酶束缚于水不溶的载体上,或将酶束缚于一定的空间内,限制酶分子的自由流动,但能使酶发挥催化作用的酶。
与游离酶相比:固定化酶的优点表现在:(1)易将固定化酶和底物,产物分开产物溶液中没有酶的残留简化了提纯工艺(2)可以在较长的时间内连续使用(3)反应过程可以严格控制,有利于工艺自动化(4)提高了酶的稳定性(5)较能适于多酶反应(6)酶的使用效率高产率高成本低但固定化酶也有待改进的缺点,比如(1)固定化时酶的活力有损失(2)比较适应于水溶性底物(3)与完整的细胞相比,不适于多酶反应。