温度对反应速率的影响课件
- 格式:ppt
- 大小:291.00 KB
- 文档页数:22










§9.5 温度对反应速率的影响(1) 阿累尼乌斯经验公式前面讨论浓度对反应速率的影响时都以温度一定为前提,现在来讨论温度对反应速率的影响时,也需把浓度的影响消除,所以通常都是讨论速率常数k 随温度的变化。
温度对反应速率的影响比浓度的影响更为显著,一般说来反应的速率常数随温度的升高而很快增大。
关于速率常数k 与反应温度T 之间的定量关系,早在19世纪末,阿累尼乌斯(Arrhenius)等人总结了大量的实验数据提出了下述经验公式2ln a E d kdTRT = (9.24) 式中的E a 称为“实验活化能”,一般可将它看作与温度无关的常数,其单位为J ⋅mol -1或kJ ⋅mol -1。
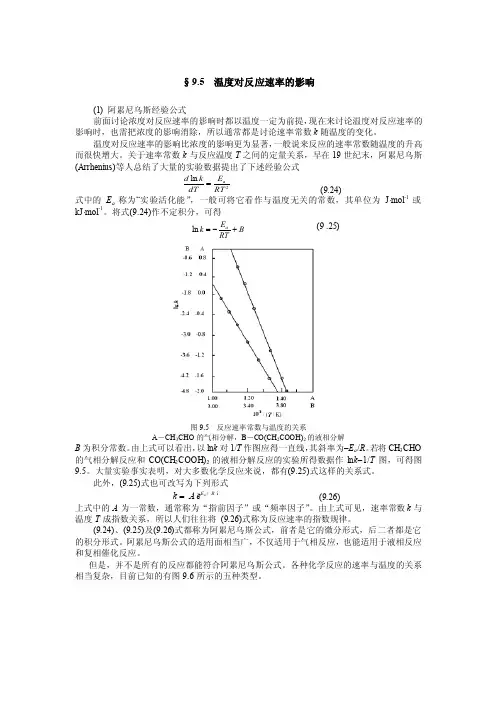
将式(9.24)作不定积分,可得B RTEk a +-=ln (9 .25)图9.5 反应速率常数与温度的关系A -CH 3CHO 的气相分解,B -CO(CH 2COOH)2的液相分解B 为积分常数。
由上式可以看出,以ln k 对1/T 作图应得一直线,其斜率为-E a /R 。
若将CH 3CHO 的气相分解反应和CO(CH 2COOH)2的液相分解反应的实验所得数据作ln k -1/T 图,可得图9.5。
大量实验事实表明,对大多数化学反应来说,都有(9.25)式这样的关系式。
此外,(9.25)式也可改写为下列形式/a E R Tk A e -= (9.26) 上式中的A 为一常数,通常称为“指前因子”或“频率因子”。
由上式可见,速率常数k 与温度T 成指数关系,所以人们往往将 (9.26)式称为反应速率的指数规律。
(9.24)、(9.25)及(9.26)式都称为阿累尼乌斯公式,前者是它的微分形式,后二者都是它的积分形式。
阿累尼乌斯公式的适用面相当广,不仅适用于气相反应,也能适用于液相反应和复相催化反应。
但是,并不是所有的反应都能符合阿累尼乌斯公式。
各种化学反应的速率与温度的关系相当复杂,目前已知的有图9.6所示的五种类型。