课时49原子核外电子排布
- 格式:doc
- 大小:120.00 KB
- 文档页数:4

49号元素的电子排布式49号元素的电子排布式是一种重要的物理概念,它可以帮助我们更好地理解化学中不同元素之间的相互作用。
49号元素是一种稀有金属,也称为“长短锡”,化学符号为In,原子序数为49。
这种元素的原子核由49个质子和50个中子组成,它的电子排布式如下:1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p1。
49号元素的电子排布式是以三个星形最外层电子2s2,2p6为基础,依次向内嵌套其他层次的电子组成的。
最外层的2s2,2p6称为钇组,即把2s2的两个电子放到2p的6个电子中,产生8个电子的总组。
而3s2,3p6称为铋组,4s2,3d10称为锗组,5s2,4d10称为钼组,6s2,4f14,5d10称为镱组,最后的6p1称为镉组。
从上述的电子排布式可以看出,49号元素的电子排布式共有五个能量层,从最外层到最内层依次为K、L、M、N、O四个能量层,K层有2个,L层有8个,M层有18个,N层有32个,O层有1个,总共61个电子。
由此可见,49号元素的电子排布式是一种复杂的电子结构,其中包含了多种原子轨道配置。
49号元素的电子排布式对于理解化学反应至关重要,它有助于我们了解不同元素之间的相互作用。
比如,通过比较其他元素的电子排布式,我们就可以知道49号元素之间的化学性质,以及与其他元素之间的反应特性,例如氧化还原反应,水合反应,离子交换反应等。
另外,49号元素的电子排布式也可以帮助我们了解原子核的结构,从而更好地掌握其表面特性及其他性质。
比如,我们可以根据这种元素的电子排布式来推断它的表面形态,以及它的原子核结构,从而更好地了解它的化学性质。
总之,49号元素的电子排布式是一种重要的知识,它的研究有助于我们更好地理解化学中不同元素之间的相互作用,从而有助于更好地掌握其他元素的性质,提高我们对化学反应的理解。


原子的核外电子排布教案一、教学目标1. 让学生了解原子的基本结构,知道原子由原子核和核外电子组成。
2. 使学生掌握核外电子的排布规律,能运用能量最低原理、泡利不相容原理和洪特规则解释核外电子的排布。
3. 培养学生的观察、分析和推理能力,提高学生对原子结构的理解和运用能力。
二、教学重点与难点1. 教学重点:核外电子的排布规律及其应用。
2. 教学难点:能量最低原理、泡利不相容原理和洪特规则的理解和应用。
三、教学方法采用问题驱动法、案例分析法和小组合作法,引导学生观察、分析和推理,培养学生的科学思维能力。
四、教学准备1. 教学课件:原子的核外电子排布相关图片和动画。
2. 教学素材:有关核外电子排布的案例和练习题。
3. 教学工具:黑板、粉笔、多媒体设备。
五、教学过程1. 导入:通过展示原子结构模型,引导学生回顾原子的基本结构,提出问题:“原子的核外电子是如何排布的?”2. 讲解:讲解原子的核外电子排布规律,包括能量最低原理、泡利不相容原理和洪特规则。
3. 案例分析:分析具体案例,让学生运用核外电子排布规律解释原子光谱、化学性质等现象。
4. 练习:布置练习题,让学生巩固核外电子排布的知识。
5. 总结:对本节课内容进行总结,强调核外电子排布的重要性。
6. 拓展:引导学生思考核外电子排布在其他领域的应用,如材料科学、生物化学等。
7. 布置作业:布置相关作业,巩固所学知识。
8. 课后反思:教师对本节课的教学效果进行反思,为下一步教学做好准备。
六、教学内容与课时安排1. 教学内容:第六章:核外电子的能级和轨道第七章:能量最低原理第八章:泡利不相容原理第九章:洪特规则第十章:核外电子排布的应用2. 课时安排:每章内容安排2课时,共10课时。
七、教学评价1. 课堂参与度:观察学生在课堂上的发言和提问情况,评估学生的参与度。
2. 练习题的正确率:分析学生完成练习题的情况,评估学生对核外电子排布知识的掌握程度。
3. 小组讨论与合作:评价学生在小组讨论和合作中的表现,评估学生的团队协作能力。


第1单元 课时1原子核外电子的排布教学设计一、学习目标1.了解原子核外电子运动的特征。
2.初步掌握原子核外电子排布规律,会画1~18号元素原子结构示意图。
3.培养学生的观察能力、分析能力和抽象思维的能力。
二、教学重点及难点重点:知道原子核外电子是如何分层排布的。
难点:原子核外电子排布规律间相互制约关系。
三、设计思路教学中,首先引导学生观察1~18号元素的原子结构示意图,熟悉这些元素的原子核外电子排布情况,然后采用交流、讨论、归纳、总结的方法,探究原子核外电子的排布规律,得出以下规律:1.电子总是尽量先排布在能量最低的电子层,然后排布在能量较高的电子层。
即电子总是尽量先排在内层。
2.随着核电荷数的增加,元素原子的最外层电子数逐步增加,每一电子层都容纳一定数目的电子。
3.再引导学生观察稀有气体的原子核外电子的排布情况,探究排布规律,通过分析讨论下列规律:(1)各电子层最多容纳的电子数为2n2个(n为电子层序数)。
(2)各稀有气体元素的原子中最外层所容纳的电子数是8(氦除外)。
(3)各元素原子次外层所容纳的电子数最多是18。
四、教学过程[引入]在《化学1》中我们已经学习了原子结构的有关内容,现在,我们先来复习下列内容。
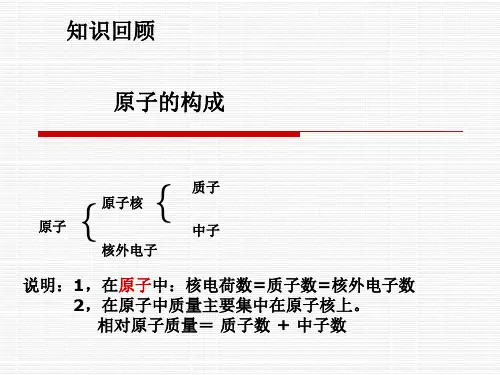
(ppt:2)什么是原子?原子由什么微粒构成的?(原子是化学变化中的最小微粒,它是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成。
)[投影](ppt :3)外电子数核电荷数=质子数=核的负电荷核外电子:带一个单位中子:不带电个单位的正电荷质子:带原子核原子⎪⎩⎪⎨⎧⎩⎨⎧1[投影](ppt :4):资料:核外电子的运动特点(1)电子的质量很小,带负电荷。
(2)电子运动的空间范围小。
(3)电子做高速运动,接近光速。
由于上述原因,核外电子的运动规律与宏观物体不同:它没有确定的轨道,我们不能测定或计算它在某一时刻所在的位置,也不能描绘出它的运动轨道。
[提问]是不是原子核外的电子的运动就没有规律呢?核外电子的运动有什么规律呢?钠原子核外有11个电子,这11个电子是聚成一堆在离核相同的距离处运动,还是分散在离核不同的距离处运动?为什么?(ppt :5)(学生思考)[讲述]在多电子原子里,一方面电子和原子核之间因带有异性电荷而有吸引力,这个吸引力倾向于把电子尽可能拉得靠近原子核。

原子核外电子的排布-人教五四学制版八年级教案
一、基本概念
1.1 原子的结构
原子由带正电荷的原子核和围绕在原子核外的负电子构成。
1.2 电子的能级
在原子中,电子并不随意地运动,而是处于不同的能级中。
1.3 电子云模型
电子云模型是目前较为广泛接受的原子模型,该模型通过描述电子在原子中的云状分布方式,能较好地解释原子的结合性和反应性。
二、电子的排序原则
2.1 能级排序
电子的能级大小按以下顺序排列:n=1, n=2, n=3, n=4……
2.2 规则排序
① 填充原子中最内层的电子,然后逐个填充下一层的电子。
② 同一能级中的电子应先填充未占据的轨道,再填占据轨道的电子。
③ 在填充能级时,应使每个轨道内先填满一个电子,再逐渐向上填满电子,直到不再接受其他电子为止。
三、电子云能区图(SPDF)
3.1 s轨道
s轨道为球形云状,分别位于各个能级的中心位置。
一个s轨道有两个电子,其自旋方向相反。
3.2 p轨道
p轨道为双球形云状,其中一个球形云形在x-y平面,另一个球形云在z轴正方向上。
每个p轨道有两个电子,其自旋方向相反。
3.3 d轨道
d轨道为双扁球状云状,分别位于第三能级以上各自能级的中心点。
每个d轨道有四个电子,其自旋方向相反。
3.4 f轨道
f轨道为复杂的形式,由7个不同的轨道组成。
每个f轨道有六个电子,其自旋方向相反。
四、总结
通过学习原子核外电子的排布,可以更好地理解原子结构及化学反应原理。
在实际科学研究中,更可对物质的性质和应用有更深刻的认识。



初中化学《核外电子排布》教案初中化学《核外电子排布》教案第一章原子结构与元素周期律第一节原子结构一.教材分析(一)知识脉络通过初中的化学学习,同学们已经知道原子是由原子核和核外电子构成的。
本节教材,就是要在已有经验的基础上继续深入地探讨原子核的结构以及核外电子的排布的规律,并利用原子结构的知识解释某些元素的部分性质,使学生初步了解原子的最外层电子排布与元素的性质(得失电子能力、化合价等)的关系。
同时,通过原子结构知识的学习,为后阶段学习元素周期律、元素周期表和分子结构打下基础。
(二)知识框架(三)新教材的主要特点:新教材(必修)与旧教材相比,删掉了描述核外电子运动特征的电子云;降低了核外电子排布规律的要求;增加了原子结构示意图,元素的部分化学性质与原子的最外层电子排布的关系;调整了核素、同位素在教材中出现的位置。
使得它更符合知识的逻辑关系,符合学生认识规律。
同时,新教材更注重了让学生参与学习,提高了学生学习的主动性,更注重了学生能力的培养。
二.教学目标(一)知识与技能目标1.引导学生认识原子核的结构,懂得质量数和A ZX的含义,掌握构成原子的微粒间的关系;知道元素、核素、同位素的涵义;掌握核电荷数、质子数、中子数、质量数之间的相互关系。
2.引导学生了解原子核外电子的排布规律,使他们能画出1~18号元素的原子结构示意图;了解原子的最外层电子排布与元素的原子得、失电子能力和化合价的关系。
(二)过程与方法目标通过对构成原子的微粒间的关系和氢元素核素等问题的探讨,培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
(三)情感态度与价值观目标1.通过构成物质的基本微粒的质量、电性的认识,了解微观世界的物质性,从而进一步认识物质世界的微观本质;通过原子中存在电性不同的两种微粒的关系,认识原子是矛盾的对立统一体。
2.通过人类探索原子结构的历史的介绍,使学生了解假说、模型等科学研究方法和科学研究的历程,培养他们的科学态度和科学精神,体验科学研究的艰辛与喜悦。

课时49 原子核外电子排布【高考说明】1.了解原子核外电子的分层排布,掌握能层、能级及其表示。
2.掌握构造原理及核外电子排布规律,掌握1-36号元素的核外电子排布式3.了解电子云与原子轨道概念,掌握原子轨道数目的判断方法4.了解能量最低原子、基态、激发态、光谱【知识梳理】一、能层与能级对多电子原子的核外电子,按将其分成不同的能层(n);对于同一能层里能量不同的电子,将其分成不同的;能级类型的种类数与能层数相对应;同一能层里,能级的能量按的顺序升高,即E(s)<E(p)<E(d)<E(f)。
完成下表:各能层所包含的能级类型及各能层、能级最多容纳的电子数由表中可知:①各能层最多容纳的电子数为。
②能级类型的种类数与数相对应③原子轨道s、p、d、f 伸展方向分别为、、、,与能级所在能层。
二、电子云与原子轨道1.电子云:电子在原子核外出现的概率密度分布。
电子云是核外电子运动状态的形象化描述,小黑点的疏密表示。
2.原子轨道:不同能级上的电子出现概率约为 %的电子云空间轮廓图。
s电子的原子轨道呈对称, ns能级各有个原子轨道;p电子的原子轨道呈,np能级各有个原子轨道,相互垂直(用p x、p y、p z表示);nd能级各有个原子轨道;nf能级各有个原子轨道。
各轨道的的形状与所处的能层无关。
三、核外电子排布规律1.构造原理:绝大多数基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、、、4p、5s、4d、5p、6s、4f……构造原理揭示了原子核外电子的能级分布。
从中可以看出,不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
构造原理是书写基态原子电子排布式的依据,也是绘制基态原子电子排布图(即轨道表示式)的主要依据之一。
思考:如何快速判断不同能级的能量高低?2.能量最低原理:能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。
即在基态原子里,电子优先排布在的能级里,然后排布在能量逐渐升高的能级里。
当某能级中的原子轨道处于全充满或半充满状态时能量较低。
3.泡利原理:每个原子轨道里最多只能容纳个自旋方向的电子。
4.洪特规则:电子排布在同一能级的各个轨道时,优先占据轨道,且自旋方向。
思考:如何描述原子核外的一个电子的运动?四、基态、激发态、光谱1.基态:最低能量状态。
如处于最低能量状态的原子称为基态原子。
2.激发态:较高能量状态(相对基态而言)。
如基态原子的电子吸收能量后,电子跃迁至较高能级成为激发态原子。
3.光谱:不同元素的原子发生跃迁时会吸收(基态→激发态)和放出(激发态→基态)能量,产生不同的光谱—原子光谱(吸收光谱和发射光谱)。
利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
【例1】下列有关电子云和原子轨道的说法正确的是()A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大【例2】下列有关认识正确的是()A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n—1 D.各能层含有的电子数为2n2【例3】以下电子排布式表示基态原子电子排布的是()A.1s22s22p63s13p3 B.1s22s22p63s23p63d104s1 4p1C.1s22s22p63s23p63d24s1 D.1s22s22p63s23p63d104s2 4p1【例4】人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。
以下有关主族元素原子的“未成对电子”的说法,错误的是()A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子”D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”【例5】以下是表示铁原子和铁离子的3种不同化学用语。
⑴铁原子最外层电子数为,铁在发生化学反应时,参加反应的电子可能是。
⑵请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。
【巩固练习】结构示意图电子排布式电子排布图(轨道表示式)铁原子1s22s22p63s23p63d64s2铁离子1s22s22p63s23p63d51.氢原子的3d和4s能级的能量高低是()A. 3d>4sB. 3d<4sC. 3d=4sD. 无3d、4s轨道,无所谓能量高低2.在下面的电子结构中,第一电离能最小的原子可能是()A. ns2np3B. ns2np5C. ns1D. ns2np63.表示一个原子在第三电子层上有10个电子可以写成()A. 310B. 3d10C. 3s23p63d2D. 3s23p64s24.下列关于价电子构型为3s23p4的粒子描述正确的是()A.它的元素符号为OB.它的核外电子排布式为1s22s22p63s23p4C.它可与H2生成液态化合物D.其电子排布图为:1s 2s 2p 3s 3p5.下列各组指定的元素,不能形成AB2型化合物的是()A.2s22p2和2s22p4B. 3s23p4和2s22p4C.3s2和2s22p5D. 3s1和3s23p57.下面是四种元素原子基态的电子排布式,其中化合价最高的是A.1s22s22p3 B.1s22s22p63s23p63d34s2 C.1s22s22p63s23p6 D.1s22s22p58.下列原子或离子的基态电子排布式正确的是()A.Ni2+:[Ar] 3d8 B. Cu:[Ar] 3d94s2 C.S2- :[Ne] 2s23p6 D.Si: [Ar] 3s23p29.下列微粒的基态电子排布式一定错误的是()A.A原子:1s22s22p63s23d103p6 B.B2-离子:1s22s22p6C.C2+离子:1s22s22p6 D.原子:1s22s22p610.具有下列最外层电子排布的基态原子,其相应的元素,一定属于主族的是()A.ns1 B.ns2 C.ns2np6 D.ns2np211.A元素的原子基态外围电子排布是ns2np5,B元素基态原子外围电子排布是ms2mp2,它们形成的化合物的化学式为()A.A4B7B.BA4 C.AB4 D.A7B412.硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。
实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:(1)写出Fe、Fe2+、Fe3+的核外电子排布式。
(2)用轨道表示式表示Fe3+的3d电子的排布情况。
(3) Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,ClO-的电子式是,Fe(OH)3与NaClO 反应的化学方程式是。
(4)硫酸亚铁制备中实验步骤①的目的是。
(5)实验步骤②明显不合理,理由是。
(6)实验步骤④中用少量冰水洗涤晶体,其目的是。
【高考题解】1.(09上海)2.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )A .B .C .D .2. (2007年高考江苏卷)下列叙述正确的是 ( )A.2CH 2CH 2nB.石英的化学式为:CaSiO 3C.在CS 2、PCl 3电子的稳定结构D.Ar 原子的结构示意图为3.(2007年高考海南) 、B 、C 、D 、E 代表5种元素。
请填空:(1)A 2个电子,其元素符号为__________;(2)B B 的元素符号为____ __,C 的元素符号为____ __;(3)D 元素的正三价离子的3d 亚层为半充满,D 的元素符号为_____,其基态原子的电子排布式为______。
(4)E 元素基态原子的M 层全充满,N 层没有成对电子,只有一个未成对电子,E 的元素符号为________,其基态原子的电子排布式为_______________________。
4.(2007年高考上海)现有部分短周期元素的性质或原子结构如下表: (1)元素T 的原子最外层共有 种不同运动状态的电子。
元素X 的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y 与氢元素形成一种离子YH 4+ ,写出该微粒的电子式 (用元素符号表示)(3)元素Z 与元素T 相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a .常温下Z 的单质和T 的单质状态不同b .Z 的氢化物比T 的氢化物稳定c .一定条件下Z 和T 的单质都能与氢氧化钠溶液反应(4)探寻物质的性质差异性是学习的重要方法之一。
T 、X 、Y 、Z 四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 _ ____________ 。
5.(2007山东卷)请完成下列各题:(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN 、GaP 、GaAs 等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。
Ga原子的电子排布式为 。
在GaN 晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。
在四大晶体类型中,GaN 属于 晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
元素编号 元素性质或原子结构 T M 层上有2对成对电子 X 最外层电子数是次外层电子数的2倍 Y 常温下单质为双原子分子,其氢化物水溶液呈碱性 Z 元素最高正价是+7价 +20 2 8 8。