氢气理化性质
- 格式:docx
- 大小:16.49 KB
- 文档页数:2

告知牌我公司生产氢气,现将氢气理化性质、安全措施、应急处置知识告知如下:1、特别警示:氢气属及易燃气体2、理化性质无色、无味的气体,很难液化。
液体氢无色透明。
极易扩散和渗透。
微溶于水,不溶于乙醇、乙醚。
分子量2,熔点-259.2℃,沸点-252.8℃,密度0.0899g/l,临界压力1.30MPa,临界温度-240℃,爆炸极限4%----75%(空气),自燃温度500℃。
主要用途:用于生产合成氨和甲醇,石油精制,有机氢化物及制作火箭燃料。
3、危害信息燃烧和爆炸危险性极易燃,与空气混合能形成爆炸性混合物,遇热或明火即发生爆炸。
比空气轻,在室内使用和存储时,漏气上升滞留屋顶不易排出,遇火星回引起爆炸。
在空气中燃烧时,火焰呈蓝色,不易被发现。
活性反应:与氟、氯、溴等卤素会剧烈反应。
危害健康:为单纯性窒息气体,仅在高浓度时,由于空气中氧分压降低才引起缺氧性窒息。
在很高的分压下,呈现麻醉作用。
4、安全措施一般要求:操作人员必须经过专门培训,严格遵守操作规程,熟练掌握操作技能,具备应急处置知识。
密闭操作,严防泄漏,工作场所加强通风。
远离火种、热源,工作场所严禁吸烟。
生产使用氢气的车间及储氢场所应设有氢气泄漏报警仪,使用防爆型的通风设施。
操作人员穿防静电服。
储纯压力容器和设备应设有安全阀、压力表、温度计,并应装有带压力、温度远传记录和报警功能的安全装置。
避免与氧化剂、卤素接触。
生产、储纯区域应设置安全警示标志。
在传送过程中,钢瓶和容器必须接地和跨接,防止产生静电。
搬运时轻装轻卸,防止钢瓶及附件破损。
配备相应品种和数量的消防器材及泄漏应急处理设备。
特殊要求:a、操作安全1、氢气系统运行时,不准敲击,不准带压修理和紧固,不得超压,严禁负压。
制氢和充装人员工作时,不得穿戴易产生静电的服装及带钉的鞋作业,以免产生静电和撞击起火。
2、当氢气作焊接、切割、燃料和保护气等使用时,每台用氢设备的支管上应设阻火器。
因生产需要,必须在现场(室内)使用氢气瓶时,其数量不得超过5瓶,并且氢气瓶与盛有易燃、易爆、可燃物质及氧化性气体的容器或气瓶的间距不应小于8米,与空调装置、空气压缩机和通风设备等吸风口的间距不应小于20米。
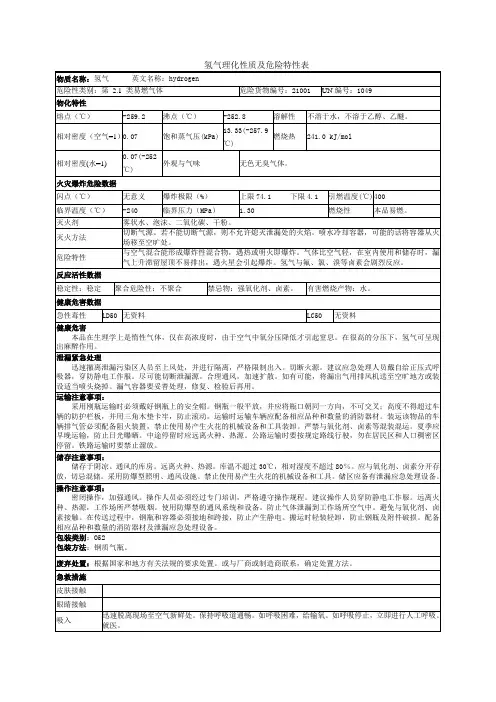


氢气的理化性质及危险特性(表-)
氢气是一种无色、无味、可燃的气体。
它具有以下的理化性质
和危险特性:
- 化学性质:化学性质:
- 氢气能与氧气发生剧烈的反应,生成水,并释放大量的热能。
这种反应称为燃烧反应,也是氢气被广泛用作燃料的原因之一。
- 氢气还可以与许多其他元素和化合物发生化学反应,形成不
同的化合物。
例如,它可以与氟反应生成氢氟酸,与氯反应生成氢
氯酸等。
- 物理性质:物理性质:
- 氢气是轻于空气的气体,密度比空气小。
它具有很高的热导
率和电导率。
- 在常温下,氢气是气态的,但可以通过降低温度和增加压力
来将其液化或固化。
- 危险特性:危险特性:
- 氢气具有高度可燃性,能够与氧气或其他氧化剂发生剧烈反应。
在空气中,氢气能够形成易燃的混合物,并且只需要有明火或
电火花的存在,就能引发爆炸。
- 氢气对于火源、高温和明火非常敏感,在接触火源或高温物
体时,容易发生燃烧或爆炸事故。
- 氢气在储存和运输过程中需要特殊的安全措施,如防爆设备、气体泄漏检测和适当的通风系统,以减少事故的发生。
综上所述,了解氢气的理化性质和危险特性对于安全操作和应
用非常重要。
在使用氢气时,需要严格遵循相关的安全规程和操作
指南,以确保人员和环境的安全。


公考氢气知识点总结一、氢气概述氢气是化学元素中的一种,原子序数为1,原子量为1.008。
在化学周期表中,氢气位于第一主族元素,化学符号为H。
氢气是宇宙中最丰富的元素之一,但在地球上以自由状态非常罕见。
通常情况下,氢气以分子的形式存在,即H2。
氢气在工业、能源、核能、航空航天等领域都有应用,因其环境友好和高能量特性而备受关注。
二、氢气的性质1. 物理性质氢气是一种无色、无味、无臭的气体,密度比空气小,易于燃烧。
液态氢气是一种极低温液体,沸点为-252.87°C,是温度最低的液体之一。
2. 化学性质氢气有较高的活性,可以与氧气、氯气等元素发生化学反应。
在空气中,氢气易与氧气发生爆炸性反应,释放大量热能。
此外,氢气还可与一些金属发生反应,生成金属氢化物。
三、氢气的制备1. 实验室制备在实验室中,氢气一般采用锌和盐酸反应制备。
反应方程式为:Zn + 2HCl → ZnCl2 + H2↑2. 工业制备工业上氢气的制备主要采用天然气蒸汽重整反应、气化反应、电解水等方法。
其中,天然气蒸汽重整反应是制备氢气的主要方法之一,过程中甲烷与水蒸汽反应生成氢气和一氧化碳。
四、氢气的应用1. 能源领域氢气作为清洁能源的应用不断扩大。
其燃烧产生的唯一副产品是水,不会造成环境污染,因此被认为是未来替代传统石油能源的重要候选者。
2. 工业领域氢气可用作还原剂、氢化剂、氢化制氨、硬化油脂等多种工业反应的原料。
3. 航空航天领域氢气被广泛用于火箭推进器,因其高能量、低密度、燃烧后不产生固体或液体副产品的特点,逐渐成为航天领域不可或缺的推动力。
五、氢气的安全性氢气在一定条件下具有较高的爆炸性,因此在储存、运输、使用过程中需严格控制其浓度。
同时,在化工生产、实验室使用氢气时,应严格遵守安全操作规程,做好安全防护工作。
六、氢气的环保性相对于传统的石油能源,氢气燃烧只产生水,不会产生二氧化碳、二氧化硫、氮氧化物等污染物,对环境友好。

氢气变成水的化学方程式两个-概述说明以及解释1.引言1.1 概述氢气变成水的化学方程式是一种常见的化学反应,也是我们日常生活中常见的现象之一。
这个化学反应发生在氢气与氧气之间,当它们在适当的条件下相遇时,就会发生化学反应并生成水。
氢气是一种无色、无臭的气体,化学式为H2。
氧气则是一种无色、无味、无臭的气体,化学式为O2。
这两种气体在自然界中广泛存在,并且在大气中的含量也相当丰富。
当氢气与氧气以适当的比例混合时,它们可以通过点燃来引发化学反应。
在这个反应中,氢气的两个氢原子与氧气的两个氧原子结合形成了水分子。
水分子的化学式为H2O。
化学方程式可以用来描述这个反应的化学过程。
通常,我们可以用以下化学方程式表示氢气变成水:2H2 + O2 -> 2H2O在这个化学方程式中,反应物是氢气和氧气,产物则是水。
化学方程式的左侧是反应物,右侧是产物,箭头表示反应的方向。
这个化学方程式告诉我们,当两个氢气分子和一个氧气分子发生反应时,它们会生成两个水分子。
这个反应是一个放热反应,释放出大量的能量。
氢气变成水的化学方程式在许多领域都有重要的应用,包括能源产生、环境保护和化学工业等。
利用氢气与氧气生成水的反应,我们可以通过燃烧来产生能量,从而驱动发动机或发电机。
除了能源产生,氢气变成水的化学方程式还可以被应用于其他领域的研究和开发。
例如,通过研究氢气与氧气的反应机理,我们可以探索更高效、更环保的能源转化和存储方法。
综上所述,氢气变成水的化学方程式是一种重要的化学反应,它可以在适当的条件下发生,并且在能源产生和其他领域具有广泛的应用前景。
对于未来的研究和开发来说,进一步探索和理解这个化学反应的机制是非常有意义的。
文章结构部分的内容可以根据需要进行展开,以下是一个示例:1.2 文章结构本文将按照以下结构展开对氢气变成水的化学方程式的探讨:2. 正文部分2.1 氢气的性质在这一部分,我们将介绍氢气的物理和化学性质,包括其化学式、分子结构、燃烧性质等。


氢气的理化性质及危险特性表-氢气的理化性质及危险特性化学名称:氢[压缩的];氢气化学式:H2外观和性质:氢气是一种无色无味的气体,不溶于水、乙醇和乙醚。
它的相对密度为0.07(水=1),比空气轻。
它的熔点为-259.2℃,沸点为-252.8℃,饱和蒸气压为74.1 kPa。
健康危害:在正常情况下,氢气是一种惰性气体,对人体没有毒性。
但是在高浓度下,由于空气中氧分压降低,会引起窒息。
在很高的分压下,氢气可呈现出麻醉作用。
急救方法:如果吸入氢气导致呼吸困难,应立即脱离现场到空气新鲜处,并保持呼吸道通畅。
如果呼吸停止,应立即进行人工呼吸,然后就医。
燃烧性:氢气易燃,闪点为<-50℃,引燃温度为400℃。
它能与空气混合形成爆炸性混合物,遇热或明火即会发生爆炸。
在室内使用和储存时,漏气上升滞留屋顶不易排出,遇火星会引起爆炸。
危险特性:氢气与氟、氯、溴等卤素会剧烈反应,属于强氧化剂、卤素。
建议与氧气、压缩空气、卤素(氟、氯、溴)、氧化剂等分开存放,切忌混储混运。
搬运时应轻装轻卸,防止钢瓶及附件破损。
运输时应配备相应品种和数量的消防器材。
装运该物品的车辆排气管必须配备阻火装置,禁止使用易产生火花的机械设备和工具装卸。
严禁与氧化剂、卤素等混装混运。
储运条件和泄漏处理:氢气应储存在阴凉、通风仓间内,远离火种、热源,防止阳光直射。
中途停留时应远离火源、热源。
泄漏处理时应迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。
切断火源。
建议应急处理人员戴自给正压式呼吸器,穿消防防护服。
尽可能切断泄漏源。
合理通风。
泡沫、二氧化碳等。
在灭火过程中,要注意避免受损,导致漏气加剧。
同时,要及时通知有关部门处理漏气。
在处理气体泄漏时,加速扩散是一个非常重要的步骤。
可以通过排风机将漏出气体送至空旷地方或者使用适当的喷头将其烧掉。
漏气也需要进行妥善处理,修复和检验后才能再次使用。
如果无法立即切断气源,那么不能熄灭正在燃烧的气体。
氢气的理化性质及危险特性理化性质- 化学符号: H化学符号: H- 原子序数: 1原子序数: 1- 原子量: 1. g/mol原子量: 1.00784 g/mol- 元素族: 1A元素族: 1A- 主族: 1主族: 1- 周期: 1周期: 1- 电子排布: 1s1电子排布: 1s1- 气态: 氢气在常温常压下为无色、无味、无毒的气体。
气态: 氢气在常温常压下为无色、无味、无毒的气体。
- 熔点: -259.2°C熔点: -259.2°C- 沸点: -252.9°C沸点: -252.9°C- 密度: 0. g/L(0°C,1 atm)密度: 0.08988 g/L(0°C,1 atm)- 溶解性: 在水中存在着一定程度上的溶解度。
溶解性: 在水中存在着一定程度上的溶解度。
- 燃烧性: 氢气是一种高度易燃的气体,在遇到火源时能够发生剧烈燃烧并产生水。
燃烧性: 氢气是一种高度易燃的气体,在遇到火源时能够发生剧烈燃烧并产生水。
危险特性尽管氢气是无毒且无害的,但其具有以下危险特性:- 易燃性: 氢气是高度易燃的气体,与空气中的氧气或其他氧化剂产生反应时能够迅速燃烧。
这意味着氢气在存在火源时极易导致火灾或爆炸。
易燃性: 氢气是高度易燃的气体,与空气中的氧气或其他氧化剂产生反应时能够迅速燃烧。
这意味着氢气在存在火源时极易导致火灾或爆炸。
- 可燃气体的扩散性: 氢气具有极佳的扩散性,且与其他气体混合后能快速扩散。
这使得在泄露或事故情况下,氢气能够迅速扩散到较远的地方,增加事故范围和危害。
可燃气体的扩散性: 氢气具有极佳的扩散性,且与其他气体混合后能快速扩散。
这使得在泄露或事故情况下,氢气能够迅速扩散到较远的地方,增加事故范围和危害。
- 氧气的贫化: 当氢气燃烧时,会消耗周围的氧气,导致空气中氧气含量减少,从而造成窒息危险。
氧气的贫化: 当氢气燃烧时,会消耗周围的氧气,导致空气中氧气含量减少,从而造成窒息危险。
【化学知识点】氢气的物理性质和化学性质
氢气的物理性质:在通常情况下,氢气是无色、无味的气体;密度是最小的气体;难溶于水等。
氢气的化学性质:1.可燃性(用途:高能燃料、氢氧焰焊接、切割金属);2.还原性(冶炼金属)。
常温常压下,氢气是一种极易燃烧,无色透明、无臭无味且难溶于水的气体。
氢气是世界上已知的密度最小的气体,氢气的密度只有空气的1/14,即氢气在1标准大气压和0℃,氢气的密度为0.089g/L。
所以氢气可作为飞艇、氢气球的填充气体(由于氢气具有可燃性,安全性不高,飞艇现多用氦气填充)。
氢气是相对分子质量最小的物质,主要用作还原剂。
氢气 (H2) 最早于16世纪初被人工制备,当时使用的方法是将金属置于强酸中。
1766–1781年,亨利·卡文迪许发现氢元素,氢气燃烧生成水(2H₂+O₂点燃=2H₂O),拉瓦锡根据这一性质将该元素命名为“hydrogenium”(“生成水的物质”之意,“hydro”是“水”,“gen”是“生成”,“ium”是元素通用后缀)。
19 世纪50 年代英国医生合信编写《博物新编》(1855 年)时,把“hydrogen”翻译为“轻气”,意为最轻气体。
工业上一般从天然气或水煤气制氢气,而不采用高耗能的电解水的方法。
制得的氢气大量用于石化行业的裂化反应和生产氨气。
氢气分子可以进入许多金属的晶格中,造成“氢脆”现象,使得氢气的存储罐和管道需要使用特殊材料(如蒙耐尔合金),设计也更加复杂。
感谢您的阅读,祝您生活愉快。
在工业上,氢气被广泛应用于氢能源领域,比如用作燃料电池的燃料,或者用来制备氨、甲醇等化工产品。
由于氢气的高能量密度和清洁燃烧特性,使得它成为了一种备受关注的替代能源。
在本文中,我们将对氢气的知识点进行详细的总结,并深入探讨其在科学研究和应用领域中的重要性。
氢气的物理性质1. 密度:氢气是一种非常轻的气体,它的密度比空气小得多,因此在大气中会上升。
这也使得氢气在一些应用中具有一些独特的性质,比如可以用来充填气球。
2. 气味:氢气是一种无色、无味的气体,在常温下是气态存在。
因此,很难通过外观或气味来识别氢气的存在。
3. 燃烧性:氢气是一种非常容易燃烧的气体,在空气中可以燃烧产生水和热。
这使得氢气成为了一种理想的燃料选择,尤其是在环保和能源利用效率上具有优势。
氢气的化学性质1. 反应性:氢气是一种非常活泼的元素,它可以和氧气发生剧烈的反应,产生水和释放大量的能量。
此外,氢气还可以和其他元素形成化合物,在化工生产和实验室研究中有广泛的应用。
2. 溶解性:氢气在水中有一定的溶解度,不过比空气要大得多。
这也是导致水中的氢离子浓度增加的原因之一。
3. 电化学性质:氢气在电化学反应中有重要的应用,比如用来制备氢气燃料电池等。
由于氢气的高能量密度和清洁燃烧特性,使得其在能源领域具有很大的潜力。
氢气的制备与提纯1. 电解法:通过电解水可以制备氢气和氧气,这是一种常见的实验室制备氢气的方法。
在实际生产中,也可以利用这种原理来制备大量的氢气。
2. 重水法:通过对重水(即氘化氢)的反应,也可以制备出纯度较高的氢气。
重水中的氘原子在反应中会与氧原子结合,形成氢的同位素氚(tritium)。
这种方法在核燃料生产和科学研究中有重要应用。
3. 沸腾水法:将锌和稀盐酸置于形状适宜的容器中,通入稀盐酸和锌粉的氢气可在装上集氢气的瓶内,用排水管引出小试管中的饱和氯化钠溶液和双氧水溶液,使氢气井通进过氯化钠溶液中,再流进双氧水溶液中。
1. 氢气燃料电池:氢气燃料电池是一种使用氢气作为燃料,通过化学反应产生电能的设备。