看谱半定量分析
- 格式:ppt
- 大小:338.50 KB
- 文档页数:15



光谱半定量分析原理、方法、操作技术知识要点一、光谱半定量分析原理光谱半定量分析是根据元素的特征谱线确定被测元素的存在,然后根据谱线的黑度估计其含量的光谱分析。
与目视比色法相似,测量试样中元素的大致浓度范围。
光谱半定量分析法应用:用于钢材、合金等的分类、矿石品位分级等大批量试样的快速测定。
二、光谱半定量分析方法光谱半定量分析的方法有三种:谱线呈现法;谱线强度比较法;均称线对法等。
其中谱线强度法最常用。
谱线呈现法:试样中某元素含量低时,摄谱后在感光板上仅出现少数几根灵敏线,随着试样中该元素含量的增加,一些次灵敏线与原本较弱的谱线相继出现,于是可以编成一张谱线出现于含量的关系表,根据某一谱线是否出现来估计试样中该元素的大致含量。
谱线强度比较法:测定一系列不同含量的待测元素标准光谱系列,在完全相同条件下(同时摄谱),测定试样中待测元素光谱,选择灵敏线,比较标准谱图与试样谱图中灵敏线的黑度,确定含量范围。
三、光谱半定量分析操作技术(一)、仪器与试剂1.摄谱仪:WSP-1型平面光栅摄谱仪2.电极:下电极¢3.5×6×0. 5 mm碳电极;上电极:圆锥形碳电极,端面直径2 mm3.相板:天津紫外Ⅱ型光谱相板4.投影仪:8W型光谱投影仪5.显影液:取水(35~45℃)700mL、无水亚硫酸钠26.0g、无水碳酸钠20.0g、米吐尔1.0g、对苯二酚5.0g、溴化钾1.0g,加水至1000mL溶解,摇匀备用。
6.停影液:冰醋酸(98%)15mL加水至1000mL,摇匀备用。
7.定影液:取水(35~45℃)650mL、无水亚硫酸钠15.0g、硼酸7.5g、海波240.0g、冰醋酸(98%)15mL、钾明矾15.0g,加水至1000mL溶解,摇匀备用。
(二)、操作步骤1.摄谱前的准备工作(1)准备电极:在光谱分析实验时一般用纯的碳棒作为辅助电极。
(2)将粉状样品用小勺加入电极的样品孔中,或直接将电极压在试样中,填满碳电极小孔。
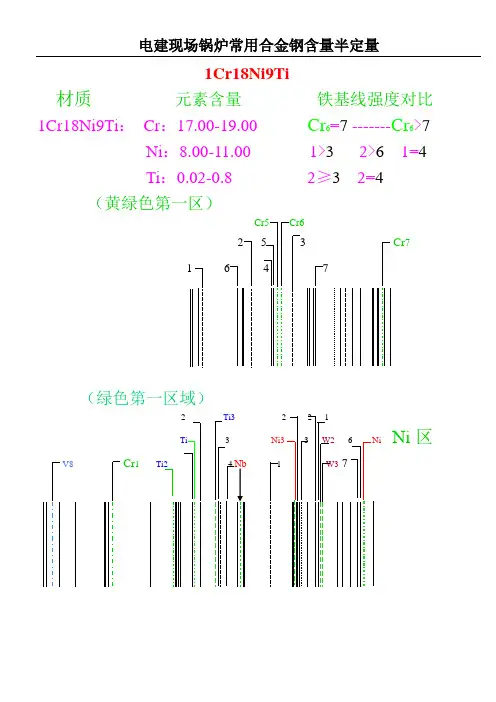
1Cr18Ni9Ti材质元素含量铁基线强度对比1Cr18Ni9Ti:Cr:17.00-19.00 Cr6=7 -------Cr6>7Ni:8.00-11.00 1>32>61=4Ti:0.02-0.8 2≥32=4(黄绿色第一区)Cr5 Cr62 53 Cr71647(绿色第一区域)2 Ti3 2 2 1Ti3Ni33W26Ni Ni区V8Cr1Ti2 4 1W3712CrIMoV材质元素含量铁基线强度对比12Cr1MoV:Cr:0.90-1.20 Cr5<4并Cr6>3┄┄Cr5≤4或Cr5≥4Mo:0.25-0.35 1≥3 1>3 1<4V: 0.15-0.30 1≤1(黄绿色第一区)(黄绿色第二区)Cr 5 Cr 6Mo353Mo44 7 45 32 Cr7 2 1 71 6 3 Sn(紫色区域V1组)(橙色区域Mn2组)Cr4V1V2 323V3Mn10Mn111V4Mn9 4 Mo2V5V621V11V710CrMo910材质元素含量铁基线强度对比10CrMo910:Cr:2.00-2.50 1≥52≤4Mo:0.90-1.20 1=62<5(黄绿色第一区)(黄绿色第二区)Cr 5 Cr6Mo35 3 Mo44 7 45 32 Cr7 2 1 71 6 3 6 Sn15NiCuMoNb5材质元素含量铁基线强度对比WB36 Ni:1.00-1.30 1≤31隐约出现15NiCuMoNb5Nb:0.015-0.045 1隐约出现2刚出现(蓝色第二区域)Mn82低Ni1Mn1Mn4Mn5Mn7 4 Nb1Nb23 5 Mn2Mn3Mn621 32 1 34图谱中合金元素序号(如:Cr1、Cr5、Cr6)是根据中国电力工业理化检验人员资格考核委员会出版的《光谱分析标准谱图与标志卡》标注为准。

光谱半定量分析光谱半定量分析00在实际工作中,有时只需要知道试样中元素的大致含量,不需要知道其准确含量。
例如钢材与合金的分类、矿产品位的大致估计等等,另外,有时在进行光谱定性分析时,需要同时给出元素的大致含量,在这些情况下,可以采用光谱半定量分析。
所以光谱半定量分析的任务就是给出试样中某元素的大致含量。
光谱半定量分析的方法有三种:谱线呈现法;谱线强度比较法谱;均称线对法等。
其中线强度比较法最为常用。
1.谱线呈现法谱线强度与元素的含量有关。
当元素含量的降低时,其谱线强度逐渐减弱,强度较弱的谱线渐次消失,即光谱线的数目逐渐减少。
因此,可以根据谱现出现的条数及其明亮的程度判断该元素的大致含量。
例如:Pb含量(%)谱线λ(nm)0.001 283.3069清晰可见,261.4178和280.200很弱0.003 283.306、261.4178增强,280.200清晰0.01 上述谱线增强,另增266.317和278.332,但不太明显。
0.1 上述谱线增强,无新谱线出现1.0 上述谱线增强,214.095、244.383、244.62出现,241.77模糊3 上述谱线增强,出现322.05、233.242模糊可见10 上述谱线增强,242.664和239.960模糊可见30 上述谱线增强,311.890和269.750c出现2.谱线强度比较法光谱半定量分析常采用摄谱法中比较黑度法,这个方法须配制一个基体与试样组成近似的被测元素的标准系列(如,1%,0.1%,0.01%,0.001%)。
在相同条件下,在同一块感光板上标准系列与试样并列摄谱,然后在映谱仪上用目视法直接比较试样与标准系列中被测元素分析线的黑度。
黑度若相同,则可做出试样中被测元素的含量与标准样品中某一个被测元素含量近似相等的判断。
例如,分析矿石中的铅,即找出试样中灵敏线283.3 nm,再以标准系列中的铅283.3nm线相比较,如果试样中的铅线的黑度介于0.01% ~ 0.001%之间,并接近于0.01%,则可表示为0.01% ~ 0.001%。


化学表征半定量方法
化学表征里的半定量方法呀,可有趣啦。
半定量方法呢,就像是在化学世界里做一个大概的“数数”。
比如说,我们想知道一个混合物里各种成分大概占多少,又不需要特别精确的数字的时候,半定量方法就闪亮登场啦。
有一种比较常见的半定量方法是光谱分析。
就像看彩虹一样,不同的物质在光谱里有不同的表现。
通过观察光谱里各种特征峰的强弱,我们就能估摸出成分的相对含量。
这就好比你看一群人穿不同颜色的衣服,通过大概看看哪种颜色占的面积大,就知道这种颜色对应的人大概有多少啦。
比如说在红外光谱里,某个峰很强,那就说明对应的官能团或者物质在这个混合物里可能含量比较多呢。
还有比色法也能做半定量。
想象一下,我们把要检测的东西和一些试剂混合,然后溶液就会变色。
颜色的深浅和物质的含量是有关系的。
就像我们冲果汁,放的果汁粉越多,颜色就越浓。
在化学里,我们可以根据颜色的深浅,对照一个标准比色卡,然后大概判断出物质的含量范围。
这就像是猜谜语一样,根据颜色这个小线索来推测物质含量这个谜底。
另外呢,X射线荧光光谱法也能半定量。
它能检测出元素的种类和大概的含量。
就像是一个超级侦探,能发现隐藏在物质里的元素小坏蛋,还能知道它们大概有多少。
不过这个方法给出的也是一个大概的数值,不是精确到小数点后好几位的那种。


原子发射光谱(Atomic Emission Spectrometry,AES)是一种利用物质在热激发或电激发下,每种元素的原子或离子发射特征光谱来判断物质的组成,进行元素的定性与定量分析的方法。
原子发射光谱法具有多元素检测、分析速度快、选择性好、检测限低、准确度高、误差较小、试样消耗少、线性范围大等优点。
然而,它也存在一些局限性,如不能非金属、光谱复杂、价格昂贵等。
在原子发射光谱法中,定量和半定量的分析主要依据以下原理:
1. 定量分析:通过测量待测物质中各元素的发射光谱强度,与标准光谱强度进行比较,从而计算出待测物质中各元素的含量。
常用的定量分析方法有:标准曲线法、标准加入法、内标法等。
2. 半定量分析:通过比较待测物质中某元素的发射光谱与已知浓度的标准物质光谱,对待测物质中该元素的含量进行大致估算。
半定量分析常用的方法有:目视法、比较法等。
在实际应用中,原子发射光谱法可对约70 种元素(包括金属元素及磷、硅、砷、碳、硼等非金属元素)进行分析。
在一般情况下,用于1% 以下含量的组份测定,检出限可达ppm,精密度为10% 左右,线性范围约2 个数量级。
这种方法可有效地用于测量高、中、低含量的元素。


第十一章原子光谱分析法第一节原子发射光谱法一、分析过程获得样品的原子发射光谱最简便、常用的方法如图11-1所示.将被测样品置于B处,用适当的激发光源激发,样品中的原子就会辐射出特征光,经外光路照明系统L聚焦在入射狭缝S上,再经准直系统O1使之成为平行光,经色散元件P把光源发出的复合光按波长顺序色散成光谱,暗箱物镜系统O2把色散后的各光谱线聚焦在感光板F上,最后把感光板进行暗室处理就得到了样品的特征发射光谱.每一种元素的原子及离子激发以后,都能辐射出一组表征该元素的特征光谱线.其中有一条或数条辐射的强度最强,最容易被检出,所以也常称做最灵敏线(参见第二章第二节).如果样品中有某些元素存在,那么只要在合适的激发条件下,样品就会辐射出这些元素的特征谱线,在感光板的相应位置上就会出现这些谱线.一般根据元素灵敏线的出现与否就可以确定样品中是否有这些元素存在.这就是光谱定性分析的基本原理.光谱线的强度,反映在感光板上就是谱线的黑度.在一定的条件下,元素的特征谱线的强度或黑度随着元素在样品中的含量或浓度的增大而增强.利用这一性质来测定元素的含量便是光谱半定量分析及定量分析的依据.如果用光电接收装置来代替感光板接收、测量和记录谱线的强度,这种仪器便称为光电光谱仪.目前电子计算机技术已应用到发射光谱分析上.利用一台光电光谱仪可以用多个光电接收装置同时接收一个样品中多种元素的特征光谱线,经过电子计算机处理,可以给出多种元素的谱线强度的信号以及被测元素的含量或浓度.现代光电光谱仪把激发、测量、计算、记录等几个环节连结在一起,分析速度极快.二、谱线强度1.玻尔兹曼分布定律谱线的产生是由于电子从高能级向低能级跃迁的结果,即原子或离子由激发态跃迁到基态或低能态时产生的.在热力学平衡条件下,某元素的原子或离子的激发情况,即分配在各激发态和基态的原子浓度遵守统计热力学中的麦克斯韦-玻尔兹曼(Maxwell-Boltzman)分布定律.玻尔兹曼分布定律表明,处于不同激发态的原子数目的多少,主要与温度和激发能量有关温度越高越容易把原子或离子激发到高能级,处于激发态的数目就越多;而在同一温度下,激发电位越高的元素,激发到高能级的原子或离子数越少;就是对同一种元素而言,激发到不同的高能级所需要的能量也是不同的,能级越高所需能量越大,原子所在的能级越高,其数目就越少.2.谱线强度由于电子处于高能级的原子是不稳定的,它很快要返回到低能级而发射出特征光谱.但由于激发时可以激发到不同的高能级,又可能以不同的方式回到不同的低能级,因而可以发射出许多条不同波长的谱线.图11-2只用几个能级表示了电子在各能级之间跃迁的示意图.电子在不同能级之间的跃迁,只要符合光谱选律就可能发生.而这种跃迁发生可能性的大小称为跃迁几率.设电子在某两个能级之间的跃迁几率为A,这两个能级的能量分别为Ei和E0,发射的谱线频率为v,则一个电子在这两个能级之间跃迁时所放出的能量即这两个能级之间的能量差△E=Ei—E0=hv.因在热力学平衡条件下,共有Ni个原子处在第i激发态,故产生的谱线q强度I为3.影响谱线强度的主要因素由式(11-4)可知,影响谱线强度的主要因素有:(1)激发电位? 由于谱线强度与激发电位成负指数关系,所以激发电位越高,谱线强度就越小.这是因为随着激发电位的增高,处于该激发态的原子数就迅速减少的缘故.因为每一种元素都有不同的激发电位,就是同一种元素产生不同波长辐射时也有不同的激发电位,所以其谱线强度都是不同的.由于激发到第一激发态时的激发电位是该元素中所有激发电位中最小的,所以主共振线通常是该元素所有谱线中最强的谱线.实践证明:激发电位较低的谱线都比较强,而激发电位高的谱线都比较弱,甚至由于激发电位太高,用一般激发光源无法使之激发,而使该谱线不能产生.(2)跃迁几率跃迁几率是指电子在某两个能级之间每秒跃迁的可能性的大小.可以通过实验数据计算出来.对于遵守光谱选律的那些跃迁,一般跃迁几率在106~109s-1之间.跃迁几率是与激发态寿命成反比的,即原子处于激发态的时间越长,跃迁几率就越小,产生的谱线强度就弱.例如产生NaI 330.232 nm谱线的跃迁几率比产生NaI 588.996nm谱线的跃迁几率小约22倍,因而谱线强度也相应弱得多.(3)统计权重谱线强度与激发态和基态的统计权重之比gi/g0名。
光谱半定量分析:是利用火焰发射光谱分析的原理判定元素的存在与否,然后根据其谱线黑度大致判定该元素或化合物的质量分数的检测方法。
该检测样品元素质量分数如下:
样品中检测结果排列质量分数前15位的元素(化合物)所占比例如图:
质量分数前15位的矿物(化合物)有粘土混合物(TFe2O3、Na2O 、CaO、Al2O3、MgO、K2O)、金属元素锰Mn 、钨W、钛Ti 、锂Li 、钇Y 、稀土元素(铪Hf、钪Sc、铈Ce、铯Sr )。
以上元素均以各种矿物化合物和氧化物组合的形式赋存于自然界中。
由于光全分析未出示金属元素金(Au)的质量百分比,但在样品中肉眼可见金砂颗粒分布。
此次光全分析只能作为检测元素大致的质量分数,并不能根据数据说明该地区元素化合物(矿物)的含量以及品位。
就目前贵金属和矿石开发市场而言,以上检测出的元素如果经过有效的系统的地质勘查研究以及后期的合理开发,确定
其具备形成工业开发价值的矿产,那么带来的经济效益也是很可观的。
分析可通过浮选法就能选出的矿,按标准品位计算每吨矿的综合价值。
自然科学实验中的半定量与定性分析技巧与方法自然科学实验是科学研究的重要手段之一,通过实验可以验证理论、探索未知、解决问题。
在实验过程中,对实验结果进行分析是不可或缺的一步。
而在分析实验结果时,半定量和定性分析技巧与方法的应用显得尤为重要。
半定量分析是指通过对实验结果进行定量测量,但结果的精确性和准确性有一定的限制。
在自然科学实验中,半定量分析技巧与方法的应用广泛而重要。
例如,在化学实验中,我们常常使用滴定法来确定溶液中某种物质的浓度。
滴定法通过向待测溶液中加入一种已知浓度的试剂,通过观察试剂的滴定终点来确定待测溶液中物质的浓度。
这种方法虽然不具备绝对的精确性,但在实际应用中具有较高的可靠性。
另一个常用的半定量分析技巧是光谱分析。
光谱分析通过测量物质对光的吸收、发射或散射来确定物质的特性。
例如,在生物学实验中,我们可以使用紫外-可见光谱来确定溶液中某种物质的浓度。
通过测量溶液对特定波长光的吸收强度,可以根据光谱分析的原理计算出物质的浓度。
这种方法在生化实验中广泛应用,具有较高的准确性和可重复性。
与半定量分析相对应的是定性分析。
定性分析是指通过观察和判断来确定物质的性质、组成或存在与否,而不涉及具体的数值。
定性分析在自然科学实验中同样具有重要的地位。
例如,在地质学实验中,我们常常使用显微镜来观察和分析岩石的组成和结构。
通过观察岩石的颗粒大小、形状和颜色等特征,可以判断岩石的成因和演化历史。
这种定性分析方法在地质学研究中起到了至关重要的作用。
除了显微镜观察之外,还有其他定性分析技巧和方法。
例如,在生物学实验中,我们可以通过观察生物体的形态、结构和行为来判断其物种、生态习性和遗传特征。
这种观察和判断的过程并不涉及具体的数值,但对于生物学研究和分类具有重要的意义。
综上所述,半定量和定性分析技巧与方法在自然科学实验中具有重要的地位和作用。
半定量分析通过定量测量来获得实验结果,为科学研究提供了重要的数据支持;定性分析通过观察和判断来确定物质的性质和特征,为科学研究提供了重要的信息。