电解水的创新实验教程文件
- 格式:doc
- 大小:19.00 KB
- 文档页数:3

化学创新实验:
电解水H2检验的实验改进
一、实验名称:电解水H2检验的实验改进
二、实验目的:1、电解水,通过检验产物H2和O2来证明水由氢、
氧两种元素组成。
2、通过观察实验,确定水分子中氢氧元素的原子个
数比为2:1。
三、实验仪器及试剂:简易水电解器,水,稀硫酸。
四、实验仪器装置图及仪器的组装说明:
简易水电解器,实现水的电解没有任何问题,但到电解产物的检验时出现了问题。
主要是在检验H2时,打开左边的活塞,H2逸出时总是会携带水蒸气,所以点燃H2时总是会失败。
当时在乡下中学,也没有替代装置,多次失败后,我发现可以给左边的滴定管尖嘴部分戴个小纸帽子,从而提升上课效率。
五、实验操作部分:
取一张实验室常用直径为9cm的滤纸,对折两次,用剪刀剪下四分之一。
将该小扇形沿着顶点卷成一个圆锥体,顶点用剪刀从高于
滴定管尖嘴部分剪开一个小洞,保证气体能顺利逸出,且能完美地给滴定管戴上一顶合适的小纸帽子,这样打开活塞H2逸出时携带的水蒸气就会被滤纸吸收且向下方扩散,这时点燃气体就很容易了。
六、装置改进的意义:
为了实现实验目的,必须要证明水电解产物是H2和O2气,O2用带火星的木条,若复燃就可证明,而H2的证明则必须要利用其可燃性来证明,若电解产生的气体不燃烧,则整个实验可以说是失败的,所以通过改进,学生观察到了完美的实验现象,对知识的理解和掌握起到了关键性的作用,终于解决了困扰大家多年的问题。

科学实验:如何进行水的电解实验
引言
水的电解实验是一种常见且有趣的科学实验,通过这个实验我们可以观察到水分子被电解分解成氢气和氧气的现象。
本文将具体介绍如何进行水的电解实验并提供操作步骤。
实验材料
•9伏直流电源
•水槽或容器
•两根导线(最好为铜导线)
•粒状食盐(用来增加水中离子浓度)
实验步骤
1.准备一个干净、无菌的水槽或容器,并将其放在平稳的台面上。
2.将水槽或容器中注入适量清水,最好使用纯净水。
3.在两侧边缘固定两个导线,确保它们位于容器内并不相碰。
4.连接导线:一根连接正极(阳极)端口,另一根连接负极(阴极)端口。
此时需要注意确保连接正确,以避免短路和危险情况发生。
5.添加食盐:如果要加速电解作用效果,可以向水中添加适量粒状食盐,这
将增加水中离子的浓度。
6.打开电源:将电池连接到电源上,确保电解开始进行。
7.观察实验现象:在通电时,会发现气泡从阴极和阳极生成并升至液面。
阴
极产生氢气(H2),而阳极则产生氧气(O2)。
8.进行观察并记录:观察所生成的气泡的数量、大小和颜色等特征,并记下
你的观察结果。
结论
通过水的电解实验,我们看到了庞大的分子——水分子被魔力般地分解成两种不同分子:氧气和氢气。
这是一种有趣且引人注目的观察,同时也向我们展示了科学中电解作用的基本原理。
需要注意的是,在进行这个实验时,要遵循安全操作规范,并应在监督下进行以确保没有任何危险。
另外,在实验室环境中完成此类实验可提供更好的安全性。
希望这个简单而有趣的科学实验能够激发您对科学探索和学习的兴趣!。

对“电解水”实验的改进一、创新实验名称:水电解化学实验设计二、创新实验目的在初中化学中的《电解水》是个很重要的实验,通过该实验使学生认识水的元素组成和水分子的原子构成。
山东鲁教版教材使用的霍夫曼式水电解器,由于生产商提供的电极材料是石墨或钢丝,电解速度太慢,大概一节课快结束时才能验证,并且实验还未完成酸液或碱液就会从长颈漏斗口溢出,操作不便、易损坏等诸多原因,被弃之不用。
于是变成老师讲实验现象,学生硬背实验结论。
为解决这个问题,我在霍夫曼式水电解器做了一些改进,适合于教师演示,整个装置简单,易于操作,实验效果良好,整个实验只需3分钟左右的时间,就可验证两极产生的气体。
三、创新实验仪器及试剂霍夫曼电解器、长颈漏斗、保险丝(较粗)、15%硫酸溶液、木条、火柴、学生用直流电源(12V及以上)、橡皮导管、酒精灯、小砂轮、剪刀。
四、实验仪器装置图及仪器的组装说明首先将原装置的石墨电极(或其它电极)改换成保险丝;其次,在长颈漏斗中部用小砂轮将其切断,用长20厘米的橡皮管连接;最后用细铁丝检查两端活塞处的小孔是否畅通。
五、实验操作部分(1)将霍夫曼电解器固定在铁架台上;(2)打开霍夫曼电解器两边刻度玻璃管上的活塞,往长颈漏斗里倒入浓度为15%硫酸溶液。
待两个刻度管里的液体将升到活塞时,倾倒的速度减慢,使液面稍稍超过两个活塞;(3)关闭活塞,用卷成细卷的滤纸条伸入活塞上的玻璃管中,吸去超过活塞的液体;(4)通入12V直流电,两极冒出大量气泡,为了避免因氧气的溶解度比氢气大造成V(H2):V(O2)﹥2:1,可电解一会儿后打开活塞放掉两极的气体再关闭活塞进行实验,使氧气在液体中浓度达到饱和;(5)2到3分钟后,当阳极产生的气体10毫升时,打开活塞,用带火星的木条去检验,带火星的木条能复燃;负极产生气体大约有20毫升时,即可打开活塞,用燃着的木条去点燃,产生黄色火焰。
六、装置改进的意义(1)一般生产商使用石墨碳棒作电极,反应虽快,但表面有东西剥落,对溶液造成很严重的污染,影响实验现象的观察,况且做完一次实验必须更换电极,重新制作石墨碳棒又比较麻烦;(2)不锈钢丝(生产商提供)做电极易与酸反应也会不断氧化溶解,用碱液虽较快一点,但电解器的活塞开关易被粘结;(3)用金属铂(白金)做电极效果较好,但价格太贵,学校实验室一般没有;(4)用铜和铝导线做电极,两极产生气泡速率太慢,且铜电极变绿。

科学实验教案 - 如何进行水的电解实验一、实验目的通过水的电解实验,使学生了解电解现象和水的组成,培养观察、记录实验现象以及科学思维能力。
二、实验材料1.盛水的2.9V电池或其他电源3.两个导线4.两个电极(例如金属钉、铜片等)5.长草纸三、实验步骤1.准备工作:在盛水的中加入适量的水。
将两个导线的一端分别连接到电池的正极和负极。
将另一端分别固定在两个电极上。
2.进行实验:将两个固定好的电极同时插入中的水中。
打开电源,使电流通过水进行电解。
3.观察实验现象:观察电解过程中水的变化。
注意观察电解产生的气体、导电能力等现象。
4.记录实验结果:使用长草纸将实验现象进行记录。
绘制电解过程中电极上析出的气体的形状、颜色等变化。
四、实验注意事项1.进行实验时,应小心操作,注意安全。
不要将电源连接时间过长,以防发生意外。
2.实验完成后,关闭电源,将导线与电极分离,清理实验用具。
五、实验原理水的电解是指利用电流通过水溶液时,使水分解成氢气和氧气的过程。
电解水的方程式为2H2O → 2H2 + O2.通过观察电解过程中电极上析出的气体的形状和体积变化,可以了解水的组成和电解现象。
六、实验扩展1.增加电池的电压,观察对电解现象的影响。
2.尝试使用其他电解质溶液(如盐水、酸溶液等)进行电解实验,比较其与水电解的不同。
七、实验总结通过本实验,我们了解到水的电解是将水分解成氢气和氧气的过程。
同时,我们培养了观察、记录实验现象以及科学思维能力。
此实验还有许多扩展实验,可以进一步深入研究电解现象。

初中化学自制电解水教案目标:了解电解水的概念,掌握自制电解水的方法并进行实验观察。
一、电解水的概念1. 电解水是指利用电流通过水溶液时,水分子发生电解反应,将水分解成氧气和氢气的过程。
2. 电解水的化学方程式:2H₂O(l) → 2H₂(g) + O₂(g)3. 电解水是一种实验室常见的化学实验,也可以用来制取氢气和氧气。
二、自制电解水的方法1. 准备工具和材料:电解槽、电源(直流电源)、导线、铂电极、盐桥、蒸馏水、盐和酒精灯。
2. 实验步骤:a. 在电解槽中注入蒸馏水,加入少量盐溶液并搅拌均匀。
b. 将铂电极分别连接电源的正负极,并放入电解槽中。
c. 用盐桥连接两个电解槽,以保证电解反应的进行。
d. 打开电源,调节电流强度,并观察电解水的反应过程。
e. 分别观察电极产生的气体,用火柴点燃检验气体性质。
三、实验观察结果与结论1. 实验后,观察到正极产生氧气,负极产生氢气的现象。
2. 氧气在火柴附近会点燃,氢气则会使火柴燃烧更旺。
3. 反应过程中,水分子被电解分解成氢气和氧气,证实了电解水的存在和反应规律。
四、拓展延伸1. 你还可以尝试用不同的电极材料和电解质溶液进行实验,观察气体产生的情况有何不同。
2. 可以尝试在实验中使用不同的电流强度,探究对于气体生成速率的影响。
五、实验安全注意事项1. 实验过程中要小心操作,避免发生意外。
2. 电源调节时要注意电流强度不要过大,以防电解槽过热。
3. 实验结束后要关闭电源,及时清洗实验器材。
六、总结与评价通过本次实验,学生们掌握了自制电解水的方法,并观察到了水分子在电解过程中分解成氢气和氧气的现象,对化学反应有了更深入的认识。
希望同学们能够在实验中保持好奇心,勇于尝试,探索更多有趣的化学现象。

初中化学电解水实验的教案
实验目的:通过电解水实验,探究水的电解现象以及产生氧气和氢气的规律。
实验器材:电解池、电池、导线、铜板、玻璃试管、盐水溶液、夹子等
实验步骤:
1. 将电解池放置在实验台上,确保电解池中有足够的水填满,同时将正负极电极接好。
2. 将铜板和玻璃试管分别用夹子固定在电解池内,确保安全。
3. 将电解池连接电池,开启电源。
4. 用导线连接正极电极和铜板,连接负极电极和玻璃试管。
观察实验现象。
5. 在实验过程中记录气体种类及产生量。
实验记录:
1. 正极电极:铜板负极电极:玻璃试管
2. 实验现象:观察到水中的氧气气泡从负极电极释放,同时在正极电极观察到水中的氢气
气泡释放。
3. 实验中观察到玻璃试管中氢气气体的产生量比氧气产生量要多。
实验结论:
根据实验现象观察及实验记录,可以得出如下结论:
1. 水在电解时会分解成氧气和氢气。
2. 氧气在负极电极释放,氢气在正极电极释放。
3. 氢气的产生量比氧气的产生量要多,这是由于水的分子中氧原子数比氢原子数多的缘故。
拓展实验:
1. 可以进一步探究不同电解液中水分解现象的差异。
2. 可以研究电解液浓度、电流强度对水分解现象的影响。
注意事项:
1. 在进行实验时要注意安全,遵守实验室安全操作规程。
2. 实验结束后要及时关闭电源,避免发生意外。
3. 实验后要及时清洗器材,保持实验室整洁。

电解水实验过程
电解水实验过程
一、准备物质:
(1)准备盐酸、稀释的氢氧化钠溶液、纯水、2块平板铜、2块铁板和2根合金线。
(2)准备1只电热杯,1只烧杯,1只铝箔纸,1只氢气灯,1只腐蚀电源,1台电子秤,1只板式烧杯。
二、安装实验器具:
(1)将电热杯底部装上烧杯,将2块平板铜放在电热杯的两侧;
(2)在平板铜上面粘贴铝箔纸,用热封剂将铝箔纸完全封住;
(3)将2块铁板放置在平板铜的两侧,将2根合金线贯通每块铁板,然后将2根合金线分别接通腐蚀电源的正负极;
(4)利用氢气灯,将实验烧杯上的气体排出;
(5)在平板铜之间放入稀释的氢氧化钠溶液,将实验烧杯倒入电热杯里,将氢气灯的出口安装上板式烧杯,将烧杯中加入盐酸,并保持水位在烧杯中;
(6)将电热杯上插上电源,用电子秤测量盐酸的重量。
三、开始实验:
(1)将腐蚀电源的电流调节到50mA;
(2)将电热杯加热温度调节到80℃,保持30分钟;
(3)用电子秤再次测量盐酸的重量,并记录;
(4)将电流调节到100mA,将加热温度调节到80℃,保持30分
钟;
(5)最后再用电子秤测量盐酸的重量,并记录。
四、小结:
本次实验使用盐酸进行电解水,调节电流从50mA到100mA,温度从室温调节到80℃,随着电流和温度的增加,盐酸的重量也随之增加,说明盐酸被解离出来,成为氢氧化氢、氢氧化钠和水,即完成电解水的过程。

电解水实验的创新设计
电解水实验是化学实验中重要的一部分,它以分离水的氢离子和氧离子的形式探索电解质的各种特性。
本文将介绍一种电解水实验的创新设计。
首先,介绍一种新的实验装置的构成。
该装置由电极放电箱、溶液加热器、气体收集管和水杯组成。
电极放电箱由不同类型的电极两个极板相互穿插连接而成。
当装置中的溶液被加热,电极放电箱就会产生电荷,并通过放电来分离水中的氢离子和氧离子。
气体收集管通过连接到水杯而形成一个闭环,用于收集分离出来的气体。
其次,介绍电解水实验的实施过程。
首先,在放电箱中安放电极,将电路的极板连接好。
接着,将溶液加热到一定温度,以便实现电解质的分离。
随后,气体收集管将通过水杯连接起来,并在过程中将分离的气体收集起来。
最后,电极会从溶液中抽取出分离出来的氢离子和氧离子,以完成电解水实验。
最后,简要概括电解水实验的优点。
首先,该实验装置利用了一种全新的技术,可以更加有效地分离水中的氢离子和氧离子。
其次,新的实验装置可以有效地收集分离的气体,从而避免出现溢出的现象。
最后,新的实验装置可以有效地控制模拟实验的环境,从而获得准确的实验结果。
总之,本文介绍了一种电解水实验的创新设计。
新的实验装置可以有效地分离水中的氢离子和氧离子,并有效地收集分离出来的气体,从而获得更准确的实验结果。
因此,该实验装置对研究电解质具有重
要意义,并且在学术研究中有着广泛的应用前景。

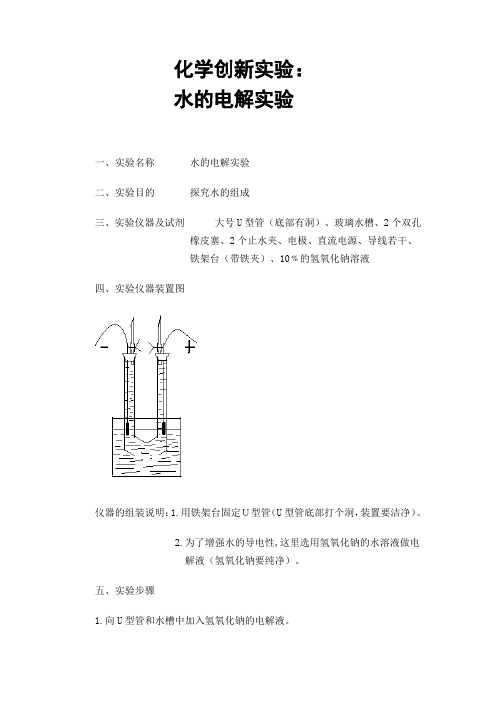
化学创新实验:
水的电解实验
一、实验名称水的电解实验
二、实验目的探究水的组成
三、实验仪器及试剂大号U型管(底部有洞)、玻璃水槽、2个双孔
橡皮塞、2个止水夹、电极、直流电源、导线若干、
铁架台(带铁夹)、10﹪的氢氧化钠溶液
四、实验仪器装置图
仪器的组装说明:1.用铁架台固定U型管(U型管底部打个洞,装置要洁净)。
2.为了增强水的导电性,这里选用氢氧化钠的水溶液做电
解液(氢氧化钠要纯净)。
五、实验步骤
1.向U型管和水槽中加入氢氧化钠的电解液。
2.用导线将电极连接在学生电源上,接通电源,观察现象。
待产生气体体积比接近2:1时关闭电源。
3.气体检验:将燃着的木条放在与负极相连的导管口,打开止水夹,观察现象。
将带火星的木条放在与正极相连的导管口,打开止水夹,观察现象。
六、装置改进的意义
人教版九年级化学第三单元课题1 水的组成中,通过电解水实验现象及产物分析,得出水的组成。
但课本中的装置在操作中有些不足:
1.装置固定较难。
2.气体检验困难。
装置改进后就可以弥补以上不足,尤其在气体检验上操作简单,现象明显。

电解水的实验教案初中化学第一篇:电解水的实验教案初中化学电解水的实验教案一、教学目标1,由已有知识让学生掌握水的化学性质、电解水的实验原理和基本的实验操作。
2,让学生了解电解水的实验操作过程和现象,并学会分析实验结果。
3,让学生加强理解水的组成部分及其比例,氢气和氧气的性质。
二、导入新课(提问)大家都知道刚洗过手不能触碰电源,为什么?(因为手上有水,容易导致触电,说明水是可以导电的。
)大家都知道水是无色无味的,这是它的什么性质?还有什么其他的物理性质?(物理性质,还有水为液体,水的密度等)那么水的组成是什么?下面我们用实验来验证一下。
(由氢元素和氧元素组成。
注意是元素。
)三、任务描述1,用电解法证明水中含有氢元素和氧元素;2,电解产生的氢气和氧气的比例是2:1。
四、重点和难点重点:由电解水的实验推测水的组成。
实验一定要精确,才能正确判断出水的组成部分和比例。
难点:电解水的具体实验过程。
实验过程中要注意的细节问题,安全问题和具体步骤。
五、实验设计实验仪器:电池、导线、火柴、木条、水槽、试管。
实验试剂:蒸馏水、1:4稀硫酸。
实验原理:1,水在通电情况下会发生水解,电解阴极产物为氢气,阳极产物为氧气,其体积比为2:1,以此可以确定水的组成成分。
2,纯水导电能力不强,电解速度慢,因此为改善这个问题,加快电解速度,可加入适量稀硫酸等电解质来增强水的导电能力。
实验步骤:(可以叫两名同学上来协助实验,利于观察实验过程和结果)按照装置图搭建,并检查装置的气密性。
然后通电,让同学观察与正负极相连的试管中气体的量。
提问同学来描述他观察到的现象。
(通电后电极周围产生大量气泡,两个试管中都有气泡产生,并看到水面下降,与电源负极相连的阴极产生气体体积大约为与电源正极相连的阳极产生气体体积的两倍。
)验证气体:用带有火星的木条检验氧气,若复燃则证明为氧气;用点燃的火柴去点燃氢气,看到淡蓝色火焰,并有水滴产生,则证明为氢气。
(提问学生,可以使他们回顾氧气和氢气燃烧的性质。

电解水实验的操作步骤及介绍教案一、实验介绍电解水实验是一项经典的物理实验,它能够帮助我们深入理解电化学的基本原理以及电解的过程。
该实验可通过简单的仪器设备进行,能够展现出直观的化学现象,是一项非常有趣和有启发性的实验。
二、实验原理水是一种分子化合物,由氧原子和氢原子通过共价键结合在一起。
水分子具有极性,因此它会分解成正负两极的离子,即氢离子和氧离子。
在电解水实验中,通过电流的作用可以将水分解成氢氧离子,然后将它们在两个极板上分别收集起来。
三、实验用具有机玻璃容器、导电板、电线、电源以及各种电化学试剂。
四、实验步骤1、准备实验用具:取一只有机玻璃容器,将导电板固定在容器底部,并且用电线将板与电源连接起来。
2、制备电化学试剂:制备氨水、盐酸和红色酚酞。
3、清洁导电板:先用水冲洗导电板,然后将其置于盐酸溶液中,使导电板得到清洁。
4、准备实验液:取一定量的氨水和红色酚酞加入到电解水容器中,然后加入适量的水,使容器中液面恰好覆盖导电板。
5、进行电解水:将电源的正负极和导电板连接后,通电即可开始电解水。
6、观察实验结果:可以观察到产生的气体以及液体变化。
在负极处会生成氢气,而在正极处会生成氧气,同时导电板上会出现鲜红的氢离子离子。
五、实验注意事项1、电解水液面应该恰好覆盖导电板。
2、在实验过程中不要触碰电压源以及导电板。
3、如果液体出现气泡多,可以适当降低电压或者调整液面高度。
4、实验完毕后将电线和电源拆解,清洗导电板及存放化学试剂。
六、实验教学目标1、了解电化学的基本原理。
2、掌握电解水操作步骤和实验注意事项。
3、获得直接观察气体和化学变化的经验。
4、培养实验操作能力和对实验结果的观察与分析能力。

图 1 图 2 图3 人教版初中化学九年级上册第四单元课题2的第1课时:探究水的组成电解水实验创新改进一、实验背景本节课内容位于人教版九年级上册第四单元课题2的第1课时探究水的组成,本课时内容是以转变学生的学习方式为重点,以“观察与思考”、“活动与探究”为主线,发挥学生学习的主动性和积极性,通过探究水的组成,建立守恒的概念,能从微观视角深度认识化学变化,了解人类研究化学物质的一般方法——实验法。
所以电解水实验是初中化学的实验教学重点之一,但在课堂教学中,传统实验探究过程繁杂、时间不足,演示效果欠佳。
为解决这个问题,特设计了一套化繁为简、现象明显,便于检验的电解水实验创新装置,它不仅适合于教师演示,而且也适合于学生分组实验,近距离观察实验现象,能够在实验器材不够完备的乡村学校普及。
二、实验用品1、实验仪器:3支改装后的10mL 注射器、细铁丝、烧杯、酒精灯、小木条、火柴、若干导线、9V 碳性方形干电池2、实验药品:10%NaOH 溶液三、实验创新要点1、传统实验的不足以上三类电解器是课堂教学常用的,在演示实验中会存在以下问题:图1为霍夫曼水电解器,能看到明显的两电极产生气泡和液面下降的现象,但体积比误差较大,收集够检验气体的量用时较长,课堂效率较低;整套装置体积较大,且由玻璃材料制成,易碎又不易清洗,由于使用了学生电源,老师在前面展示,无法移动到后面给更多的学生观察。
图2的缺点在于导线泡在电解质溶液里,气体检验时,需要将手伸到电解质溶液中取出试管;图3最大的缺点就是容易漏气。
2、创新改进因此基于以上的难点进行了思考和改进,并根据新课标对化学实验要求,创造了简易版的电解水装置,实验现象明显,结果精确,便于检验正负极气体。
主要有几下创新点:①趣味性:装置材料生活易得打破思维禁锢,培养创新精神,用注射器代替传统实验仪器更能吸引学生注意力,激发兴趣;近几年在各类考试和练习题中的实验探究题版块频繁考察注射器改进装置的探究,通过改进装置让学生认识到注射器在实验中的重要作用。

初中化学水的电解实验教案实验目的:通过实验,观察水的电解现象,了解水的电解过程和电解液的性质。
实验原理:水分子在电解过程中会分解为氢氧离子,生成氢气和氧气。
电解液中离子的运动受到电场力的作用,负电荷的阴离子向阳极移动,正电荷的阳离子向阴极移动,形成电流。
实验材料:酸性废水、电解池、电源、导线、电极(铜板或碳棒)、试管、试管架、火柴或点燃用具。
实验步骤:1. 将电解池放在试管架上,添加适量的酸性废水(酸性废水中含有H+和OH-离子)。
2. 将电极插入电解池中,一个作为阴极,一个作为阳极,并用导线连接电源。
确保电极不直接接触。
3. 打开电源开关,使电流通过电解池中的水。
观察水的两侧是否产生气泡。
4. 将试管倒置在电解池中,收集气泡。
实验现象:在电解池的两侧会产生气泡,通过观察气泡的量和气体的性质,可以判断生成氢气和氧气。
实验结果:电解过程中,水分子会分解为氢气和氧气,气体比例为1:2。
观察收集到的气泡的性质,氢气呈现指火现象,而氧气可以再次点燃火焰。
实验注意事项:1. 实验中需注意安全,禁止触碰电解液和电源。
2. 电解产生的气体具有较大的危险性,需小心操作,避免气体溢出造成危险。
3. 实验结束后,将电解液倒掉并清洗实验仪器。
实验延伸:可以尝试将不同电解液进行电解,观察不同电解液的电解现象及气体生成情况,比如食盐水、硫酸溶液等。
实验结果分析:实验结果表明,水可以发生电解现象,分解为氢气和氧气。
氢气比例较少,氧气比例较多。
在电解液中含有离子时,可导致更容易分解的现象。

初中化学电解水实验教案
【实验目的】:通过电解水的实验,使学生了解水的电解过程,掌握电解的基本原理和方法,培养学生的实践能力和动手能力。
【实验原理】:电解水是将水在电化学条件下分解为氧气和氢气的过程。
在电解水的过程中,水分子会发生电离,质子被还原成氧气,氢离子被氧化成氢气。
【实验器材】:电解池、导电板、直流电源、导线、两个电极(碳棒或铜板)、蓄电池、水、溶液电导率计。
【实验流程】:
1.准备实验器材和化学试剂,将电解池中装满蒸馏水。
2.将两个电极(碳棒或铜板)插入电解池中,接上导线,连接至直流电源的负极和正极。
3.开启直流电源,调节电压,开始电解水的实验。
4.观察电解水的过程,记录产生的气体和气体的量,观察电极的变化。
【实验内容】:
1.观察电解水的过程,记录气体的产生量,观察气泡的性质。
2.观察电解水的电极变化,记录电极的变化。
【实验结果】:
1.通过电解水的实验,得到氢气和氧气两种气体。
2.观察到电极的变化,阴极产生氢气,阳极产生氧气。
【实验结论】:电解水是将水在电化学条件下分解成氢气和氧气的过程,水经过电解将会分解成氢和氧两种气体,在电解的过程中,阴极产生氢气,阳极产生氧气。
【注意事项】:
1.实验过程中要小心操作,避免发生意外。
2.实验结束后要注意清理实验器材和化学试剂。
3.对实验结果进行记录和分析,及时向老师汇报实验结果。

水的电解实验报告一、实验目的1、了解电解水的原理。
2、掌握水的电解实验的操作方法。
3、验证水是由氢和氧两种元素组成。
二、实验原理水(H₂O)在通电的条件下,会发生分解反应,生成氢气(H₂)和氧气(O₂)。
其化学方程式为:2H₂O ==通电== 2H₂↑ + O₂↑三、实验用品1、仪器:直流电源、电解槽、导线、小试管、木条。
2、药品:蒸馏水、硫酸钠(增加水的导电性)。
四、实验步骤1、检查实验用品是否齐全完好。
2、向电解槽中加入适量的蒸馏水,再加入少量硫酸钠,搅拌使其溶解,以增强水的导电性。
3、连接好电路,将两根导线分别连接在直流电源的正负极上,另一端插入电解槽中。
4、把两个小试管倒扣在电解槽中的电极上,收集电解产生的气体。
5、通电一段时间后,观察两个试管中气体的体积。
可以发现,连接电源负极的试管中气体体积约为连接电源正极的试管中气体体积的两倍。
6、检验气体:用带火星的木条伸入连接电源正极的试管口,木条复燃,证明该气体是氧气。
用点燃的木条靠近连接电源负极的试管口,气体被点燃,产生淡蓝色火焰,证明该气体是氢气。
五、实验现象及数据记录1、实验现象通电后,电极上有气泡产生。
负极产生的气体体积约是正极产生气体体积的两倍。
正极产生的气体能使带火星的木条复燃,负极产生的气体能燃烧,产生淡蓝色火焰。
2、数据记录电解时间:_____分钟正极产生气体的体积:_____毫升负极产生气体的体积:_____毫升六、实验结果分析1、根据实验现象和数据,我们可以得出:水在通电的条件下分解生成氢气和氧气。
2、氢气和氧气的体积比约为 2 : 1,这与水的电解化学方程式2H₂O ==通电== 2H₂↑ + O₂↑ 中氢、氧两种气体的系数比 2 : 1 相符合。
3、通过对生成气体的检验,进一步证明了水是由氢元素和氧元素组成的。
七、实验注意事项1、电解所用的水必须是蒸馏水,以减少杂质对实验的影响。
2、硫酸钠的加入量要适量,过多或过少都会影响实验效果。

高中化学电解水实验教案实验目的:通过电解水实验,观察水的电解现象,了解水分解为氢气和氧气的过程,并掌握电解水的基本原理。
实验器材与试剂:1. 电解仪2. 直流电源3. 试管4. 盐桥5. 水6. 氢气探气管7. 火柴实验步骤:1. 将电解仪中的两个电极插入试管中,加入一定量的水,注意水位要高于两个电极。
2. 将盐桥连接两个电极,使电解仪能够通电。
3. 打开直流电源,调节电流至适当值,开始进行电解水实验。
4. 观察试管中的气体产生情况,用氢气探气管收集气体,并用火柴点燃气体。
5. 记录实验现象,观察气体的性质和反应过程。
实验现象:1. 在负极末端观察到气泡产生,并且气泡呈现两种不同的气体。
2. 用氢气探气管收集气体,点燃气体时,发出“吱吱”的声音并有火苗。
3. 气体点燃后,观察火焰的颜色和大小。
实验原理:1. 电解水是将水通过直流电流分解为氢气和氧气的过程,其化学反应为:2H2O(l) → 2H2(g) + O2(g)2. 负极发生还原反应:2H2O(l) + 2e^- → H2(g) + 2OH^-(aq)3. 正极发生氧气析出反应:4OH^-(aq) → O2(g) + 2H2O(l) + 4e^-注意事项:1. 实验中要注意安全,防止发生漏电或其他电击现象。
2. 电解水实验产生的氢气是易燃的,要小心处理和储存气体。
3. 实验结束后要及时断开电源,清洗实验器材。
实验结果分析:通过电解水实验,观察到水分解为氢气和氧气的现象,掌握了电解水的基本原理,加深了对水的化学性质的理解。
延伸实验:可以对不同浓度的电解质溶液进行电解实验,观察在不同条件下气体产生的情况。
(注:实验中的具体步骤和参数可根据实际情况进行调整,以确保实验安全和效果。
)。
电解水的创新实验
对“电解水”实验的改进
一、创新实验名称:水电解化学实验设计
二、创新实验目的
在初中化学中的《电解水》是个很重要的实验,通过该实验使学生认识水的元素组成和水分子的原子构成。
山东鲁教版教材使用的霍夫曼式水电解器,由于生产商提供的电极材料是石墨或钢丝,电解速度太慢,大概一节课快结束时才能验证,并且实验还未完成酸液或碱液就会从长颈漏斗口溢出,操作不便、易损坏等诸多原因,被弃之不用。
于是变成老师讲实验现象,学生硬背实验结论。
为解决这个问题,我在霍夫曼式水电解器做了一些改进,适合于教师演示,整个装置简单,易于操作,实验效果良好,整个实验只需3分钟左右的时间,就可验证两极产生的气体。
三、创新实验仪器及试剂
霍夫曼电解器、长颈漏斗、保险丝(较粗)、15%硫酸溶液、木条、火柴、学生用直流电源(12V及以上)、橡皮导管、酒精灯、小砂轮、剪刀。
四、实验仪器装置图及仪器的组装说明
首先将原装置的石墨电极(或其它电极)改换成保险丝;其次,在长颈漏斗中部用小砂轮将其切断,用长20厘米的橡皮管连接;最后用细铁丝检查两端活塞处的小孔是否畅通。
五、实验操作部分
(1)将霍夫曼电解器固定在铁架台上;
(2)打开霍夫曼电解器两边刻度玻璃管上的活塞,往长颈漏斗里倒入浓度为15%硫酸溶液。
待两个刻度管里的液体将升到活塞时,倾倒的速度减慢,使液面稍稍超过两个活塞;(3)关闭活塞,用卷成细卷的滤纸条伸入活塞上的玻璃管中,吸去超过活塞的液体;(4)通入12V直流电,两极冒出大量气泡,为了避免因氧气的溶解度比氢气大造成V
(H2):V(O2)﹥2:1,可电解一会儿后打开活塞放掉两极的气体再关闭活塞进行实验,使氧气在液体中浓度达到饱和;
(5)2到3分钟后,当阳极产生的气体10毫升时,打开活塞,用带火星的木条去检验,带火星的木条能复燃;负极产生气体大约有20毫升时,即可打开活塞,用燃着的木条去点燃,产生黄色火焰。
六、装置改进的意义
(1)一般生产商使用石墨碳棒作电极,反应虽快,但表面有东西剥落,对溶液造成很严重的污染,影响实验现象的观察,况且做完一次实验必须更换电极,重新制作石墨碳棒又比较麻烦;(2)不锈钢丝(生产商提供)做电极易与酸反应也会不断氧化溶解,用碱液虽较快一点,但电解器的活塞开关易被粘结;(3)用金属铂(白金)做电极效果较好,但价格太贵,学校实验室一般没有;(4)用铜和铝导线做电极,两极产生气泡速率太慢,且铜电极
变绿。
总之常见物质不是溶解就是被粉碎,要么产生气泡的速率太慢,要么就是很快被钝化不导电了......而电极如果选用价格低、容易取材的保险丝,在长颈漏斗中间加一段橡皮管,用15%的酸或碱液做电解液解决了以上各方面的不足,短时间内做完水电解实验,给老师上课赢得了时间,避免实验器材长时间放在讲桌上分散学生的注意力,也不会带来装置易跌倒和酸外溢造成的不安全因素。