医院消毒效果检测报告模版
- 格式:doc
- 大小:970.50 KB
- 文档页数:12

样品受理编号: 第1页/共9页被监测单位 采样单位 采样人 检测项目 医院**省卫生监督所、**省疾病预防控制中心医院消毒效果监测采样日期 送样日期 检毕日期2008年 10月15日 2008年 10月15日 2008年 10月22日检验依据《消毒技术规范》2002年版、医院消毒卫生标准GB15982-1995、消毒与灭菌效果的评价方法与标准GB15981-1995、医疗机构污水排放要求GB18466-2005、《内镜清洗消毒技术操作规范(2004年版)》检验结论:1. 经检测: 医院除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。
2. 经检测: 医院受检的物体表面消毒效果监测结果符合GB15982-1995的规定。
3. 经检测: 医院受检的使用中消毒液监测结果符合GB15982-1995的规定。
4. 经检测: 医院受检的医护人员手消毒效果监测结果均符合GB15982-1995的规定。
5. 经检测: 医院受检的医院污水消毒效果监测结果符合GB18466-2005的规定。
6. 经检测: 医院受检的脉动预真空高压蒸汽灭菌器灭菌效果监测结果符合GB15981-1995的规定。
7. 经检测: 医院受检的新医科寸银针、新医科寸银针、口腔门诊手机头、口腔门诊车针的灭菌效果监测结果符合GB15982-1995的规定。
8. 经检测: 医院受检的消化内科胃镜(2522315)、支纤镜(25027)、肠镜(2710832)的消毒效果监测结果符合《内镜清洗消毒技术操作规范(2004年版)》的规定。
以下空白**省疾病预防控制中心检 验 报 告样品受理编号: 第1页/共9页 被监测单位 采样单位 采样人 检测项目 医院湖南省卫生监督所、湖南省疾病预防控制中心医院消毒效果监测采样日期送样日期检毕日期2008年 10月15日 2008年 10月15日 2008年 10月22日检验依据《消毒技术规范》2002年版、医院消毒卫生标准GB15982-1995、消毒与灭菌效果的评价方法与标准GB15981-1995、医疗机构污水排放要求GB18466-2005、《内镜清洗消毒技术操作规范(2004年版)》检验结论:1. 经检测: 医院除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。
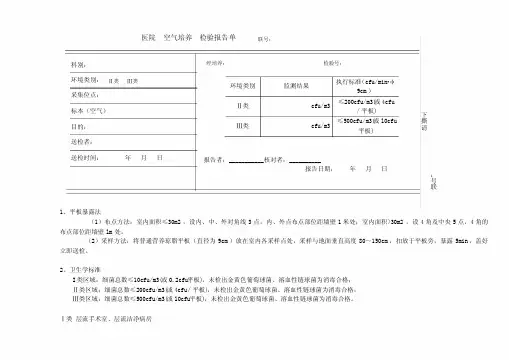
医院 空气培养 检验报告单 联号:1、平板暴露法(1)布点方法:室内面积≤30m2,设内、中、外对角线3点,内、外点布点部位距墙壁1米处;室内面积>30m2,设4角及中央5点,4角的布点部位距墙壁lm 处。
(2)采样方法:将普通营养琼脂平板(直径为9cm )放在室内各采样点处,采样与地面垂直高度80~150cm ,扣放于平板旁,暴露5min ,盖好立即送检。
2、卫生学标准I 类区域:细菌总数≤10cfu/m3(或0.2cfu/平板),未检出金黄色葡萄球菌、溶血性链球菌为消毒合格; Ⅱ类区域:细菌总数≤200cfu/m3(或4cfu /平板),未检出金黄色葡萄球菌、溶血性链球菌为消毒合格: Ⅲ类区域:细菌总数≤500cfu/m3(或l0cfu 平板),未检出金黄色葡萄球菌、溶血性链球菌为消毒合格。
Ⅰ类 层流手术室、层流洁净病房科别:环境类别: Ⅱ类 Ⅲ类 采集位点: 标本(空气) 目的:送检者: 送检时间: 年 月 日经培养: 检验号:环境类别监测结果执行标准(cfu/min ·φ9cm )Ⅱ类 cfu/m3≤200cfu/m3(或4cfu/平板) Ⅲ类 cfu/m3≤500cfu/m3(或l0cfu平板)报告者:___________核对者:__________报告日期: 年 月 日请撕下 联号:Ⅱ类 普通手术室、产房、婴儿室、早产儿室、普通保护性隔离室、供应室无菌区、烧伤病房、重症监护病房。
Ⅲ类 儿科病房、妇产科检查室、注射室、换药室、治疗室、供应室清洁区、急诊室、化验室、各类普通病房 Ⅳ类 传染病科及病房医院 医务人员手 检验报告单 联号:1. 采样时间:在接触患者或从事医疗活动前进行采样。
2.采样面积及方法: 被检人五指并拢,将浸有无菌9g/L 氯化钠溶液的棉拭子一支在双手曲面从指根到指端来回涂擦各两次(一只手涂擦面积约30cm2),并随之转动采样棉拭子,剪去手接触部位,将棉拭子放入装有10ml 采样液的试管内送检。

检验报告**(消杀检样)检字第201000269[1-4]号
委托单位:****县妇幼保健院门诊注射室产品名称:碘伏等
检验目的:消毒效果监测
报告日期:
湖北省**县疾病预防控制中心
注意事项
1、检测报告无“实验室资质认定标志及认证号”、“检测专用章”和“骑缝章”无效。
2、检测报告涂改、增删无效。
到毛检测仅对来样负责。
3、未经本中心书面同意不得部分复制(全文复制除外)检测报告
4、检测报告无编制人、审核人、授权签字人签字无效。
5、对检测报告若有异议,应于收到检测报告之日起7天内向我单位提出,逾期视作对本报告无异议。
6、样品送检数量不能满足复检、仲裁需要量,复检、仲裁时间已超过样品保质期或按有关规定不进行复检、仲裁的检验项目不接受送检单位复检、仲裁要求。
7、未经本中心同意,州可单位和个人不得以本中心的名义和本检测报告作商业广告。
8、凡伪造本中心检测报告,作虚假广告,本中心将追究法律责任。
9、本检测报告一式二份,一份由检测机构存档,一份交送检单位。
10、带“*”项目为分包检测项目。
实验室地址:**县**镇*********
邮政编码:433300 电话:*********
传真:电子邮箱:
湖北省**县疾病预防控制中心
检验报告
20091704155 ***(消杀检样)检字第201000269[1-4]号
(盖章)
检验者:复核者:授权签字人:
日期:日期:日期:
(第1页共1页)。

样品受理编号:第1页/共9页被监测单位采样单位采样人检测项目医院**省卫生监督所、**省疾病预防控制中心医院消毒效果监测采样日期送样日期检毕日期2008年10月15日2008年10月15日2008年10月22日检验依据《消毒技术规范》2002年版、医院消毒卫生标准GB15982-1995、消毒与灭菌效果的评价方法与标准GB15981-1995、医疗机构污水排放要求GB18466-2005、《内镜清洗消毒技术操作规范(2004年版)》检验结论:1.经检测:医院除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。
2.经检测:医院受检的物体表面消毒效果监测结果符合GB15982-1995的规定。
3.经检测:医院受检的使用中消毒液监测结果符合GB15982-1995的规定。
4.经检测:医院受检的医护人员手消毒效果监测结果均符合GB15982-1995的规定。
5.经检测:医院受检的医院污水消毒效果监测结果符合GB18466-2005的规定。
6.经检测:医院受检的脉动预真空高压蒸汽灭菌器灭菌效果监测结果符合GB15981-1995的规定。
7.经检测:医院受检的新医科2.5寸银针、新医科1.5寸银针、口腔门诊手机头、口腔门诊车针的灭菌效果监测结果符合GB15982-1995的规定。
8.经检测:医院受检的消化内科胃镜(2522315)、支纤镜(25027)、肠镜(2710832)的消毒效果监测结果符合《内镜清洗消毒技术操作规范(2004年版)》的规定。
以下空白签发人:最终审核日期:2008年11月07日样品受理编号:第1页/共9页被监测单位采样单位采样人检测项目医院湖南省卫生监督所、湖南省疾病预防控制中心医院消毒效果监测采样日期送样日期检毕日期2008年10月15日2008年10月15日2008年10月22日检验依据《消毒技术规范》2002年版、医院消毒卫生标准GB15982-1995、消毒与灭菌效果的评价方法与标准GB15981-1995、医疗机构污水排放要求GB18466-2005、《内镜清洗消毒技术操作规范(2004年版)》检验结论:1.经检测:医院除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。

消毒剂消毒效果的验证组长:***组员:*** ****** ****** ****** ******编号:1135版次:2014 年第 1 版目录1.概述 ............................................................................................................... 错误!未定义书签。
消毒剂 ................................................................................................................. 错误!未定义书签。
消毒剂使用说明 ................................................................................................. 错误!未定义书签。
2.验证目的 ....................................................................................................... 错误!未定义书签。
3.验证内容 ....................................................................................................... 错误!未定义书签。
4.验证组织 ....................................................................................................... 错误!未定义书签。
验证小组 ............................................................................................................. 错误!未定义书签。

消毒剂消毒效果验证报告验证编号:药业有限公司2013年11月验证报告确定目录验证概述 (1)验证准备 (1)试验仪器设备 (1)试验用品 (1)菌种及菌液 (2)消毒剂 (2)菌液计数 (3)菌片制备 (3)菌片菌数复核 (3)载体喷洒消毒杀菌效力试验 (4)载体喷洒消毒杀菌效力试验结果 (4)载体喷洒消毒杀菌效力试验结论 (19)人员培训 (19)变更及偏差 (19)验证结论 (19)1.0验证概述1.1对75%乙醇、%新洁尔灭消毒效果进行验证,验证中根据洁净区不同材质选择规则表面载体(详见消毒剂消毒效果验证方案),验证后总结数据形成报告。
2.0验证准备试验仪器设备:(设备的检验情况详见校验记录)试验用品:(培养基的制备及适用性检查详见制备及适用性检查记录)菌种及菌液:(菌液制备详见原始记录)消毒剂:(消毒剂的配制详见原始记录)菌液计数:(菌液计数详见原始记录)确认人/日期:复核人/日期:菌片的制备:详见原始记录。
菌片菌数复核:2.7.1 合格标准:回收菌片的含菌量应不小于105cfu/片。
2.7.2 结论:上述结果显示,每个菌片的含菌量均不小于105 cfu/片,符合验证试验要求。
确认人/日期:复核人/日期:3.0载体喷洒消毒杀菌效力试验载体喷洒消毒杀菌效力试验结果:合格标准:要求各次试验的杀灭对数值均≥3,可判定消毒合格。
结论:上述各次实验结果显示,经消毒剂喷洒消毒后,软塑料载体菌片的杀灭对数值均大于3,符合标准要求。
确认人/日期:复核人/日期:合格标准:要求各次试验的杀灭对数值均≥3,可判定消毒合格。
结论:上述各次实验结果显示,经消毒剂喷洒消毒后,硬质塑料载体菌片的杀灭对数值均大于3,符合标准要求。
确认人/日期:复核人/日期:合格标准:要求各次试验的杀灭对数值均≥3,可判定消毒合格。
结论:上述各次实验结果显示,经消毒剂喷洒消毒后,不锈钢载体菌片的杀灭对数值均大于3,符合标准要求。
确认人/日期:复核人/日期:合格标准:要求各次试验的杀灭对数值均≥3,可判定消毒合格。

我院医院环境卫生及消毒灭菌效果三年监测报告目的:了解我院环境卫生及消毒灭菌效果,进一步提高医院感染管理质量。
方法:常规现场抽检采样和检测。
结果:我院自2005年1月~2007年12月三年各项监测共采样6 562份,结果符合要求6 421份,合格率为97.85%。
各项合格率分别为:室内空气为97.84%,物体表面为96.52%,医护人员手为97.66%,使用中消毒液98.39%,无菌器械保存液为96.64%,无菌物品为100.00%,灭菌器为97.29%,紫外线灯辐照强度为99.87%,透析用水和透析液为92.16%。
结论:我院消毒灭菌质量整体较好,但存在消毒液质量和使用不规范等现象,应加大消毒管理和监督力度,落实消毒隔离制度,从而有效控制医院感染的发生。
标签:消毒灭菌;监测;医院感染医院消毒是控制和预防医院感染的重要手段,消毒效果的监测是评价其消毒设备运转是否正常、消毒剂是否有效、消毒效果是否达标的唯一手段[1]。
加强消毒灭菌管理是控制医院感染发生的重要环节,为了解我院消毒工作质量,对2005年1月~2007年12月三年的消毒灭菌监测结果进行了初步分析。
1 对象与方法1.1 对象监测对象为医院重点科室及部门室内空气、物体表面、医护人员手、使用中消毒液、无菌器械保存液、无菌物品、灭菌器、透析液及透析用水、紫外线灯辐照强度。
1.2 方法室内空气在消毒处理后、操作前关好门窗,于无人走动的情况下,采用平板暴露法進行采样,将直径为9 cm的普通营养琼脂平板放置各采样点自然暴露5 min采样。
洁净手术室室内空气采样,按卫生部《医院洁净手术部建筑技术规范》采样,用沉降法测定沉降菌密度。
物体表面和手用浸有含相应中和剂的无菌洗脱液的棉拭子做涂抹采样,取样进行活菌计数培养;部分采用平板压印法计数培养。
使用中消毒液和无菌器械保存液用无菌吸管吸取消毒液,加入含相应中和剂的采样管内,作10倍稀释混匀后取样活菌计数培养。
无菌医疗物品用浸有无菌生理盐水的棉拭子在器械表面往返涂抹5次,将棉拭子投放入普通营养肉汤中培养。

消毒检测报告
尊敬的客户您好,
根据您的要求,我们为您完成了本次消毒检测工作,并提供以下报告。
一、检测方法
我们采用了专业的消毒检测方法,具体包括对消毒剂残留量、微生物学指标、可见物污染、气味、光洁度等方面的检测。
二、检测结果
1.消毒剂残留量:我们对您的设施进行了多点取样,检测结果显示,您的设施中消毒剂残留量均在国家标准范围内,不会对人体造成危害。
2.微生物学指标:我们对您的设施进行了多点取样,检测结果显示,您的设施内无致病微生物,符合卫生标准。
3.可见物污染:我们对您的设施进行了光洁度检测,检测结果
显示,您的设施内的可见物污染在合理范围内,不影响设施的卫
生状态。
4.气味:我们对您的设施进行了气味检测,检测结果显示,您
的设施内无异味。
5.光洁度:我们对您的设施进行了光洁度检测,检测结果显示,您的设施内保持了良好的卫生状态。
三、结论
根据本次检测结果,您的设施符合卫生标准,设施内无毒性物
质残留,无致病微生物,保持了良好的卫生状态。
四、建议
我们建议您在日常消毒工作时,注意消毒剂使用量和时间的控制。
同时,您可根据我们的报告,对设施进行一定的清洁和消毒工作,保持设施的良好卫生状态。
祝您生活愉快!
此致
敬礼
检测单位名称:xxxxxx
检测日期:20xx年xx月xx日
签字盖章:。

医疗机构消毒质量监测与卫生调查结果分析摘要目的:对医疗机构消毒工作进行监测、评价。
方法:采用GB规定方法对医院内各类检测点进行采样、检验。
结果:医院污水消毒排放超标率为52.94%,室内空气超标率为39.57%,物体表面细菌超标率为5.93%,医护人员手细菌超标率为10.29%,一次性使用医疗用品微生物指标超标率为2.91%,一次性使用卫生用品微生物指标超标率为9.09%,使用中消毒剂细菌超标率为1.564%,紫外线灯辐照强度和压力蒸汽灭菌器均为100.00%合格,调查中所检不合格样品则以细菌总数超标为多见。
结论:医疗机构应强化消毒意识,把好一次性使用医疗用品及卫生用品进货质量关,严禁不合格用品流入医院。
关键词医疗机构;消毒质量监测;卫生指标医院消毒是预防医院内感染的重要手段之一,加强对医院消毒效果的监督、监测是控制医院感染,防止传染病流行,保障人民健康的有效措施。
为此,2002年3月~2002年10月对辖区内的8家市级医疗机构和10家厂矿医疗机构进行了消毒质量的预防性监测。
1 材料与方法1.1 监测对象2002年3月~2002年10月对长治市辖区的8家市级医疗机构和10家厂矿企业的医疗机构进行了消毒质量的预防性监测。
1.2 检验方法及结果判定根据GB15979-1995《一次性使用卫生用品卫生标准》、GB15980-1995《一次性使用医疗用品卫生标准》、GB15981-1995《消毒与灭菌效果的评价方法与标准》、GB15982-1995《医院消毒卫生标准》、GBJ48-83《医院污水排放标准》、卫生部《消毒技术规范》第三版第一册进行了物体表面和医护人员手、室内空气、使用中消毒剂细菌菌落总数和乙型肝炎表面抗原的检测,医院污水消毒排放,一次性使用医疗用品和卫生用品的无菌、内毒素和微生物检测、紫外线灯辐照强度和压力蒸汽灭菌器(生物法)灭菌效果的测定。
结果判定:物体表面和医护人员手:二类标准≤5cfu/cm2,三类标准≤10cfu/cm2;室内空气:二类标准≤200cfu/cm3;三类标准≤500cfu/cm3为合格;使用中消毒剂细菌菌落总数≤100cfu/ mL,一次性医疗用品使用于人体无菌组织器官必须无菌;接触粘膜和皮肤的医疗用品细菌菌落总数≤200cfu/g(100cm2)和≤200cfu/g (100cm2),均不得检出致病菌;医院污水消毒后排放,总大肠菌群≤500个/L,余氯为4mg/L~5mg/L,不得检出肠道致病菌为合格;紫外线灯辐照强度≥70uw/cm2为合格。

消毒液检测报告
报告编号:XXXXXX
检测单位:XXXXXX
检测日期:XXXX年XX月XX日
一、检测目的:
本次检测旨在验证消毒液的消毒效果,保障使用者的安全和健康。
二、样品信息:
样品名称:XXXXXX消毒液
生产日期:XXXX年XX月XX日
生产厂家:XXXXXX
三、检测标准:
GB/T 22610-2008《聚丙烯一次性医用手套》标准
四、检测方法:
1.制备聚丙烯一次性医用手套5副(左右各2只,剩余1只作
备用)。
2.将手套放入样品中,按照说明书使用。
3.用培养基涂布法对手套上进行细菌培养。
4.对培养基上的菌落进行计数,评估消毒效果。
五、检测结果:
经过消毒液处理的手套上未检出任何细菌生长,符合标准要求。
六、结论:
本次检测结果表明,样品的消毒效果达到标准要求,可保障使用者的安全和健康。
七、备注:
本次检测结果仅针对本批次样品,结果仅供参考。
检测人员:XX
检测单位盖章:XXX
附:检测证书及对应的检测报告。

消毒剂消毒效果的验证组长:***组员:*** ****** ****** ****** ******编号:201412151135版次:2014 年第 1 版目录1.概述 (3)1.1消毒剂 (3)1.2消毒剂使用说明 (3)2.验证目的 (3)3.验证内容 (4)4.验证组织 (4)4.1验证小组 (4)4.2验证委员会 (4)5.验证实施步骤 (5)5.1验证前准备 (5)5.2验证所需文件资料 (5)5.3悬液法定量杀灭试验 (6)5.4对裸手消毒效果试验 (7)5.5消毒剂对佩戴手套后的消毒效果验证 (9)5.6消毒剂对物体表面消毒效果验证 (11)5.7消毒剂消毒效果验证结论 (15)6.验证主要依据 (15)7.验证合格标准 (15)7.1判断标准 (15)7.2现场考察试验合格标准 (15)8. 再验证周期 (15)附录 (16)附录一验证方案会审记录 (16)附录二验证方案修改申请及批准书 (17)附录三漏项和偏差处理记录 (18)附录四悬液法定量杀灭试验记录 (19)附录五消毒剂对佩戴手套后人员手现场试验记录 (22)1.概述1.1 消毒剂消毒剂的作用原理:破坏细胞膜类,阻断细胞食物摄取和废物排泄,钝化关键酶。
以下是几种常用的消毒剂:(1)新洁尔灭(苯扎溴铵):是一种常用的季铵盐类消毒剂,在浓度较低时即可有抑菌的作用;当浓度较高时,可以杀灭多种细菌繁殖体和部分的病毒,但是不能杀灭细菌芽孢,属于低效消毒剂。
(2)75%乙醇:适用于一般物体表面消毒以及手和皮肤的消毒,它无法杀灭细菌芽孢和病毒。
(3)优洁:属于长效、强效、广谱杀菌剂,是一种新型消毒剂,其有效成分为复合季铵盐和六亚甲基四胺,可有效快速地杀灭细菌繁殖体、芽孢、真菌和部分病毒等,各种微生物对其均无抗药性,抑菌时间较长,可用于一般物体表面消毒,稳定性好,无腐蚀性,无毒无害,并且由于杀菌时不受蛋白质及有机物的干扰,故使用衰减周期长,可循环使用,相对使用成本低。
消毒剂检验报告引言消毒剂是一种常用的清洁产品,用于杀灭病菌和细菌,保持环境的清洁和卫生。
本文档旨在对某款消毒剂进行检验分析,评估其杀菌效果、化学成分和安全性。
检验目的本次检验的目标是对该款消毒剂的以下几个方面进行评估: - 杀菌效果:通过对特定病菌进行检验,评估消毒剂的杀菌效果。
- 化学成分:分析消毒剂的化学成分,并确保符合相关标准。
- 安全性:评估消毒剂对人体和环境的安全性。
方法和步骤在本次检验中,我们采用了以下方法和步骤:1.杀菌效果测试–选取常见病菌,并制备相应的培养基。
–将消毒剂与含有病菌的培养基接触,并按照指定时间进行培养。
–统计培养后存活的病菌数量,并与对照组进行对比。
2.化学成分分析–采用色谱、质谱等方法对消毒剂进行化学成分分析。
–确定主要成分及其浓度,并与相关标准进行对比。
3.安全性评估–对消毒剂进行毒性测试,包括对小鼠的急性毒性和皮肤刺激性测试。
–评估消毒剂对环境的影响,包括生物降解性和对水质的影响。
检验结果杀菌效果测试结果根据我们的检验结果,该款消毒剂对常见病菌的杀灭效果非常显著。
在指定的接触时间内,消毒剂成功杀灭了高达95%以上的病菌。
化学成分分析结果通过色谱和质谱分析,我们确认了消毒剂的主要成分及其浓度。
该款消毒剂主要由酒精、过氧化物类物质和界面活性剂组成。
根据相关标准,消毒剂的化学成分符合规定要求。
安全性评估结果消毒剂的毒性测试结果显示,该款消毒剂在指定剂量下对小鼠没有明显的急性毒性反应。
皮肤刺激性测试结果也显示该款消毒剂不会引起明显的刺激。
此外,消毒剂的生物降解性良好,对水质的影响较小。
结论综合以上检验结果,我们可以得出以下结论: - 该款消毒剂具有良好的杀菌效果,能有效杀灭常见病菌。
- 消毒剂的化学成分符合相关标准,并不存在有害物质。
- 消毒剂对人体和环境的安全性良好,不会对健康和环境造成明显的影响。
建议基于本次检验结果,我们建议使用消毒剂时遵循以下几点: 1. 在使用消毒剂前,请确保阅读产品说明,并按照指定用量和使用方法使用。
消毒剂消毒效果得验证组长:***组员:*** ****** ****** ****** ******编号: 2版次: 2014 年第 1 版目录1.概述 (3)1、1消毒剂 (3)1、2消毒剂使用说明 (3)2.验证目得 (3)3.验证内容 (4)4.验证组织 (4)4、1验证小组 (4)4、2验证委员会 (4)5.验证实施步骤 (5)5、1验证前准备 (5)5、2验证所需文件资料 (5)5、3悬液法定量杀灭试验 (6)5、4对裸手消毒效果试验 (7)5、5消毒剂对佩戴手套后得消毒效果验证 (9)5、6消毒剂对物体表面消毒效果验证 (11)5、7消毒剂消毒效果验证结论 (15)6.验证主要依据 (15)7.验证合格标准 (15)7、1判断标准 (15)7、2现场考察试验合格标准 (15)8、再验证周期 (15)附录 (16)附录一验证方案会审记录 (16)附录二验证方案修改申请及批准书 (17)附录三漏项与偏差处理记录 (18)附录四悬液法定量杀灭试验记录 (19)附录五消毒剂对佩戴手套后人员手现场试验记录 (22)1.概述1、1 消毒剂消毒剂得作用原理:破坏细胞膜类,阻断细胞食物摄取与废物排泄,钝化关键酶。
以下就是几种常用得消毒剂:(1)新洁尔灭(苯扎溴铵):就是一种常用得季铵盐类消毒剂,在浓度较低时即可有抑菌得作用;当浓度较高时,可以杀灭多种细菌繁殖体与部分得病毒,但就是不能杀灭细菌芽孢,属于低效消毒剂。
(2)75%乙醇:适用于一般物体表面消毒以及手与皮肤得消毒,它无法杀灭细菌芽孢与病毒。
(3)优洁:属于长效、强效、广谱杀菌剂,就是一种新型消毒剂,其有效成分为复合季铵盐与六亚甲基四胺,可有效快速地杀灭细菌繁殖体、芽孢、真菌与部分病毒等,各种微生物对其均无抗药性,抑菌时间较长,可用于一般物体表面消毒,稳定性好,无腐蚀性,无毒无害,并且由于杀菌时不受蛋白质及有机物得干扰,故使用衰减周期长,可循环使用,相对使用成本低。
样品受理编号: 第1页/共9页被监测单位 采样单位 采样人 检测项目 医院**省卫生监督所、**省疾病预防控制中心医院消毒效果监测采样日期 送样日期 检毕日期 2008年 10月15日2008年 10月15日2008年 10月22日检验依据 《消毒技术规范》2002年版、医院消毒卫生标准GB15982-1995、消毒与灭菌效果的评价方法与标准GB15981-1995、医疗机构污水排放要求GB18466-2005、《内镜清洗消毒技术操作规范(2004年版)》检验结论:1. 经检测: 医院除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。
2. 经检测: 医院受检的物体表面消毒效果监测结果符合GB15982-1995的规定。
3. 经检测: 医院受检的使用中消毒液监测结果符合GB15982-1995的规定。
4. 经检测: 医院受检的医护人员手消毒效果监测结果均符合GB15982-1995的规定。
5. 经检测: 医院受检的医院污水消毒效果监测结果符合GB18466-2005的规定。
6. 经检测: 医院受检的脉动预真空高压蒸汽灭菌器灭菌效果监测结果符合GB15981-1995的规定。
7. 经检测: 医院受检的新医科2.5寸银针、新医科1.5寸银针、口腔门诊手机头、口腔门诊车针的灭菌效果监测结果符合GB15982-1995的规定。
8. 经检测: 医院受检的消化内科胃镜(2522315)、支纤镜(25027)、肠镜(2710832)的消毒效果监测结果符合《内镜清洗消毒技术操作规范(2004年版)》的规定。
**省疾病预防控制中心检 验 报 告以下空白样品受理编号: 第1页/共9页 被监测单位 采样单位 采样人 检测项目 医院湖南省卫生监督所、湖南省疾病预防控制中心医院消毒效果监测采样日期 送样日期 检毕日期 2008年 10月15日 2008年 10月15日2008年 10月22日检验依据 《消毒技术规范》2002年版、医院消毒卫生标准GB15982-1995、消毒与灭菌效果的评价方法与标准GB15981-1995、医疗机构污水排放要求GB18466-2005、《内镜清洗消毒技术操作规范(2004年版)》检验结论:1. 经检测: 医院除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。
样品受理编号: 第1页/共9页被监测单位 采样单位 采样人 检测项目 医院**省卫生监督所、**省疾病预防控制中心医院消毒效果监测采样日期 送样日期 检毕日期 2008年 10月15日 2008年 10月15日 2008年 10月22日检验依据 《消毒技术规范》2002年版、医院消毒卫生标准GB15982-1995、消毒与灭菌效果的评价方法与标准GB15981-1995、医疗机构污水排放要求GB18466-2005、《内镜清洗消毒技术操作规范(2004年版)》检验结论:1. 经检测: 医院除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。
2. 经检测: 医院受检的物体表面消毒效果监测结果符合GB15982-1995的规定。
3. 经检测: 医院受检的使用中消毒液监测结果符合GB15982-1995的规定。
4. 经检测: 医院受检的医护人员手消毒效果监测结果均符合GB15982-1995的规定。
5. 经检测: 医院受检的医院污水消毒效果监测结果符合GB18466-2005的规定。
6. 经检测: 医院受检的脉动预真空高压蒸汽灭菌器灭菌效果监测结果符合GB15981-1995的规定。
7. 经检测: 医院受检的新医科寸银针、新医科寸银针、口腔门诊手机头、口腔门诊车针的灭菌效果监测结果符合GB15982-1995的规定。
8. 经检测: 医院受检的消化内科胃镜(2522315)、支纤镜(25027)、肠镜(2710832)的消毒效果监测结果符合《内镜清洗消毒技术操作规范(2004年版)》的规定。
以下空白**省疾病预防控制中心检 验 报 告样品受理编号: 第1页/共9页 被监测单位 采样单位 采样人 检测项目 医院湖南省卫生监督所、湖南省疾病预防控制中心医院消毒效果监测采样日期 送样日期 检毕日期 2008年 10月15日2008年 10月15日 2008年 10月22日检验依据 《消毒技术规范》2002年版、医院消毒卫生标准GB15982-1995、消毒与灭菌效果的评价方法与标准GB15981-1995、医疗机构污水排放要求GB18466-2005、《内镜清洗消毒技术操作规范(2004年版)》检验结论:1. 经检测: 医院除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。
2. 经检测: 医院受检的物体表面消毒效果监测结果符合GB15982-1995的规定。
3. 经检测: 医院受检的使用中消毒液监测结果符合GB15982-1995的规定。
4. 经检测: 医院受检的医护人员手消毒效果监测结果均符合GB15982-1995的规定。
5. 经检测: 医院受检的医院污水消毒效果监测结果符合GB18466-2005的规定。
6. 经检测: 医院受检的脉动预真空高压蒸汽灭菌器灭菌效果监测结果符合GB15981-1995的规定。
7. 经检测: 医院受检的新医科寸银针、新医科寸银针、口腔门诊手机头、口腔门诊车针的灭菌效果监测结果符合GB15982-1995的规定。
8. 经检测: 医院受检的消化内科胃镜(2522315)、支纤镜(25027)、肠镜(2710832)签 发 人: 检验机构 最终审核日期:2008年11月07日 盖章**省疾病预防控制中心检 验 报 告的消毒效果监测结果符合《内镜清洗消毒技术操作规范(2004年版)》的规定。
以下空白样品受理编号: 第2页/共9页医院名称: 医院 检验项目:空气消毒效果监测 收样日期:2008年 10月15日 检 毕 日 期 :2008年 10月17日一、器 材1. 仪器设备名称与型号:LRH-150生化培养箱。
2. 局部100级空气洁净实验室。
3. 普通营养琼脂等培养基。
二、方 法检测依据:《消毒技术规范》2002版(3.17.8)。
三、结 果表1 空气消毒效果监测结果采样地点检 测 结 果细菌菌落总数cfu /m3致病菌 国 家 标 准细菌菌落总数cfu /m 3致病菌267 未检出 Ⅰ类环境:≤10 不得检出157 未检出 Ⅱ类环境:≤200 47 未检出 Ⅲ类环境:≤50047未检出湖南省疾病预防控制中心 检 验 报 告 检验人: 检验机构 校核人: (盖章)签发人: 2008年11月07日**省疾病预防控制中心检 验报 告267 未检出 未检出 未检出 157 未检出 47 未检出110 未检出 四十二病室治疗室 110 未检出一病室治疗室 157 未检出急诊科监护室518未检出注:致病菌指金黄色葡萄球菌、溶血性链球菌和铜绿假单胞菌。
四、结 论经检测: 医院受检的空气除20手术间、15手术间、急诊科监护室外,其余受检空气消毒效果监测结果符合GB15982-1995的规定。
以下空白样品受理编号: 第3页/共9页医院名称: 医院 检验项目:物体表面消毒效果监测 收样日期:2008年10月15日 检 毕 日 期 :2008年10月17日一、器 材1. 仪器设备名称与型号:LRH-150生化培养箱。
2. 试验器材:无菌器材(5cm ×5cm 规格板、棉拭子、刻度吸管等)。
3. 局部100级空气洁净实验室。
4. 普通营养琼脂等培养基、磷酸盐缓冲液、无菌生理盐水。
二、方 法**省疾病预防控制中心检 验 报 告检测依据:《消毒技术规范》2002版(3.17.7)。
三、结果表2 物体表面消毒效果监测结果样品名称检测结果细菌菌落总数cfu/cm2 致病菌国家标准细菌菌落总数cfu/cm2 致病菌未检出Ⅰ类环境:≤5不得检出未检出Ⅱ类环境:≤5未检出未检出Ⅲ类环境:≤10未检出未检出Ⅳ类环境:≤15ICU治疗室操作台未检出未检出注:致病菌指金黄色葡萄球菌、沙门氏菌和溶血性链球菌。
四、结论经检测:医院受检物体表面消毒效果监测结果符合GB15982-1995的规定。
以下空白样品受理编号:第4页/共9页医院名称:医院检验项目:使用中消毒液监测收样日期:2008年 10月15日检毕日期:2008年 10月17日一、器材**省疾病预防控制中心检验报告1. 仪器设备名称与型号:LRH-150生化培养箱。
2. 试验器材:无菌器材(平皿、刻度吸管等)。
3. 相应的中和剂。
4. 普通营养琼脂等培养基、磷酸盐缓冲液、无菌生理盐水。
5. 局部100级空气洁净实验室。
二、方 法检测依据:《消毒技术规范》2002版(3.17.9.2)。
三、结 果表3 使用中消毒液监测结果样品名称检 测 结 果细菌菌落总数cfu /ml致病菌国 家 标 准未检出 未检出 使用中消毒液:细菌菌落总数≤100 cfu /ml致病菌不得检出无菌器械保存液:必须无菌未检出 未检出 未检出 未检出 未检出 未检出未检出 未检出 感染科75%酒精未检出未检出注:致病菌指金黄色葡萄球菌、溶血性链球菌、铜绿假单胞菌。
四、结 论经检测: 医院受检的使用中消毒液监测结果符合GB15982-1995的规定。
以下空白**省疾病预防控制中心检 验 报 告样品受理编号:第5页/共9页医院名称:医院检验项目:医护人员手消毒效果监测收样日期:2008年 10月15日检毕日期:2008年 10月17日一、器材1.仪器设备名称与型号: LRH-150生化培养箱。
2.试验器材:无菌器材(平皿、棉拭子、刻度吸管等)。
3.相应的中和剂。
4.普通营养琼脂等培养基、磷酸盐缓冲液、无菌生理盐水。
5.局部100级空气洁净实验室。
二、方法检测依据:《消毒技术规范》2002版(3.17.6)。
三、结果表4 医护人员手消毒效果监测结果被采样人姓名及科室检测结果细菌菌落总数cfu/cm2 致病菌国家标准细菌菌落总数cfu/cm2 致病菌未检出未检出Ⅰ类环境:≤5不得检出未检出未检出Ⅱ类环境:≤5未检出未检出Ⅲ类环境:≤10手术室护士刘秋秋未检出未检出Ⅳ类环境:≤15注:致病菌指金黄色葡萄球菌、溶血性链球菌、沙门氏菌。
四、结论经检测:医院受检的医护人员手消毒效果监测结果均符合GB15982-1995的规定。
以下空白样品受理编号: 第6页/共9页医院名称: 医院 检验项目:医院污水监测 收样日期:2008年 10月15日 检 毕 日 期 :2008年 10月17日一、器 材1. 余氯比色测定计。
2. 仪器设备名称与型号:PYX-DHS-40×50隔水式培养箱。
3. 试验器材:无菌器材(刻度吸管等)。
4. 局部100级空气洁净实验室。
5. 普通营养琼脂等培养基、无菌蒸馏水、乳糖蛋白胨培养液等。
二、方 法检测依据:GB18466-2005.附录A 4、B 4、C 4。
三、结 果表5 医院污水消毒效果监测结果采样地点总余氯〔mg /L 〕粪大肠菌群(MPN /L )肠道致病菌国家标准参照GB18466-2005: 综合性医疗机构,粪大肠菌群≤500 MPN /L ,总余氯 ≥ mg /L ,肠道致病菌不得检出。
污水排放口≤500未检出**省疾病预防控制中心检 验 报 告注:肠道致病菌指沙门氏菌、志贺氏菌。
四、结 论经检测: 医院受检的医院污水消毒效果监测结果符合GB18466-2005的规定。
以下空白样品受理编号: 第7页/共9页医院名称: 医院 检验项目:压力蒸汽灭菌效果监测 收样日期:2008年 10月15日 检 毕 日 期 :2008年 10月22日一、器 材1. 待检样品:脉动预真空高压蒸汽灭菌器。
2. 仪器设备名称与型号:LRH-150B 生化培养箱。
3. 试验器材:无菌器材(刻度吸管等)。
4. 指示菌株:嗜热脂肪杆菌芽胞菌片ATCC 7953,批号为。
5. 溴甲酚紫蛋白胨水培养基。
6. 局部100级空气洁净实验室。
二、方 法检测依据:《消毒技术规范》2002版(3.17.2)。
三、结 果表6 脉动预真空高压蒸汽灭菌器灭菌效果监测结果锅次(号) 检测结果 国家标准1锅次阴性每个指示菌片接种的溴甲酚紫蛋白胨水培**省疾病预防控制中心检 验 报 告2锅次 阴性养基全部不变色,判定为灭菌合格。
注:阳性对照和阴性对照成立。
四、结 论经检测: 医院受检的脉动预真空高压蒸汽灭菌器灭菌效果监测结果符合GB15981-1995的规定。
以下空白样品受理编号: 第8页/共9页样品名称:新医科寸银针、新医科寸银针、口腔门诊手机头、口腔门诊车针收样日期:2008年 10月15日 检 毕 日 期 :2008年 10月22日检验项目: 无菌试验 一、器 材1. 待检样品:新医科寸银针、新医科寸银针、口腔门诊手机头、口腔门诊车针。
2. 仪器设备名称与型号:LRH-150生化培养箱、MJ-Ⅱ霉菌培养箱。
3. 试验器材:无菌器材(医用剪、平皿、医用镊子等)。