过渡元素
- 格式:ppt
- 大小:599.00 KB
- 文档页数:56



过渡元素(一)(一) 过渡元素通性过渡元素一般是指原子的电子层结构中d轨道或f轨道仅部分填充的元素。
d区元素价电子构型为(n-1)d1~8ns1~2 (Pd 4d10和Pt 5d96s1例外), 最外两层电子均未填满。
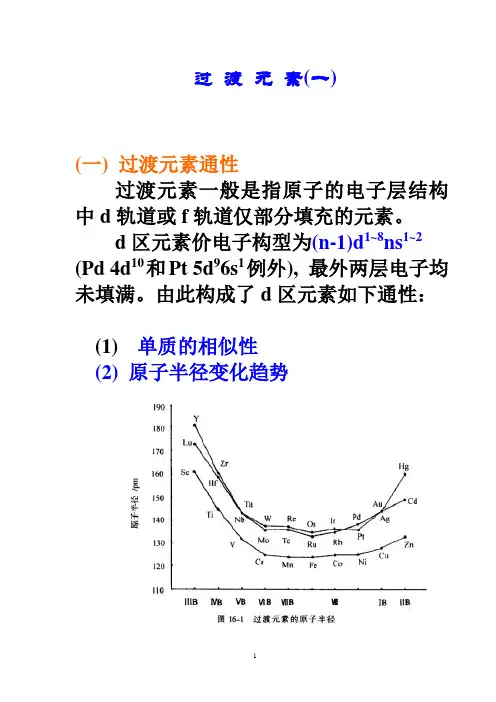
由此构成了d区元素如下通性:(1)单质的相似性(2) 原子半径变化趋势(3) 有可变氧化态例1对同一族元素来说,随周期数增加,为什么主族元素低氧化态趋于稳定而过渡元素高氧化态趋于稳定?例如,处于同一纵列的Ni和Pt,前四个电离能为I1+I2/kJ·mol-1I1+I2/kJ·mol-1Ni 2.49 8.69Pt 2.66 6.70(3) 过渡元素的氧化物及氢氧化物的性质(4) 容易形成配合物(5)配离子大多有颜色d-d跃迁MnO4-、CrO42-、VO43-等:荷移跃迁(6) 具有磁性和催化性能例2Ziegler-Natta 催化剂(6)间充化合物如r.t.下用Pd吸收H2所得氢化钯中,氢的最大含量可达PdH0.8,其他如LaH-,CeH2.69等(为原子数比值)。
这种化2.76合物仍保持金属结构特征,其间除金属键外,还存在金属和B、C、N、H等的共价键。
(二) 几种晶格类型1.钙钛矿具有边长为3.84 Å的立方晶胞,Ca、Ti和O 原子分别处在它的顶角、体心和面心的位置上。
i)给出钙钛矿的化学计量式。
ii)计算晶体密度。
iii)描述三种离子的配位情况。
(ⅰ) CaTiO3(ⅱ) ρ= 3.99 g·cm―3(ⅲ) Ca2+12个O2―围绕12面体Ti(IV) 6个O2―围绕八面体O2―2个Ti4+和4个Ca2+围绕八面体2.Fe3O4的结构:反式尖晶石结构尖晶石的通式M II M2III O4常式尖晶石中,M II占据四面体位置,M III占据八面体位置反式尖晶石中,一半M III占据四面体位置,另一半M III和M II占据八面体位置,所以Fe3O4的结构可表示为[Fe III]t[Fe II Fe III]o O4其电导是Fe2O3的106倍例尖晶石是一种金属氧化物M3O4,它的氧离子接近于按密堆积排列。






第十三章过渡元素13-1 过渡元素概述广义的过渡元素是指长式周期表中从ⅢB族到ⅡB的所有元素。
它们在长式周期表中位于s区元素和p区元素之间,因而称为过渡元素。
过渡元素单质都是金属,共分为四个系列。
第一过渡系:Sc→Zn;第二过渡系Y →Cd ;第三过渡系Lu →Hg;第四过渡系Lr→Uub。
13-1-1 过渡元素原子的特征一、价层电子构型为n-1)d1-10n s1-2。
二、原子半径变化规律1.过渡元素原子半径一般比同周期主族元素小2.同一周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
3.同族元素从上往下原子半径增大,但五、六周期(除ⅢB)外由于镧系收缩使其同族元素原子半径十分接近,导致其元素性质相似。
13-1-2 单质的物理性质1.过渡金属外观多呈银白色或灰白色,有光泽。
2. 除钪和钛属轻金属外,其余均属重金属。
3.数过渡金属(ⅡB族元素除外)的熔点、沸点高,硬度大。
13-1-3 金属活泼性过渡金属在水溶液中的活泼性,可根据标准电极电势来判断。
1.第一过渡系金属,除铜外,Eθ(M2+/M)均为负值,其金属单质可从非氧化性酸中置换出氢。
2. 同一周期元素从左向右过渡,总的变化趋势是Eθ(M2+/M)值逐渐变大,其活泼性逐渐减弱。
3.同族元素(除Sc分族外)自上往下金属活泼性降低。
13-1-4 氧化数过渡元素除最外层s电子可以成键外,次外层d电子也可以部分或全部参加成键,所以过渡元素的特征之一是具有多种氧化数。
1.期从左到右,元素最高氧化数升高, ⅦB后又降低。
2.从上往下,高氧化数化合物稳定性增加3.过渡元素可形成氧化数为0、-1、-2、-3的化合物.13-1-5 非整比化合物过渡元素的另一个特点是易形成非整比(或称非化学计量)化合物。
13-1-6 化合物的颜色过渡元素所形成的配离子大都显色,这主要与过渡元素离子的d轨道未填满电子有关。
其中d0、d10构型的离子无色。
13-1-7 配合性和催化性一、元素容易形成配合物。