过渡元素
- 格式:doc
- 大小:78.50 KB
- 文档页数:3



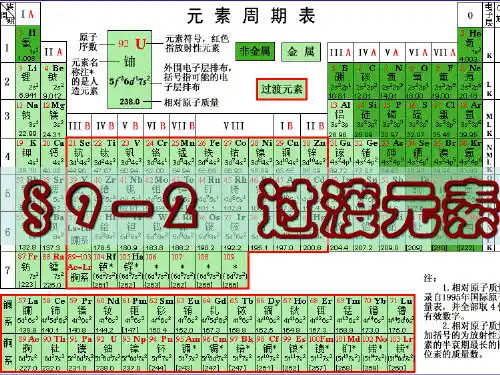
第53节 过渡元素简介一、过渡元素简介过渡元素在元素周期表中的位置和外围电子层排布从元素周期表上可以看到,表的中部从ⅢB 族到ⅢB 族10个纵行,包括镧系和锕系,共有63种元素,这些元素包括了第VI 族和全部副族元素,人们习惯上把它们叫做过渡元素。
过渡元素的价层电子构型为1~101~2(1)ds n n (Pd 为0ns )。
在元素周期表中,它们处于s 区元素和p 区元素之间。
从性质上看,s 区元素的单质均为活泼元素,形成的化合物以离子型为主,其氧化数单一,离子没有颜色;p 区元素只有部分是金属元素,形成的化合物多为共价型,含有多种氧化数;d 区介于s 区和p 区之间。
因此,人们又称d 区元素为过渡元素。
它们分属于第四周期到第七周期,如图11-1所示过渡元素原子的电子层排布有共同的特征。
从图中可以看出,它们的最外电子层上都有1~2个s 电子(Pd 除外),随着原子序数的递增,增加的电子大多填充在次外层的d 轨道上其中镧系和锕系元素的原子,增加的电子主要填充在倒数第三层的f 轨道上,少数填充在次外层的d 轨道上。
过渡元素原子的外围电子层排布反映了它不同于主族元素原子的核外电子排布的特征。
例如,钪(Sc )的外围电子层排布为3d4s2,铀(U )的外围电子层排布为5f6d7s2。
过渡元素的许多性质,都跟它们的外围电子层排布有关。
二、过渡元素的通性过渡元素原子的最外层一般只有1~2个电子,在化学反应中较易失去,故它们都是金属元素。
相对于主族元素而言,过渡元素的特性及其性质变化规律主要表现在以下几个方面1.单质的物理性质过渡元素的单质有些是高熔点、高沸点、密度大、硬度大、导电和导热性良好的金属。
在金属元素中,熔点最高的是钨,密度最大的是锇,硬度最大的是铬。
例如:铂的密度是21.45g/cm 3,约是铝的8倍;钨的熔点是3410Ⅲ,是所有金属中最难熔的。
造成这些特性的原因是过渡元素的单质因原子半径小,采取最紧密堆积,原子之间除了有电子外,还用部分d电子参与成键,在金属键之外有部分共价键,因此结合牢固。



过渡元素化学知识点总结过渡元素具有以下特点:1. 电子结构:过渡元素的电子结构特点主要是d轨道的填充,使得它们的化学性质发生变化。
具体来说,过渡元素通常有一个未填满的d轨道,这使得它们的化学性质具有多样性和复杂性。
2. 氧化态:过渡元素通常能够显示多种氧化态,这与其未填满的d轨道有关。
例如,铁元素可以显示+2和+3的氧化态,铜元素可以显示+1和+2的氧化态,这种性质使过渡元素在形成化合物时具有很大的灵活性。
3. 彩色化合物:由于过渡元素的未填满的d轨道和多重氧化态,它们通常能形成彩色的化合物。
这些彩色化合物在生活中有很多应用,比如颜料、染料、陶瓷等,彩色化合物也是化学研究和实验室实验中的常见物质。
4. 催化性质:过渡元素在催化反应中起着重要的作用。
由于其不规则的电子填充和氧化态变化,使得其化合物在催化反应中具有活性和选择性。
比如钯、铑、铂等催化剂在工业上有重要的应用,如有机合成、汽车尾气处理等领域。
5. 锂离子电池:锂离子电池作为一种重要的储能装置,过渡元素在其中起着关键作用。
比如正极材料主要由过渡金属氧化物和磷酸盐组成,其中含有镍、钴、锰等过渡元素,它们的电化学性能决定了电池的容量和循环寿命。
6. 过渡金属配合物:过渡元素通常能够形成配合物,即与配体形成稳定的化合物。
这些配合物具有多种性质,如颜色、磁性、光谱性质等,具有多样的应用。
比如金刚石、钟亭草碱等药物中都含有过渡金属配合物。
过渡元素化学知识点总结:1. 电子结构:过渡元素的电子结构特点是d轨道的填充,未填满的d轨道决定了过渡元素的化学性质的复杂性和多样性。
2. 氧化态:过渡元素通常能够显示多种氧化态,这与其未填满的d轨道有关,使得过渡元素具有很大的化学活性和灵活性。
3. 彩色化合物:过渡元素的多重氧化态和未填满的d轨道使得其形成的化合物通常具有彩色,这些彩色化合物在生活中有很多应用。
4. 催化性质:过渡元素在催化反应中有重要的应用,其化合物在催化反应中具有活性和选择性。



化学元素周期表中的过渡元素练习题1. 请列出元素周期表中的过渡元素。
元素周期表中的过渡元素包括:第4周期:钒(V)、铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)、镍(Ni)、铜(Cu)第5周期:铝(Al)、锌(Zn)、镓(Ga)、镉(Cd)、铟(In)、锡(Sn)、锑(Sb)、铊(Tl)第6周期:铱(Ir)、铂(Pt)、金(Au)第7周期:汞(Hg)2. 过渡元素的电子排布如何?过渡元素的电子排布遵循以下规则:- 相对于主族元素,过渡元素的d轨道开始填充电子。
这导致过渡元素具有更多可能的氧化态,因为它们可以丢失或获得不仅仅是最外层的电子,而是d轨道中的电子。
- 过渡元素的电子排布一般遵循(Ar)4s^2 3d^n的模式,其中n为d轨道中的电子数。
这个模式保证了过渡元素中d轨道的填充顺序。
3. 过渡元素的化学性质有哪些特点?过渡元素具有以下化学性质的特点:- 过渡元素可以形成多种氧化态。
这是由于过渡元素的d轨道相对较稳定,允许容纳不同数量的电子。
因此,过渡元素可以形成不同的离子,具有不同的氧化态。
- 过渡元素可以形成配合物。
过渡元素的d轨道提供了额外的空间,可以与其他分子或离子形成配位化合物。
这些配位化合物具有独特的性质和应用。
- 过渡元素具有良好的催化性能。
过渡元素的d轨道和可变的氧化态使其在许多催化反应中起到关键作用。
许多工业催化反应和生物催化反应都涉及过渡元素。
4. 过渡元素在生活中的应用有哪些?过渡元素在生活中有广泛的应用,包括:- 铁(Fe)是人类最早使用的金属之一,广泛用于建筑、制造、工业等领域。
- 铜(Cu)被用于制作导线、管道和各种电子设备,因为它是良好的导电材料。
- 锌(Zn)常用于锌-碳电池和热镀锌等领域。
- 铬(Cr)用于制作不锈钢,使其具有抗腐蚀性能。
- 钼(Mo)广泛应用于合金制造、催化剂和电子器件中。
- 钛(Ti)因其强度和耐腐蚀性,被广泛应用于航空航天、医疗器械等高科技领域。
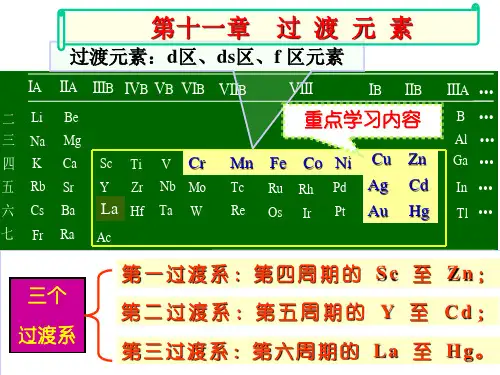
第十三章过渡元素13-1 过渡元素概述广义的过渡元素是指长式周期表中从ⅢB族到ⅡB的所有元素。
它们在长式周期表中位于s区元素和p区元素之间,因而称为过渡元素。
过渡元素单质都是金属,共分为四个系列。
第一过渡系:Sc→Zn;第二过渡系Y →Cd ;第三过渡系Lu →Hg;第四过渡系Lr→Uub。
13-1-1 过渡元素原子的特征一、价层电子构型为n-1)d1-10n s1-2。
二、原子半径变化规律1.过渡元素原子半径一般比同周期主族元素小2.同一周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
3.同族元素从上往下原子半径增大,但五、六周期(除ⅢB)外由于镧系收缩使其同族元素原子半径十分接近,导致其元素性质相似。
13-1-2 单质的物理性质1.过渡金属外观多呈银白色或灰白色,有光泽。
2. 除钪和钛属轻金属外,其余均属重金属。
3.数过渡金属(ⅡB族元素除外)的熔点、沸点高,硬度大。
13-1-3 金属活泼性过渡金属在水溶液中的活泼性,可根据标准电极电势来判断。
1.第一过渡系金属,除铜外,Eθ(M2+/M)均为负值,其金属单质可从非氧化性酸中置换出氢。
2. 同一周期元素从左向右过渡,总的变化趋势是Eθ(M2+/M)值逐渐变大,其活泼性逐渐减弱。
3.同族元素(除Sc分族外)自上往下金属活泼性降低。
13-1-4 氧化数过渡元素除最外层s电子可以成键外,次外层d电子也可以部分或全部参加成键,所以过渡元素的特征之一是具有多种氧化数。
1.期从左到右,元素最高氧化数升高, ⅦB后又降低。
2.从上往下,高氧化数化合物稳定性增加3.过渡元素可形成氧化数为0、-1、-2、-3的化合物.13-1-5 非整比化合物过渡元素的另一个特点是易形成非整比(或称非化学计量)化合物。
13-1-6 化合物的颜色过渡元素所形成的配离子大都显色,这主要与过渡元素离子的d轨道未填满电子有关。
其中d0、d10构型的离子无色。
13-1-7 配合性和催化性一、元素容易形成配合物。
元素周期表中的过渡元素特点过渡元素是元素周期表中的一类元素,位于周期表的d区。
它们的特点使得它们在化学反应中扮演着重要的角色。
本文将介绍过渡元素的共同特点和其在化学中的应用。
一、外层电子结构过渡元素的外层电子结构特点是它们的d轨道不断填充。
这些元素的原子结构允许它们有多个不同价态,即能够形成多种不同电荷状态的离子。
这是因为d轨道相对于s和p轨道,具有较高的能量。
由于具备这种特性,过渡元素能够参与更多的化学反应,并形成多种化合物。
二、多种氧化态过渡元素包含不同的氧化态,其过渡金属离子能够在溶液中自由转变。
这使得它们具有良好的催化性能。
例如,过渡金属催化剂在化学工业生产中扮演着重要的角色。
此外,这些多种氧化态还赋予了过渡元素化合物丰富的颜色。
许多过渡金属离子是有色的,例如铜离子呈现蓝绿色,铁离子呈现黄色等。
三、良好的热和电导性过渡元素具有良好的热和电导性能。
这主要归因于它们d轨道中的自由电子。
这些自由电子能够快速地传递热和电能。
这种性质使得过渡元素在电子学和热学领域有着广泛的应用。
例如,铜和银等过渡金属被广泛应用在电路和导线中,用于传输电能。
四、形成强稳配合物过渡金属离子能够形成稳定的配合物。
这是由于d轨道的空余能级,使得它们能够与配体形成配位键。
许多过渡金属配合物在生物学、医学以及工业上都有重要的应用。
例如,铂配合物常作为抗癌药物使用,铁配合物在生物体内嵌入血红蛋白的中心。
五、磁性与铁磁性过渡元素中的一些元素具有磁性。
这是由于过渡元素中的电子自旋和轨道角动量之间的相互作用。
这些元素中的电子会同时填充相同自旋的轨道,使得整个原子中存在相对磁矩。
这使得过渡元素在磁学领域有着重要的应用。
例如,铁、钴、镍等元素被广泛地用于制造磁体和磁性材料。
结论过渡元素具有许多独特的特点,这些特点使它们在化学中扮演着重要的角色。
它们的多种氧化态、良好的热和电导性、形成稳定配合物以及磁性等性质,使得它们被广泛应用于不同的领域,包括电子学、磁学、药学等。
1、 下列氢氧化物中具有两性的是(A )
(A) Cr(OH)3 (B) Fe(OH)3 (C) Ni(OH)2 (D) Mn(OH)2
2、下列氢氧化物中可溶于NaOH 溶液,又能溶于NH 3·H 2O 的是(D )
(A) Al(OH)3 (B) Bi(OH)3 (C) Ni(OH)2 (D) Zn(OH)2
3、CrCl 3溶液与下列物质作用时,即生成沉淀又生成气体的是(C )
(A) NH 3·H 2O (B) NaOH (C) Na 2CO 3 (D) 锌粉
4、能使酸性KMnO 4溶液褪色的试剂有(B )
(A) Fe(NO 3)3 (B) NaNO 2 (C) Na 2CO 3 (D) Na 2SO 4
5、下列氢氧化物溶于浓HCl 的反应不仅仅是酸碱反应的是(D )
(A) Fe(OH)3 (B) Cr(OH)3 (C) Mn(OH)2 (D) Co(OH)3
6、K 2Cr 2O 7溶液与下列试剂反应,没有沉淀生成的是(B )
(A) H 2S (B) H 2O 2 (C) KI (D) AgNO 3
7、下列试剂中,不能与FeCl 3溶液反应的是(D )
(A) Fe (B) Cu (C) KI (D) SnCl 4
8、下列各组物质能用NaOH 分离的有(D )
(A) Zn 2+,Cu 2+ (B) Mn 2+,Ni 2+ (C) Pb 2+,Cr
3+ (D) Zn 2+,Mg 2+
9、下列各组物质能用NH 3·H 2O 分离的有(C )
(A) Zn 2+,Cu 2+ (B) Co 2+,Ni 2+ (C) Cu 2+,Al 3+ (D) Mn 2+,Fe 3+
10、下列各组离子能够共存的是(B D )
(A)2N O -,4M nO - (B)227C r O -24C rO - (C) Fe 3+,I - (D) Cr 3+,Fe 2+ 11、锰的下列物种中,在酸性溶液中发生歧化反应的是(A C )
(A) 24M nO - (B) MnO 2 (C) Mn 3+ (D) Mn 2+
12、下列物质不易被空气中O 2氧化的是(B )
(A) Mn(OH)2 (B) Ni(OH)2 (C) [Co(NH 3)6]2+ (D) [Cu(NH 3)2]+
13、下列各组金属与相应的盐可以反应的是(A D )
(A) Fe 与Fe 3+ (B) Cu 与Cu 2+ (C) Zn 与Zn 2+ (D) Sn 与Sn 4+
14、欲使软锰矿(MnO 2)转变为K 2MnO 4应选择的试剂是 (A )
(A) KClO 3(s) + KOH(s) (B) 浓HNO 3 (C)Cl 2 (D) O 2
15、仅用一种试剂,即可将Ag +, Hg 2+, Cr 3+, Fe 3+, Ni 2+五种离子区分开,这种试剂可选用 (C )
(A)Na 2S (B)H 2S (C)NaOH (D)NH 3•H 2O
16、Fe 3+离子具有的电子构型是 (A )
(A)3d 54s 0 (B)3d 64s 0 (C)3d 74s 0 (D)3d 44s 0
17、在CrCl 3和K 2Cr 2O 7溶液中加入过量NaOH 溶液,两者存在的主要形式分别是 (D)
(A)Cr(OH)3和227C r O - (B)4
()C r O H -和227C r O - (C)Cr(OH)3和24C rO - (D)4
()C r O H -和24C rO - 18、在钢样分析中,铬干扰测定时可加HClO 4蒸发除去铬,使铬变成易挥发的 (A )
(A)CrO 2Cl 2 (B)CrCl 3 (C)H 2Cr 2O 7 (D)Cr 2O 3
19、下列溶液中,在空气里既不易被氧化,也不易分解,且可用无色玻璃试剂瓶存放的是(D)
(A)硝酸银 (B)氢硫酸 (C)高锰酸钾 (D)硫酸铜
20、下列离子中,顺磁性最强的是 (D)
(A)Ni 2+ (B)V 2+ (C)Ti 3+ (D)Mn 2+
21、Al(III)和Cr(III)化学性质的不同点表现在 (A )
(A)形成络合物的能力 (B)形成复盐的能力
(C)盐类的水解性 (D)氢氧化物的两性
22、在硝酸介质中,欲使Mn 2+氧化为4M nO -
可加的氧化剂是 (B) (A)KClO 3 (B) (NH 4)2S 2O 8(Ag +催化) (C)K 4Cr 4O 7 (D)王水
23、在 FeCl 3与 KSCN 的混合液中加入过量 NaF ,其现象是 (B)
(A)产生沉淀 (B)变为无色 (C)颜色加深 (D)无变化
24、下列各组元素中,性质最相似的两个元素是 (B)
(A)Mg 和Al (B)Zr 和Hf (C)Ag 和Au (D)Fe 和Co
25、欲将K 2MnO 4转变为KMnO 4, 下列方法中可得到产率高、质量好的是 (C)
(A)CO 2通入碱性K 2MnO 4溶液 (B)用Cl 2 氧化K 2MnO 4溶液
(C)电解氧化K 2MnO 4溶液 (D)用 HAc 酸化K 2MnO 4
26、下列有关副族元素氧化态的说法中,欠妥的是 (C)
(A)副族元素在化合物中也可能出现负氧化态
(B)副族元素的最高氧化态在数值上不一定等于该元素的族数
(C)所有副族元素都有两种或两种以上的氧化态
(D)有些副族元素的最高氧化态可以超过其族数
27、下列离子中氧化性最强的是 (D)
(A) 36C oF - (B)336()C o N H + (C)36
()C o C N - (D)Co 3+ 28、在酸性K 2Cr 2O 7溶液中,加入Ag +离子,可生成(D)
(A) Ag 2O ↓ (B)AgOH ↓ (C)Ag 2Cr 2O 7↓ (D)Ag 2CrO 4↓
29、Ti 与热的浓盐酸反应,主要产物是 (B)
(A) TiCl 2 (B)TiCl 3 (C)TiCl 4 (D)TiOCl 2
30、下列物质不能大量在溶液中共存的是 (C )
(A) 36()F e C N -和OH - (B) 36()F e C N -和I - (C) 46()F e C N -和I 2 (D)Fe 3+
和Br - 31、波尔多液是由硫酸铜和石灰乳配成的农药乳液,它的有效成分是 (C)
(A)硫酸铜 (B)硫酸钙 (C)氢氧化钙 (D)碱式硫酸铜
32、将过量KCN 加入CuSO 4溶液中,其生成物是 (B)
(A) CuCN (B)34()C u C N - (C)Cu(CN)2 (D)24()C u C N -
33、考虑下面反应: AgCl(s) + 2223S O -(aq) →32232()Ag S O -(aq) + Cl -(aq) 在反应中起 Lewis 酸和 Lewis 碱作用的是 (D)
(A) AgCl 和3232()Ag S O - (B)AgCl 和223S O - (C)Ag + 和Cl - (D)Ag +和223S O -
34、将Cu(OH)2持续加热,最终的产物是 (C)
(A) CuO (B)Cu (C)Cu 2O (D)Cu(OH)2
35、能较好的解释[Cu(NH 3)4]2+是正方构型的理论是 (D)
(A) VSEPR (B)杂化轨道 (C)晶体场 (D)Jahn-Teller 效应
36、、加NH 3·H 2O 水于Hg 2Cl 2上,容易生成的是 (D)
(A) Hg(OH)2 (B) [Hg(NH 3)4]2+ (C) [Hg(NH 3)2]+ (D)HgNH 2Cl+Hg。