镁、铝、铁
- 格式:doc
- 大小:383.50 KB
- 文档页数:21

地壳中含量最多的金属元素地壳是构成地球表面的固体外壳,它由岩石、矿物和土壤组成。
而金属元素是地壳中的重要组成部分。
根据各种地质调查和研究的结果,地壳中含量最多的金属元素主要有铝、铁、钙、钠和镁。
第一,铝是地壳中含量最多的金属元素之一,其化学符号为Al。
铝广泛存在于地壳中的各种岩石和矿物中。
根据统计数据,地壳中约含有8%的铝元素。
铝是一种轻质金属,具有良好的导电性和导热性,因此在工业上有广泛的应用,如建筑材料、电子设备、飞机制造等。
第二,铁也是地壳中含量最多的金属元素之一,其化学符号为Fe。
铁主要存在于地壳的岩石中,尤其是铁矿石中。
据估计,铁在地壳中的含量大约为5%左右。
铁是一种重要的结构金属,广泛用于建筑和基础设施建设,如钢铁制造、桥梁建设、汽车制造等。
此外,铁还在生物体中扮演着重要角色,它是人体血红蛋白和肌肉中的成分之一第三,钙也是地壳中含量较多的金属元素之一,其化学符号为Ca。
钙主要存在于地壳中的矿石和岩石中,如石灰石、大理石等。
地壳中大约含有3%的钙元素。
钙在生物体中起着重要的作用,它是人体骨骼和牙齿的主要成分之一,同时也参与细胞信号传递和神经传导过程。
第四,钠也是地壳中常见的金属元素之一,其化学符号为Na。
钠广泛存在于地壳的岩石和矿石中,如盐矿、芒硝矿等。
地壳中约含有2.3%的钠元素。
钠是一种重要的离子,对于维持体液平衡、神经传导和肌肉收缩等生理过程起着重要作用。
第五,镁也是地壳中含量较多的金属元素之一,其化学符号为Mg。
镁主要存在于地壳的岩石和矿石中,如滑石、白云石等。
地壳中大约含有2.1%的镁元素。
镁是一种重要的结构金属,广泛用于制造飞机、汽车、摩托车等。
此外,镁也在生物体中具有重要作用,如是叶绿素的组成部分、参与细胞代谢等。
综上所述,根据各种地质调查和研究的结果,地壳中含量最多的金属元素主要有铝、铁、钙、钠和镁。
这些金属元素在地壳中的高含量对于地球的形成、构造和化学成分有重要影响,并对人类的工业生产和生物体的正常功能发挥着重要作用。

常见金属元素金属是一类重要的化学元素,具有良好的导电、导热、延展性和强度等特点。
常见金属元素包括铁、铜、铝、锌、镁和钛等。
下面将对这些金属元素进行介绍。
1. 铁(Fe)铁是一种重要的金属元素,也是地壳中含量最多的金属元素之一。
铁具有良好的延展性、导电性和磁性。
它在工业上广泛应用于制造钢铁、机械设备和建筑材料等领域。
2. 铜(Cu)铜是一种具有良好导电性和导热性的金属元素。
它的导电性仅次于银和金,被广泛应用于电子、电力和通信等领域。
此外,铜也被用于制造管道、电线、器具和硬币等。
3. 铝(Al)铝是一种轻质金属元素,具有良好的导热性和抗腐蚀性。
它广泛应用于航空航天、汽车制造和建筑等领域。
铝制品通常具有较高的强度和耐用性,同时也能够降低结构的重量。
4. 锌(Zn)锌是一种常见的金属元素,具有良好的耐蚀性。
它常用于制造电池、镀锌钢板和合金等。
此外,锌也是维持生物体正常生理功能所必需的微量元素之一。
5. 镁(Mg)镁是一种轻质金属元素,具有良好的强度和导热性。
它广泛应用于汽车制造、航空航天和电子等领域。
镁合金具有较高的强度和抗腐蚀性,同时具备轻质的特点,可有效降低结构的重量。
6. 钛(Ti)钛是一种轻质高强度的金属元素,具有良好的耐腐蚀性和生物相容性。
它广泛应用于航空航天、医疗器械和化工等领域。
钛合金具有较高的强度和低的密度,被誉为“现代金属之王”。
总结:以上介绍了常见的金属元素,包括铁、铜、铝、锌、镁和钛。
这些金属元素在工业和生活中发挥着重要的作用,应用广泛。
了解这些金属元素的特点和应用范围,有助于我们更好地认识和利用金属资源,推动科技和工业的发展。

金属专题二——镁、铝、铁3.其它常见的金属(如Mg、Al、Fe)[考点扫描]1.Mg、Al的性质。
2.Al2O3和Al(OH)3的两性。
3.铁的化学性质。
4.铁的氧化物和铁的氢氧化物。
5.Fe、Fe2+、Fe3+之间的相互转化关系。
6.Fe2+、Fe3+的检验。
[知识指津]1.Mg、Al的性质(1)物理性质:镁、铝都是密度小、熔点低、硬度较小的银白色金属,但镁与铝相比较,铝的硬度、密度都比镁大,熔沸点都比镁高。
二者都有良好的导热、导电性能及韧性和延展性。
(2)镁、铝化学性质及用途比较镁铝与非金属反应与X2、O2、S、N2等反应,如:Mg+S MgS,2Mg+O22MgO与X2、O2、S等反应,如:2Al+3S Al2S3,4Al+3O22Al2O3与酸反应Mg+2H+=Mg2++H2↑,与氧化性酸浓H2SO4、HNO3反应较为复杂2Al+6H+=2Al3++3H2↑,室温时,在浓硫酸、浓硝酸中钝化与水反应Mg+2H2O Mg(OH)2+H2↑生成的Mg(OH)2能使酚酞试液变红去掉氧化膜的Al与沸水缓慢反应2Al+6H2O2Al(OH)3+3H2↑与碱反应不反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑与氧化物反应(干态置换)2Mg+CO22MgO+C 镁着火,不能用CO2灭之2Al+Fe2O3Al2O3+2Fe (铝热反应) 用途照明弹,制合金等导线、电缆、炊具、化工、合金2.Al2O3Al2O3是一种白色难熔的物质,不溶于水,是冶炼金属铝的原料,也是一种比较好的耐火材料。
是典型的两性氧化物,Al2O3+6H+=2Al3++3H2O,Al2O3+2OH-=2AlO2-+H2O3.Al(OH)3Al(OH)3是几乎不溶于水的白色胶状物质,能凝聚水中的悬浮物,又能吸附色素,是典型的两性氢氧化物,在酸或强碱中都能溶解,能用平衡移动原理解释,其两性电离方程式如下:H2O+AlO2-+H+Al(OH)3Al3++3OH-酸式电离碱式电离4.“铝三角”及其应用――典型复分解关系(1)“铝三角”系指Al3+、Al(OH)3、AlO2-相互依存的三角关系;有关离子方程式为:Al3++3OH-=Al(OH)3↓或Al3++3NH3·H2O=Al(OH)3↓+3NH4+Al(OH)3+OH-=AlO2-+2H2O,AlO2-+4H+=Al3++2H2O;Al3++4OH-=AlO2-+2H2O,AlO2-+H++H2O=Al(OH)3↓或AlO2-+CO2+2H2O=Al(OH)3+HCO3-,Al(OH)3+3H+=Al3++3H2O(2)应用①制取Al(OH)3,最好用铝盐与氨水作用或将CO2通人偏铝酸盐中;②离子共存问题:Al3+与S2-、AlO2-、HCO3-、CO32-因相互促进水解而不能大量共存,AlO2-与H+、NH4+、Al3+、Fe3+等不能大量共存。

常见金属元素及其化合物金属元素是指具有金属性质的化学元素,常见金属元素包括铁、铜、铝、锌、镁、钙、锡等。
这些金属元素具有良好的导电性、导热性、延展性、韧性等特点,被广泛应用于工业、建筑、电子、汽车等领域。
以下将对常见金属元素及其化合物进行介绍。
铁是最常见的金属元素之一,它在地壳中含量很丰富。
铁具有良好的韧性和可塑性,广泛应用于钢铁制造、建筑、机械加工、电子设备等领域。
铁的化合物有很多,常见的有氧化铁(Fe2O3)和硫化铁(FeS2)等。
氧化铁是一种重要的无机颜料,用于制造红、橙、黄等颜色的油漆、颜料和陶瓷;硫化铁常用于制造火柴的火头。
铜是另一种常见的金属元素,具有良好的导电性和导热性。
铜广泛应用于电子设备、电线、管道等领域。
铜的化合物有氧化铜(CuO)、硫化铜(CuS)等。
氧化铜常用作无机颜料、催化剂和电池材料;硫化铜可用于制备农药和矿石浮选剂。
铝是一种轻质金属元素,密度低、延展性好。
铝广泛用于飞机、汽车、建筑等领域。
铝的主要化合物有氧化铝(Al2O3)和硫化铝(Al2S3)等。
氧化铝是一种重要的工业原料,广泛用于制造陶瓷、搪瓷、耐火材料等;硫化铝用于制备染料和催化剂。
锌是一种重要的工业金属,具有抗腐蚀性好、导电性能优良等特点。
锌广泛应用于电镀、电池制造、建筑材料等领域。
锌的主要化合物有氧化锌(ZnO)和硫化锌(ZnS)等。
氧化锌常用于生产橡胶、涂料、油漆、化妆品等;硫化锌是一种重要的矿石,在锌冶炼过程中起着重要的作用。
镁是一种轻质金属元素,密度低、质轻。
镁广泛应用于轻金属合金、烟火制造、航空航天等领域。
镁的主要化合物有氧化镁(MgO)和硫化镁(MgS)等。
氧化镁是一种重要的耐火材料,广泛用于高温炉窑、电解槽等;硫化镁可用于制备染料和防腐剂。
钙是一种重要的金属元素,广泛存在于生物体内。
钙广泛应用于建筑材料、电子材料、钢铁冶炼等领域。
钙的主要化合物有氧化钙(CaO)和氯化钙(CaCl2)等。
氧化钙是一种重要的建筑材料,用于制备水泥、石灰等;氯化钙常用于融雪剂、防止水泥凝固等。

专题六镁、铝、铁、铜金属的冶炼考点1 镁及其化合物1. [2018全国名校第二次大联考]镁、铝都是较活泼的金属,下列描述中正确的是( )A.高温下,镁、铝在空气中都有抗腐蚀性B.镁、铝都能跟稀盐酸、稀硫酸、强碱反应C.镁在点燃条件下可以与二氧化碳反应,铝在一定条件下可以与氧化铁发生氧化还原反应D.铝热剂是镁条、铝粉和氧化铁的混合物2.在标准状况下,进行甲、乙、丙三组实验,三组各取 60 mL 同浓度盐酸,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:则下列说法正确的是( )A.甲组和乙组的实验中,盐酸均是过量的B.盐酸的物质的量浓度为0.8 mol·L-1C.合金中镁铝的物质的量之比为1∶1D.丙组中铝的物质的量为0.009 mol3.(1)[2014新课标全国卷Ⅱ,36(4),4分]采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式。
(2)[2015新课标全国卷Ⅰ,27(6)改编]单质硼可用于生产具有优良抗冲击性能的硼钢。
以硼酸(H3BO3)和金属镁为原料可制备单质硼,用化学方程式表示制备过程: 。
考点2 铝及其化合物4.下列关于铝的说法中正确的有( )①铝制容器可盛装热的浓硫酸②工业上电解熔融状态AlCl3制备Al ③常温下将Al片放入浓硝酸中无明显变化,说明Al与浓硝酸不反应④铝镁合金可完全溶解于烧碱溶液中⑤氧化铝和氧化镁都可以作耐火材料A.1个B.2个C.3个D.4个5.[2016上海,20,4分]已知NaOH+Al(OH)3 Na[Al(OH)4]。
向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。
上述实验过程中没有发生的离子反应是( )A.CO2+2OH- C-+H2OB.Al2O3+2OH-+3H2O 2[Al(OH)4]-C.2Al+2OH-+6H2O 2[Al(OH)4]-+3H2↑D.Al3++4OH- [Al(OH)4]-6.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为( )A.3∶1B.2∶1C.1∶1D.1∶37.[2014北京理综,7,6分]下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )A.KB.NaC.FeD.Al8.向MgSO4、(NH4)2SO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。

铁铜锌镁铝化学元素铁(Fe),铜(Cu),锌(Zn),镁(Mg),铝(Al)是五种常见的化学元素。
它们在自然界中广泛存在,具有重要的工业和生物学应用。
本文将从它们的物理性质、化学性质、用途等方面对这五种元素进行介绍。
铁(Fe)是地壳中含量最丰富的金属元素之一,也是人体中最丰富的矿物元素之一。
它的原子序数为26,原子量为55.845。
铁是一种有磁性的金属,具有良好的强度和韧性。
它有较高的熔点和沸点,可在高温下与氧气反应生成氧化铁。
铁的主要用途是制造钢铁,钢铁是现代工业中广泛使用的构造材料。
此外,铁也用于制造电线、汽车、船舶等。
铜(Cu)是一种有价值的金属元素,它的原子序数为29,原子量为63.546。
铜是一种非常好的导电体和导热体,具有良好的延展性和韧性。
铜广泛应用于电气工程、电子技术和建筑工程等领域。
铜还可以合金化,制成耐蚀合金,如黄铜、青铜等。
另外,铜也以其反菌性能而被使用在食品加工、医疗器械等领域。
锌(Zn)是一种化学活性较大的金属元素,它的原子序数为30,原子量为65.38。
锌在常温下是蓝白色的金属,具有良好的延展性和韧性。
锌是一种重要的耐蚀金属,常用于镀锌钢铁,以增强其耐腐蚀性能。
锌也可以制成合金,如白铜、铜锌合金等。
此外,锌在生物学中具有重要的作用,是许多酶的组成部分。
镁(Mg)是一种轻金属元素,它的原子序数为12,原子量为24.305。
镁具有低密度、良好的延展性和韧性,能够在常温下燃烧,产生明亮的白色火焰。
镁是一种重要的结构材料,在航空、汽车等工业中广泛使用。
镁也可以用于制造火箭、导弹等火箭推进器的燃料。
此外,镁离子在生物体内起着重要的作用,是许多生物体的必需元素。
铝(Al)是一种常见的金属元素,它的原子序数为13,原子量为26.982。
铝是一种轻金属,具有低密度、良好的延展性和导电性。
铝具有很好的耐腐蚀性,能够与氧气反应生成致密的氧化膜,保护金属的表面。
铝广泛应用于包装材料、建筑材料、电力工程等领域。


镁、铝、铁的性质镁、铝、铁、铜等是常见的几种重要的金属元素,特别是铁和铁的化合物在日常生活中有着重要的用途,因此铁和铁的化合物在高考题中经常出现。
铁的考查重点是Fe、Fe2+、Fe3+之间的相互转化,铝及其化合物也不容忽视,铝的考查重点是铝三角关系,这部分知识常以实验题、推断题、选择题等多种形式出现。
该部分知识点易出现的问题:①不能正确书写镁与二氧化碳、铝、铝的氧化物与氢氧化钠溶液、铁在高温下与水蒸气以及溴化亚铁与氯气等反应的化学方程式;②误认为氢氧化铝能溶于氨水等。
未来高考预测:以铁及其化合物、铝及其化合物的知识为线索,设计实验题;利用Al3+、AlO2-、Fe3+的双水解知识命制无机框图或离子组合题;围绕铝三角、铁三角设计创新题型;另外利用Al3+、AlO2-、Fe3+的双水解知识以及Fe2+的还原性考查离子共存问题。
我们认为这些题型在今后的高考中都是出现几率较大的题型。
镁、铝、铁、铜是中学化学中常见的重要的金属,在高考中频频出现,现将其化学性质归纳、比较如下,供同学们复习参考:化学性质镁铝铁铜与O2反应常温下生成氧化膜,点燃燃烧2Mg +O22 MgO常温下生成氧化膜,点燃燃烧4Al +3O2 2 Al2O3过度元素,第四周期,第Ⅷ族,在氧气中点燃燃烧3Fe +2O2Fe3O4过度元素,第四周期,第I B族,加热氧化2Cu + O22CuO与其它非金属反应Mg+Cl2MgCl2Mg + SMgS3Mg+N2Mg3N24Al+3Cl22AlCl32Al + 3S Al2S32Fe +3Cl22FeCl3Fe +S FeSCu + Cl2CuCl22Cu + S Cu2S与酸反Mg + 2H+===2Al + 6H+===2Al3++ Fe + 2H+=== Fe2++ 稀盐酸、稀硫酸不反应应Mg2+ + H2↑(与硝酸反应复杂,硝酸的浓度不同,还原产物可以是NO2、NO、N2O或硝酸铵等)3H2↑(常温下遇浓硝酸、浓硫酸钝化)H2↑(常温下遇浓硝酸、浓硫酸钝化,加热时反应,且反应复杂,硝酸的浓度、用量以及铁的用量不同,氧化产物和还原产物均不相同)Cu+2H2SO4(浓)CuSO4+ SO2↑+2H2OCu+4HNO3(浓) ==Cu(NO3)2+ 2NO2↑+2H2O3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O与碱溶液反应不反应2Al + 2H2O +2NaOH ===2NaAlO2 + 3H2↑不反应不反应与某些盐溶液反应Mg + 2NH4+===Mg2++H2↑+2NH3↑2Al + 3Cu2+===2Al3++3CuFe + Cu2+=== Fe 2+ +Cu湿法炼铜Cu +2Ag+=== 2Ag + Cu2+与氧化物反应2Mg + CO22MgO + C 8Al+3Fe3O49Fe+ 4Al2O33Fe + 4H2O(g)Fe3O4+ 4H2【例题1】(2011广东高考10)某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是A. 将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性B. 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C. 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D. 将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体解析:本题考察镁及其化合物的性质、常见的基本实验操作。

高考命题方向1.从钠原子结构特征认识钠的化学性质;2Na O 和22Na O 的对比,23Na CO 与3NaHCO 比较;碱金属元素的原子结构及物理性质比较。
2.Mg 、Al 及其化合物性质的试题在高考中不断增多,在离子共存、离子方程式书写及其正误判断、物质鉴别和推断、实验和化学计算不断出现。
3. Al 3+、Al(OH)3 、AlO 2-的相互转化及图像分析时,一是要明确反应原理,掌握反应规律;二是要弄清图像中的最高点、最低点、转折点及水平线的意义;三是要将定性分析和定量计算充分结合起来。
4.复习铁及其化合物性质时,要将铁的变价性质、Fe(OH)2的颜色变化、Fe 3+的检验及基本概念、基本理论和其他元素化合物知识结合起来综合分析。
知识点1: 钠、镁 1、物理性质钠:钠是银白色金属,密度小(0.97g/cm 3), 镁:镁是银白色金属,质较软,密度1.74g/cm 3, 熔点低(97℃),硬度小,质软,可用刀切 是轻金属,硬度小。
割。
钠通常保存在煤油中。
是电和热的良导体。
2、原子结构钠 镁 3、化学性质(1)与非金属单质(氧气、氯气、硫、氮气)常温:4Na + O 2 == 2Na 2O, 2Mg + O 2 == 2MgO 加热:2Na + O 2 △Na 2O 2; Mg + Cl 2点燃MgCl 2 2Na + Cl 2 △2NaCl; 2Mg+CO 2点燃2MgO+C 2Na + S △Na 2S 3Mg + N 2点燃Mg 3N 2(2)与水的反应2Na + 2H 2O == 2NaOH + H 2↑ Mg + 2H 2O(沸水)== Mg(OH)2 + H 2 ↑ 现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后 消失,在反应后的溶液中滴加酚 酞,溶液变红。
(浮、熔、游、响、红)结论:从反应条件的难易判断出 金属性/还原性:Na>Mg (3)与酸反应2Na + 2HCl == 2NaCl + H 2↑ Mg + 2HCl == MgCl 2 + H 2↑Na 放入稀盐酸中,是先与酸反应,酸不足 与非强氧化性酸反应:是酸中的H +与Mg 反应, 再与水反应。

常见金属材料
金属材料是工业生产和日常生活中常见的材料之一,其具有良好的导电性、导热性、强度和韧性,因此被广泛应用于机械制造、建筑工程、电子电器等领域。
常见的金属材料主要包括铁、铜、铝、锌、镁等,它们各自具有特定的性能和用途。
首先,铁是最常见的金属材料之一,其主要包括铸铁和钢铁两种类型。
铸铁具有良好的流动性和耐磨性,常用于机械零件、汽车零部件等的制造。
而钢铁则具有较高的强度和韧性,广泛应用于建筑结构、桥梁、船舶制造等领域。
其次,铜是一种重要的导电材料,具有良好的导电性和热导性,因此被广泛应用于电气工程领域。
铜制品主要包括铜线、铜管、铜板等,它们在电力输送、通讯设备、家用电器等方面发挥着重要作用。
另外,铝是一种轻质金属材料,具有良好的耐腐蚀性和导热性,因此被广泛应用于航空航天、汽车制造、建筑装饰等领域。
铝制品主要包括铝合金型材、铝板、铝箔等,它们在各个领域都有着重要的用途。
此外,锌是一种常见的防腐金属材料,具有良好的防腐蚀性能,因此被广泛应用于建筑材料、汽车外壳、家具五金件等领域。
锌制品主要包括镀锌钢板、锌合金件等,它们在防腐领域发挥着重要作用。
最后,镁是一种轻质金属材料,具有良好的强度和耐高温性能,因此被广泛应用于航空航天、汽车制造、兵器制造等领域。
镁制品主要包括镁合金型材、镁合金铸件等,它们在轻量化领域有着重要的应用前景。
总的来说,常见金属材料在工业生产和日常生活中发挥着重要作用,它们各自具有特定的性能和用途,为各行各业的发展提供了坚实的支撑。
随着科技的不断进步和工艺的不断创新,金属材料的应用领域将会更加广泛,为人类创造出更多的美好未来。
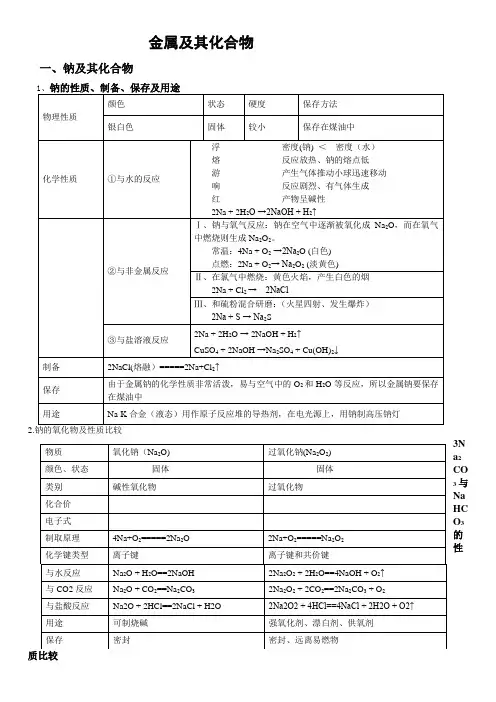
金属及其化合物一、钠及其化合物2.钠的氧化物及性质比较3N a 2CO 3与Na HC O 3的性4、焰色反应(1)定义:许多金属或他们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。
(2)实验步骤:a.点燃酒精灯(一点)b.将铂丝放入稀盐酸中清洗,在放到火焰上灼烧,直至火焰呈现原 来的颜色(二洗烧)c.用铂丝蘸取固体或液体待测物,灼烧、观察。
若是钾元素,应透过蓝色钴玻璃观察 (三蘸烧)。
d.将铂丝用稀盐酸洗净,放在火焰上烧至原色,放回原处(四洗烧)。
二、镁及其重要化合物1.镁的性质化学名称 镁物理性质 硬度及密度较小,熔点较低的银白色金属,良好的导电性,导热性,延展性。
表面均有一层致密的氧化膜。
化学 性 质 化 学 性 质 与氧气反应 2Mg+O 2 →2MgO 与非金属单质反应Mg+Cl 2 MgCl 2与水反应 Mg+2H 2OM g (O H )2+H 2↑与酸反应 Mg+2H +=Mg 2++H 2↑与碱反应 不反应 与盐反应 Mg+Cu 2+= Mg 2++Cu 与某些氧化物反应2Mg+CO 2 2MgO+C制取① 煅烧贝壳,制成石灰乳 ② 加入海水沉淀池中 ③ 沉淀与盐酸反应 ④ 蒸发结晶电解(三)铝及其重要化合物化学式 Na 2CO 3 NaHCO 3 俗名 纯碱、苏打 小苏打溶解性 易溶于水 易溶于水(溶解度较Na 2CO 3小) 热稳定性稳定受热易分解2NaHCO 3Na 2CO 3+H 2O+CO 2↑H + CO 32-+H +=HCO 3- CO 32-+2H +=CO 2↑+H 2O 分步进行HCO 3-+H +=CO 2↑+H 2O OH - 不反应 HCO 3-+OH —=CO 32-+H 2O石灰水 CO 32-+Ca 2+=CaCO 3↓ 石灰水足量:HCO 3-+Ca 2++OH -=CaCO 3↓+H 2O石灰水不足:2HCO 3-+Ca 2++2OH —=CaCO 3↓+2H 2O+CO 32-BaCl 2 CO 32-+Ba 2+=BaCO 3↓ 不反应(若再加NaOH ,则有沉淀)CO 2 NaCO 3+CO 2+H 2O=2NaHCO 3 不反应用途用于玻璃、肥皂、造纸、纺织等工业,洗涤发酵剂、灭火器,医疗上用于治胃酸过多转化点燃 点燃1、铝的结构:(1)、原子结构示意图: (2)、周期2. 铝的性质:表中位置:第三周期ⅢA 族;铝原子核外有三个电子,在化学反应中,容易失去最外层的三个电子,应的实质:分两步进行:(2)Al(OH)3+NaOH ======== Na[Al(OH)4]三、铝的重要化合物1.氧化铝(Al 2O 3)(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
镁、铝 、铁、铜 有关方程式书写(抽测范围)1.镁在O 2中燃烧 2Mg + O 2 === 2MgO镁在CO 2中燃烧2Mg + CO 2 === 2MgO + C2.镁和稀硫酸 Mg +H 2SO 4 === Mg SO 4 + H 2 ↑ Mg +2H + === Mg 2++ H 2 ↑3.铁在氯气中燃烧 2Fe + 3Cl 2 === 2FeCl 3 铁在氧气中燃烧 3Fe + 2O 2 === Fe 3O 44.加热铁和硫的混合物 Fe + S === FeS 加热铜和硫的混合物2Cu + S === Cu 2 S 5.铁和稀硫酸 Fe +H 2SO 4 === FeSO 4 + H 2 ↑ Fe +2H + === Fe 2++ H 2 ↑6.铁和硫酸铜 Fe +CuSO 4 === FeSO 4 + Cu Fe +Cu 2+ === Fe 2++ Cu 铜和硝酸银 Cu +2AgNO 3 === Cu(NO 3) 2 +2 Ag Cu +2Ag + === Cu 2+ + 2Ag7.氯化亚铁溶液和锌 FeCl 2 + Zn=== 2Fe + ZnCl 2 Fe 2+ + Zn=== Fe + Zn 2+8.氯化亚铁溶液和氯气 2FeCl 2 + Cl 2=== 2FeCl 3 2Fe 2+ + Cl 2=== 2Fe 3++ 2Cl —9.FeCl 3溶液腐蚀铜箔 2FeCl 3 + Cu=== 2FeCl 2 + CuCl 2 2Fe 3+ + Cu=== 2Fe 2+ + Cu 2+10.氯化铁溶液和铁反应 2FeCl 3 + Fe=== 3FeCl 2 2Fe 3+ + Fe=== 3Fe 2+11.将饱和FeCl 3溶液滴入沸水中FeCl 3 + 3H 2O === Fe(OH)3 (胶体) +3HClFe 3+ + 3H 2O === Fe(OH)3 (胶体) + 3H +12.Al 和Fe 2O 3的铝热反应 2Al+ Fe 2O 3 === 2Fe + Al 2O 313.Al 和稀硫酸反应 2Al +3H 2SO 4 === Al 2(SO 4) 3 + 3H 2 ↑ 2Al +6H + === 2Al 3++ 3H 2 ↑14.Al 和NaOH 溶液反应 2Al + 2NaOH +6H 2O === 2Na[Al (OH) 4 ]+ 3H 2 ↑ 2Al + 2OH — +6H 2O === 2 [Al (OH) 4 ] —+ 3H 2 ↑ 15.Al 2O 3和硫酸反应 Al 2O 3 +3H 2SO 4 == Al 2(SO 4) 3 + 3H 2OAl 2O 3+6H + == 2Al 3++ 3H 2O16.Al 2O 3和NaOH 溶液反应 Al 2O 3+ 2NaOH +3H 2O === 2Na[Al (OH) 4 ] Al 2O 3 + 2OH — +3H 2O === 2 [Al (OH) 4 ] —17.AlCl 3溶液加氨水至过量制备Al(OH)3 AlCl 3 + 3NH 3·H 2O == Al(OH)3 ↓+ 3NH 4Cl Al 3++ 3NH 3·H 2O == Al(OH)3 ↓+ 3NH 4+18.Al 2(SO 4)3溶液滴加少量NaOH 溶液有沉淀,继续加NaOH 溶液沉淀溶解(分步写) ①Al 2(SO 4)3 + 6NaOH== 2Al(OH)3↓+3 Na 2SO 4 、Al 3++ 3 OH —== Al(OH)3↓ 点燃点燃 点燃 点燃 △ △ 高温△ △②Al(OH)3 +NaOH = Na[Al (OH) 4 ]、 Al(OH)3 +OH —==[Al (OH) 4 ] — Al 2(SO 4)3溶液加过量NaOH Al 2(SO 4)3 + 8NaOH== 2Na[Al (OH) 4 ] +3 Na 2SO 4Al 3++ 4 OH —===[Al (OH) 4 ] —Na[Al(OH)4] 溶液加少量盐酸有沉淀,继续加盐酸沉淀溶解(分步写) ①Na[Al (OH) 4 ] + HCl == NaCl + Al(OH)3↓+ H 2O 、[Al (OH) 4 ] —+ H +== Al(OH)3↓+ H 2O ②Al(OH)3 +3HCl == AlCl 3 +3H 2O Al(OH)3 +3H +== Al 3++ 3H 2O Na[AlOH)4] 溶液加过量盐酸 Na[Al (OH) 4 ] +4 HCl == NaCl + AlCl 3 + 4H 2O[Al (OH) 4 ] —+4 H +== Al 3++ 4H 2O 19.Al(OH)3和硫酸反应 2Al(OH)3 +3H 2SO 4== Al 2(SO 4)3 +6H 2OAl(OH)3 +3H +== Al 3++ 3H 2O20.Al(OH)3受热分解 2Al(OH)3=== Al 2O 3+3H 2O21、电解MgCl 2 MgCl 2 === Mg + Cl 2 ↑22、铜生锈的反应 2Cu + O 2 + H 2O + CO 2 ===Cu 2(OH)2CO 3△ 通电。
高中化学镁铝铁知识归纳一、镁1. 镁的性质镁是一种质轻、柔软、有光泽的银白色金属,在空气中易氧化。
它容易发生燃烧反应,在氧气中燃烧时会放出很强的光和热。
镁可以和非金属反应,与卤素的反应尤其强烈。
2. 镁的用途•镁可以用于制造航天器、战斗机和轻量化汽车等重要的航空航天和交通工具。
•镁还可以用于制造人造合成纤维、防火材料和荧光粉等化工产品。
3. 镁的化合物及其性质•氧化镁(MgO):一种高熔点的白色固体,可用作耐高温材料。
•氯化镁(MgCl2):一种常见的镁化合物,可用作工业上重要的金属提取剂和干燥剂。
•硫酸镁(MgSO4):可用于制备镁盐和肥料。
•碳酸镁(MgCO3):常见的挥发性碱式镁盐,有一定的生物作用。
二、铝1. 铝的性质铝是一种具有良好的延展性、可塑性和耐腐蚀性的轻质金属。
它在空气中易生成一层氧化铝膜,能有效地保护其表面不受氧化破坏。
2. 铝的用途•铝可以用于制造轻型汽车、航空器和建筑结构材料等。
•铝还可以用于制造食品包装和家电等日用品。
3. 铝的化合物及其性质•氧化铝(Al2O3):一种无机化合物,可用于制备工业上重要的铝盐、金属铝和陶瓷等。
•氯化铝(AlCl3):一种常见的铝化合物,可用作工业上重要的催化剂和中间体。
•硫酸铝(Al2(SO4)3):可用于制备铝盐和纸张脱酸剂等。
三、铁1. 铁的性质铁是一种重要的金属元素,具有良好的导电性、延展性和磁性。
铁在空气中易氧化,形成氧化铁层,保护铁不受氧气的破坏。
2. 铁的用途•铁可以用于制造建筑结构、船舶、火车和汽车等重要的交通工具。
•铁还可以用于制造钢铁、炉具和钉子等日用品。
3. 铁的化合物及其性质•氧化铁(Fe2O3):一种常见的铁氧化物,可用作制备铁盐和陶瓷等。
•氯化铁(FeCl3):可用作催化剂、氧化剂和沥青加氢剂等。
•硫酸亚铁(FeSO4):可用作食品和饲料的补铁剂、铁盐的原料、药物等。
四、•镁、铝和铁都是非常重要的金属元素,它们在工业、交通和日常生活中都有很广泛的应用。
铁铜锌镁铝化学元素的写法铁铜锌镁铝是一些常见的化学元素,它们在自然界和人类生活中都有重要的作用。
本文将介绍这些元素的基本特征、化学符号、原子结构、化合物和用途,帮助读者了解它们的写法和性质。
铁铁是一种金属元素,化学符号为Fe,原子序数为26,相对原子质量为55.85。
铁是地球上最丰富的金属元素之一,占地壳的4.7%,占地球总质量的35%。
铁有四种同位素,其中最稳定的是56Fe,占铁的91.75%。
铁的原子结构如下:原子核由26个质子和30个中子组成,总共56个核子。
原子核外有26个电子,分布在四个电子层上。
最外层有两个电子,称为价电子,它们决定了铁的化学性质和价态。
铁有多种价态,最常见的是+2和+3,也有+4、+6等高价态。
铁可以与其他元素形成各种化合物,例如:氧化铁:FeO、Fe2O3、Fe3O4等,是铁锈的主要成分,也是一些矿物和颜料的来源。
硫化铁:FeS、FeS2等,是一些重要的硫化矿物,如黄铁矿、黄麻石等。
氯化铁:FeCl2、FeCl3等,是一些常用的无机盐,有杀菌、净水、染色等用途。
碳酸铁:FeCO3等,是一些碳酸盐矿物,如菱铁矿、菱锰矿等。
硝酸铁:Fe(NO3)2、Fe(NO3)3等,是一些强氧化剂,有制药、火药、染料等用途。
铁还可以与其他金属形成合金,例如:钢:含有少量碳和其他元素的铁合金,是最常用的工业材料之一。
不锈钢:含有少量铬和其他元素的钢合金,具有耐腐蚀和美观的特点。
铸铁:含有较多碳和其他元素的铁合金,具有硬度高和耐磨的特点。
镍铁:含有较多镍和其他元素的铁合金,具有磁性和导电性的特点。
铜铜是一种金属元素,化学符号为Cu,原子序数为29,相对原子质量为63.55。
铜是人类最早使用的金属之一,历史悠久。
铜在自然界中主要以硫化物或氧化物的形式存在,占地壳的0.01%。
铜有两种稳定同位素,分别是63Cu和65Cu。
铜的原子结构如下:原子核由29个质子和34个中子组成,总共63个核子。
第四章 几种重要的金属第一节 镁和铝(4课时)第1课时知识目标:1. 了解金属的通性。
2. 掌握镁和铝的化学性质。
教学过程: 一、金属的分类1.冶金工业黑色金属:铁、铬、锰;有色金属:除上述三种外 2.根据密度重金属:34.5g/cm >;轻金属:34.5g/cm <3.据地壳中的含量常见金属:铁、铝、铜;稀有金属:钽、锆、铌 二、金属的通性1.物理性质:固态(除Hg 外);金属光泽;导电导热;延展性;较大的硬度;较高的熔沸点。
2.化学性质:(1)易失电子,表现出还原性,作还原剂。
(2)金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H ) Cu Hg Ag Pt Au 例1、1.下列叙述中所描述的物质一定是金属元素的是( )A .易失去电子的物质B .原子最外层只有一个电子的元素C .单质具有金属光泽的元素D .第三周期中,原子的最外层上只有2个电子的元素 答案:D 三、镁、铝的性质(一)镁、铝的原子结构和物理性质1.原子结构:(1)原子结构示意图:Mg Al (2)电子式: Mg Al(3)周期表中的位置:Mg Al (4)原子半径;Mg Al (填<,>或=)2.物理性质都是银白色的轻金属,有较强的韧性、延展性,有良好的导电、导热性。
例2 、把镁粉中混有的少量铝粉除去,应选用的试剂是( )A.稀盐酸B.烧碱溶液C.硫酸铝溶液D.氯水答案:B例3、铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝“确定为食品污染之一”而加以控制。
铝在下列场合须加以控制的是()①制铝锭②制易拉罐③制电线电缆④制牙膏皮⑤用明矾净水⑥制炊具⑦用明研和小苏打作出食物膨化剂⑧用Al(OH)3制成胃药⑨制防锈油漆A ①②④⑤⑥⑦B ②⑤⑥⑦⑧⑨C ②④⑤⑥⑦⑧D ③④⑤⑥⑦⑧答案:C基础训练:1、下列关于金属元素特征的叙述正确的是()A.金属元素的院子只有还原性,金属离子只有氧化性B.金属元素在化合物中一定显正价C.金属元素在不同的化合物中的化合价都相同D.金属元素的单质在常温下都是固体2、相同质量的镁和铝分别跟足量的盐酸溶液反应,生成氢气的体积比为( )A .1:1B .1:2C .2:3D .3:43、由钠、镁、铝、锌四种金属单质中的两种组成的合金12g ,跟足量的盐酸反应,产生5.6L 标准状况下的氢气,那么此合金中一定含有的金属是( )A .NaB .MgC .AlD .Zn4、某透明的溶液中加入铝粉能放出氢气,此溶液中一定能大量共存的离子组是A .--++242SO Cl Cu H B .+---Na SO NO HCO 2433 C .++--Na K SO Cl24 D .---+Cl SO AlO Na 242 5、有一不纯的铝中含有硅和铁两种杂质。
取两份等质量的样品,分别与足量的盐酸和氢氧化钠溶液充分反应后,生成等量的气体,则不纯铝中含铁和硅的比是( )A .质量之比为2:1B .物质的量之比为1:1C .质量之比为1:1D .物质的量之比为2:16、把铝粉和Fe 3O 4粉末配成铝热剂,平均分为两份。
第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分;第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是( )A .1:1B .9:8C .3:4D .4:37、将相同质量的镁条分别在①氧气中②空气中③氮气中④二氧化碳中燃烧,燃烧后所得固体产物的质量由小到大的排列顺序为 (填序号) 能力提升:8、在一金属铝的易拉罐内充满CO 2,然后往罐内注入足量的NaOH 溶液,立即用胶布严封罐口。
过一段时间后,罐壁内凹内瘪。
再过一段时间后,瘪了的罐壁又重新鼓起。
(1)罐壁内凹而瘪的原因是 ,反应的化学方程式是: 。
(2)罐再鼓起的原因是 ,反应的化学方程式是: 。
第2课时学习目标:1. 掌握氧化铝的化学性质、氢氧化铝的两性。
2. 掌握氢氧化铝的制备3. 使学生初步了解合金及其特点。
教学过程: 四、铝的重要化合物(一).镁、铝的存在:在自然界中仅有化合态。
其中镁主要以432MgSO MgCO MgCl 、、等形式存在;铝主要以O 12H )KAl(SO O Al 22432⋅、等形式存在,其在地壳中的含量居第3位(金属中第1)。
(二).镁和铝的氧化物的主要性质思考1:氢氧化铝为什么呈两性? 提示:3Al(OH)呈现两性的原因:-+++22AlO H O H 3Al(OH)-++3OH Al 3(四).氢氧化铝的制备思考2:由3Al(OH)呈现两性的原因和双水解原理讨论Al(OH)3的制备有多少种方法?方法1:Al 3+ + 3OH - == Al(OH)3↓AlCl 3 + 3NH 3·H 2O == Al(OH)3↓+ 3NH 4Cl (实验室制法) 方法2:AlO 2- + H + + H 2O == Al(OH)3 CO 2 + 3H 2O + 2NaAlO 2 == 2Al(OH)3↓+ Na 2CO 3方法3:3AlO 2- + Al 3+ + 6H 2O == 4Al(OH)3↓(此方案最佳) (五).硫酸铝钾复盐:由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐。
复盐又叫重盐。
-++++=243242SO Al K )KAl(SO十二水合硫酸铝钾[O 12H )KAl(SO 224⋅]俗称明矾。
明矾是无色晶体,易溶于水,发生水解产生絮状3Al(OH),吸附能力强,能吸附水里的杂质,并形成沉淀,使水澄清,所以明矾常作净水剂。
五、合金1.定义:由两种或两种以上金属(或金属与非金属)熔合在一起形成的具有金属特性的物质。
合金属于混合物。
2.合金的性质特点:一般说来,合金的熔点比其成分金属都低,而在硬度、韧性等方面却往往有其他成分金属所不具有的独特的性质 基础训练:1、下列关于氢氧化铝性质的叙述错误的是( )A.Al(OH)3 是两性氢氧化物B. Al(OH)3 是难溶于水的白色胶状物质C. Al(OH)3 能凝聚水中悬浮物,也能吸附色素D. Al(OH)3 既能溶于NaOH 溶液、氨水、又能溶于盐酸2、为了除去MgO 中混有的少量杂质Al 2O 3,可选用的试剂是( )A .HNO 3 溶液B .氨水C .稀盐酸D .NaOH 溶液 3、实验室中要在坩埚内加热熔融氢氧化钠,下列坩埚中不可采用的是( )A .氧化铝坩埚B .氧化镁坩埚C .粘土坩埚D .铁坩埚 4、实验室中,要使3AlCl 溶液中的3Al 离子全部沉淀出来,适宜用的试剂是( ) A .NaOH 溶液 B .3AgNO 溶液 C .盐酸 D .氨水5、某碱式碳酸镁[Mg (OH )2·xMgCO 3] 固体31g 恰好与100 mL 8 mol ·L -1的盐酸反应生成MgCl 2溶液,则x 为( )A.1B.2C.3D.4 6、有关合金的叙述不正确的是 ( )A.合金的熔点比它的各成份金属的熔点低B.合金的硬度和强度一般比纯金属高C.合金一定是金属熔合而成的物质D.硬铝、黄铜和钢均为合金7、向100 mL 2 mol ·L -1的氯化铝溶液中加入1 mol ·L -1的氢氧化钠溶液, 产生7.8g 沉淀, 则加入氢氧化钠溶液的体积为( )A .300 mLB .500 mLC .700 mLD .900 mL 能力提升:8、向含amol AlCl 3的溶液中加入含bmol NaOH 的溶液,生成沉淀的物质的量可能是( ) ①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0 ⑥(4a-b )molA .①②③④⑤B .①③④⑤⑥C .①④⑤⑥D .①④⑤⑥9、实验室需要制取一定量的氢氧化铝,现可供选择的原料有铝、稀硫酸、氢氧化钠溶液.请用化学方程式表示制备的方法,并从节约原料角度出发,评价方案的优劣性.第3课时知识目标:掌握并理解有关“铝三角”的图像及其计算。
教学过程:在本节内容中,图像题特别多.并且以含铝物质与其他物质的混合计算为主.在解答图像型计算题时,要学会分析图像中的关键因素,抓住本质特征,对应特征反应,就能理想地解题.一般要抓住图像中的“四点”,即(1)起点(一般为原点),(2)交点,(3)转折点,(4)终点.通过对这些关键点的分析,计算,就能得出答案. 六、“铝三角”及相应的图像+3Al 、3)(OH Al 、-2AlO 之间的转化关系1.向一定量3AlCl 溶液中滴加NaOH 溶液。
A →B NaCl OH Al NaOHAlCl 3)(333+↓+ B →CO H NaAlO NaOHOH Al 2232)(++2.向一定量氢氧化钠溶液中滴加3AlCl 溶液 A →B O H NaCl NaAlO NaOHAlCl 223234+++B →CNaCl OH Al OH NaAlO AlCl 3)(4633223+↓++3.向一定量2NaAlO 溶液滴加盐酸溶液 A →BB →CO H AlCl OH Al HCl 2333)(3++4.向一定量HCl 溶液中逐滴加入2NaAlO 溶液 A →BO H AlCl HClOH Al 23333)(++B →CNaCl OH Al OH AlCl NaAlO 3)(4633232+↓++基础训练:1、加入强酸或强碱后都可以发生反应的离子是( ) A. Al 3+ B.HCO 3- C. AlO 2- D.CO 32-2、下列实验中,能产生白色沉淀后沉淀又溶解的是 ( ) A .NaOH 溶液中滴加AICl 3溶液至过量 B .A1Cl 3溶液中滴加NaOH 溶液至过量C .NaAIO 2溶液中滴加HCl 至过量D .HCI 溶液中滴加NaAlO 2溶液至过量3、下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )A .NaHSO 4和Ba(OH)2B .AlCl 3和NaOHC .NaAlO 2和H 2SO 4D .Ba(HCO 3)2和Ba(OH)24、向MgSO 4和Al 2(SO 4)3的混合溶液中, 逐滴加入NaOH 溶液。
下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH 溶液的体积, 纵坐标表示反应生成沉淀的质量) ( )。
5、把铝放入过量的NaOH 溶液中,发生反应的离子方程式为 。
若向反应后的溶液中通入足量的CO 2气体,出现的现象是 ;若向反应后的溶液中滴加盐酸,看到的现象是 。
能力提升:6、在3A lC l m ol a 溶液中,加入含NaOH mol b 的溶液,则下列对于Al 元素的存在情况,叙述不正确的是( )A .若3ba =,铝元素全部以3Al(OH)形式存在 B .若4b a =,铝元素全部以-2AlO 形式存在C .若34b a b <<,铝元素以+3Al 和-2AlO 形式存在D .若3b a <,铝元素以+3Al 和3Al(OH)形式存在7、把由23MgCl AlCl NaOH 、、三种固体组成的混合物溶于足量水中,有0.58g 白色难溶物析出,向所得的溶液中逐滴加入0.5mol/L 的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:(1)混合物中NaOH 的质量是 克;3AlCl 的质量是 克;2MgCl 的质量是 克。