第1讲 描述运专动题的3基 本水概溶念液中的离子反应
2 | 电离平衡常数的理解与应用 向两支分别盛有0.1 mol/L醋酸溶液和0.1 mol/L硼酸溶液的试管中滴加等浓度Na2 CO3溶液,观察现象。
第1讲 描述运专动题的3基 本水概溶念液中的离子反应
问题 1.查阅资料发现,醋酸、碳酸和硼酸在25 ℃时的电离平衡常数分别是1.75×10-5、 4.5×10-7(第一步电离)和5.8×10-10。它们的酸性强弱顺序是怎样的?有何规律? 提示:醋酸>碳酸>硼酸。在相同温度下,Ka越大,酸性越强。 2.根据问题1的分析,预测你能看到什么现象? 提示:试管1中有无色气体产生,试管2中没有明显现象。 3.在25 ℃时,H2CO3的电离平衡常数Ka1=4.5×10-7,Ka2=4.7×10-11,有人认为Ka1、Ka2差 别很大的主要原因是第一步电离产生的H+对第二步的电离起抑制作用。你认为 这种观点对吗?试从影响平衡常数因素的角度阐明你的观点。 提示:这种观点不正确。对于同一弱电解质的稀溶液来说,电离常数只与温度有 关,与溶液中的H+浓度无关。
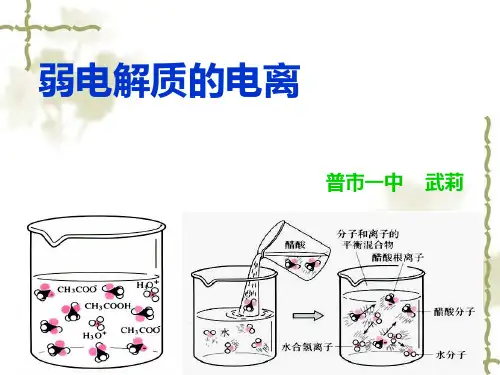
1 |强电解质和弱电解质
特别提醒 (1)电解质的强弱与溶液的导电能力没有必然联系。溶液的导电能力与离子浓度 和离子所带电荷数有关,强电解质溶液的导电能力不一定强。 (2)电解质的强弱与其溶解度无关。某些难溶盐,虽然溶解度小,但其溶于水的部 分完全电离,这类盐属于强电解质。有少数盐尽管能溶于水,但其在水溶液中只 有部分电离,属于弱电解质,如(CH3COO)2Pb等。
)
。
H++S2-,其电离常数表
第1讲 描述运专动题的3基 本水概溶念液中的离子反应
3.意义 表示弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越 大