实验室制氨气
- 格式:ppt
- 大小:109.00 KB
- 文档页数:7

实验室制取氨气装置
装置是铁架台,铁夹,酒精灯,两个大试管,棉花。
反应方程为:2NH4Cl+Ca(OH)2=2NH3+2H2O+CaCl2,条件是酒精灯加热,同时管口塞上少量棉花。
实验室制取氨气的方法主要是加热固体氯化铵与熟石灰的混合物,然后将气体收集起来。
实验室制取氨气的方法主要是加热固体氯化铵与熟石灰的混合物,然后将气体收集起来。
氨气(Ammonia),是一种无机化合物,化学式为NH3,分子量为17.031,无色、有强烈的刺激气味。
密度0.7710g/L。
相对密度0.5971(空气=1.00)。
易被液化成无色的液体。
在常温下加压即可使其液化(临界温度132.4℃,临界压力11.2兆帕,即112.2大气压)。
沸点-33.5℃。
也易被固化成雪状固体。
熔点-77.75℃。
溶于水、乙醇和乙醚。
在高温时会分解成氮气和氢气,有还原作用。
有催化剂存在时可被氧化成一氧化氮。
用于制液氮、氨水、硝酸、铵盐和胺类等。
可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的粘膜。

实验室制备氨气化学方程式实验室制备氨气是一种常见的化学实验,常用于教学和研究领域。
氨气是一种无色气体,具有刺激性气味,广泛应用于农业、医药和化工等领域。
制备氨气的主要方法是通过铵盐和碱的反应生成氨气。
一种常用的制备氨气的方法是通过铵盐和碱的反应。
以下是一种常见的制备氨气的化学方程式:NH4Cl + NaOH → NH3 + NaCl + H2O在这个反应中,铵盐NH4Cl和碱NaOH反应生成氨气NH3、氯化钠NaCl和水H2O。
这是一种酸碱中和反应,铵盐中的氨根离子和碱中的氢氧根离子结合生成氨气。
具体实验步骤如下:1. 准备所需实验器材,包括烧杯、漏斗、试管、热水浴等。
2. 将一定量的铵盐NH4Cl称入烧杯中。
3. 将一定量的碱NaOH溶解在适量的水中,得到NaOH溶液。
4. 将NaOH溶液缓慢滴加到含有铵盐的烧杯中,同时用漏斗收集生成的氨气。
5. 在收集氨气的试管中,加入一定量的氯化钠NaCl溶液,以吸附残留的氨气。
6. 经过一段时间,收集到足够的氨气后,将试管封闭。
这个实验过程中,铵盐NH4Cl和碱NaOH在水的存在下发生反应,生成氨气NH3、氯化钠NaCl和水H2O。
其中,氨气是无色气体,可以通过漏斗收集,而氯化钠溶液用于吸附残留的氨气,以避免对实验室环境造成污染。
通过这种方法制备氨气的优点是操作简单、成本低廉,适用于小规模的实验室制备。
然而,这种方法的缺点是制备氨气的效率不高,生成的氨气纯度较低。
总结来说,实验室制备氨气的化学方程式为NH4Cl + NaOH → NH3 + NaCl + H2O。
这个反应通过铵盐和碱的中和反应生成氨气,是一种常用的制备氨气的方法。
该实验步骤简单、成本低廉,适用于小规模的实验室制备。
然而,需要注意的是,制备氨气的纯度较低,可能需要进行进一步的纯化处理。


实验室制取氨气化学方程式
实验室制取氨气化学方程式
在实验室中,制取氨气是一项常见的实验操作。
通常,这种化合物用
于制作化肥等化学品。
本文将介绍实验室制取氨气的化学方程式。
制备氨气的方法有多种,其中一种是通过铁和氨盐的反应。
反应公式
如下:
Fe + 2NH4Cl → FeCl2 + 2NH3 + H2
这个实验中使用的铁粉和氨盐混合物经过反应会产生氨气和氯化亚铁。
另一种制备氨气的方法是通过氨水和碱金属或碱土金属的反应。
这种
反应需要在强碱条件下进行,具体公式如下:
Ca(OH)2 + 2NH4Cl → 2NH3 + CaCl2 + 2H2O
这种方法是靠氨水和氢氧化钙在互相作用的过程中来制备氨气的。
在实验室中,制取氨气需要注意以下几点:
首先,注意安全。
氨气是一种容易刺激眼睛和呼吸系统的有毒气体,
需要防护警告标识、手套和呼吸防护设备等。
同时,注意化学试剂的
使用量,保证反应的准确性和安全性。
其次,温度和压力也需要控制,以确保反应的稳定和产量的高效。
例如,在Ca(OH)2 + 2NH4Cl反应中,温度和氢氧化钙的浓度会对氨气的生成产生影响。
最后,对于反应结果的检验也是必要的。
可以使用试纸或其他化学测试方法检测氨气的生成和纯度。
综上所述,实验室制取氨气是一种有趣的化学实验,可以通过多种方法实现,其中最常见的是铁和氨盐反应以及氨水和碱金属或碱土金属的反应。
制取氨气需要注意安全、温度和压力的控制以及反应结果的检验。
这些注意事项的遵守可以确保实验的成功和安全。

实验室制备氨气方程式
氨气是日常实验室中一种必不可少的原料,实验室也可以制备氨气,即通过还原氰化氢制取氨气。
该反应方程式可表示为:2H2+2NaCN+H2O=2NH3+2NaOH。
该反应是一种绿色合成,可以使用温和容易获得的物质,如氰化氢、氢气和水。
它由两个步骤组成:首先,将氰化氢与氢气混合后用一定额定条件加热放置,使氰化氢还原;其次,加入纯水,完成氰化氢的还原和氨气的制备。
该反应只需温和的加热条件,避免了受振荡加热的改异而发生的爆炸。
反应过程中热量可被乳化剂或水排出,安全可靠,反应过程也比较快,效率高。
氨气反应非常容易,但是并不是所有实验室都能熟练操作这一反应。
在进行反应时,实验室需要准备好相关的安全防护措施,避免反应过程中的任何不安全的情况发生。
另外,实验室在进行氨气反应时,还需要注意原料的清洁度和容器的密封性,以确保操作质量。
最后,实验室还需要检查反应的积累物,比如氰化物的沉淀,并根据实验室常用的标准,判断氨气的质量。
在实验室制取氨气过程中,实验室需要注意多方面的事项,以确保制备出的氨气能达到实验要求的标准。
它不仅可以有效地提高实验效率,而且还能确保周围环境的安全。

氨气的实验室制法实验目的:1. 、掌握氨气的实验室制法,初步掌握氨气的性质及有关实验现象。
2、 进一步练习使用固固加热制取气体的操作。
实验原理:1、 实验室用消石灰与氯化铵在加热的条件下,反应制取氨气:Ca ( OH )2+2NH 4CI=CaCI 2+H 2O+2NH 3 f由于氨气极易溶于水溶于水,且密度比空气小,所以可以用向下排空气法收集二氨气。
2、 由于氨气溶于水后溶液变成碱性,所以可以用无色酚酞指示剂验证其碱性。
3、 氨气呈碱性,所以可以利用或者用湿润的红色石蕊试纸检验收集是否已满。
4、 氨气遇到浓盐酸产生大量白色的烟,也可以利用其性质来检验是否气体已满。
NH 3+HCI T NH 4CI5、氨气极易溶于水,因此可以利用其性质来进行倒扣实验。
实验药品:镊子、试管、导气管、硬质试管、铁架台、药匙、天平、酒精灯、水槽、火柴 固体粉末消石灰、氯化铵粉末、酚酞试剂、红色石蕊试纸实验装置:实验内容: 实验步骤实验现象 化学方程式1、 按图连接好实验装 置,并检查气密性。
2、 称取适量消石灰和氯 化铵粉末,混合,将 混合好的固体有纸槽 送入试管底部,连接 好装置,加热。
1、用酒精灯稍稍给大试 管加热,可以观察到水 槽中导气管口有气泡 冒出,移去酒精灯观察 到导气管口有倒吸。
观察到大试管中有大量水 珠生成。
Ca(OH0 2+2NH 4C 匸CaCI 2+H 2O+2NH 3 fNH 3+H 2O T NH 3 • H 2O讨论:⑴不能用 NH4NO3跟Ca(0H)2反应制氨气硝酸铵受撞击、加热易爆炸,且产物与温度有关,可能产生NH、N2、N2O NO(2) 实验室制 NHs不能用NaOH KOH代替Ca(OH) 2因为NaOH KOH是强碱,具有吸湿性(潮解)易结块,不易与铵盐混合充分接触反应。
又KOH NaOH具有强腐蚀性在加热情况下,对玻璃仪器有腐蚀作用,所以不用NaOH KOH 代替 Ca(OH)2 制 NH。

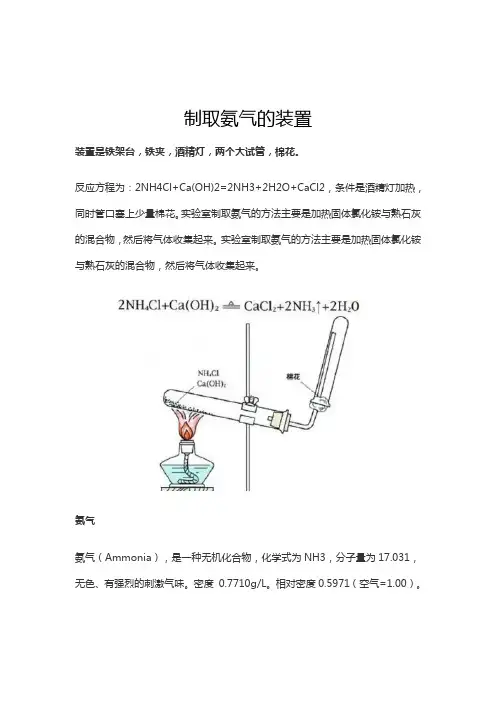
制取氨气的装置
装置是铁架台,铁夹,酒精灯,两个大试管,棉花。
反应方程为:2NH4Cl+Ca(OH)2=2NH3+2H2O+CaCl2,条件是酒精灯加热,同时管口塞上少量棉花。
实验室制取氨气的方法主要是加热固体氯化铵与熟石灰的混合物,然后将气体收集起来。
实验室制取氨气的方法主要是加热固体氯化铵与熟石灰的混合物,然后将气体收集起来。
氨气
氨气(Ammonia),是一种无机化合物,化学式为NH3,分子量为17.031,无色、有强烈的刺激气味。
密度0.7710g/L。
相对密度0.5971(空气=1.00)。
易被液化成无色的液体。
在常温下加压即可使其液化(临界温度132.4℃,临界压力11.2兆帕,即112.2大气压)。
沸点-33.5℃。
也易被固化成雪状固体。
熔点-77.75℃。
溶于水、乙醇和乙醚。
在高温时会分解成氮气和氢气,有还原作用。
有催化剂存在时可被氧化成一氧化氮。
用于制液氮、氨水、硝酸、铵盐和胺类等。
可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的粘膜。



氨气实验室制法方程式
氨气是一种无色、有刺激性气味的气体,广泛应用于化学、医药、农业等领域。
在实验室中,制备氨气的方法有多种,其中最常用的是氨水和氢氧化钠的反应。
氨水和氢氧化钠反应的化学方程式为:
NH3(aq) + NaOH(aq) → Na+(aq) + NH2-(aq) + H2O(l)
在这个反应中,氨水(NH3)和氢氧化钠(NaOH)反应生成氢氧化钠离子(Na+)和氨根离子(NH2-),同时释放出水分子(H2O)。
氨根离子和水分子之间的反应会产生氨气(NH3)。
这个反应的实验操作比较简单,只需要将氨水和氢氧化钠混合在一起,然后加热反应瓶底部,就可以观察到氨气的产生。
反应瓶的顶部可以连接到气体收集瓶中,收集氨气。
除了氨水和氢氧化钠反应,还有其他制备氨气的方法,比如铵盐和碱的反应、铝和氨水的反应等。
这些方法都有各自的优缺点,可以根据实验需要选择合适的方法。
总的来说,制备氨气的方法比较简单,但需要注意安全问题。
氨气有刺激性气味,容易引起呼吸道不适,因此在实验室中需要做好通风和防护措施。
同时,氨水和氢氧化钠都是腐蚀性物质,需要注意操作时的安全性。
在化学实验中,氨气的应用非常广泛,比如用于制备铵盐、氨基酸等化合物,也可以用于检测金属离子、酸碱度等。
因此,掌握氨气的制备方法和安全操作技巧对于化学实验人员来说非常重要。
《氨气的实验室制取与性质》实验教案氨气的实验室制取与性质1. 实验目的本实验旨在探究氨气的实验室制取方法以及其性质。
2. 实验原理氨气是一种无色气体,有刺激性气味。
在实验室中,常用氯化铵和氢氧化钠的反应制取氨气。
反应方程式如下:NH₄Cl + NaOH → NH₃↑ + H₂O + NaCl3. 实验步骤步骤一:制取氨气1. 取一烧杯,加入适量氯化铵和氢氧化钠;2. 加入足够的蒸馏水,搅拌至溶解;3. 在烧杯上盖上玻璃片做为蒸发盖,待室温下静置2小时;4. 装有塞子的试管插入试管架,将试管浸入烧杯中的溶液至一半;5. 加热烧杯,使溶液煮沸,然后用火把封闭试管口;6. 急冷烧杯,观察氨气生成情况。
步骤二:观察氨气性质1. 打开试管口,倾斜试管,用湿pH试纸浸入气体中;2. 观察试纸颜色变化,记录结果;3. 用玻璃棒蘸取一点氨水,放置在盛有盐酸的烧杯中,观察其反应情况。
4. 实验结果与讨论4.1 制取氨气根据实验步骤,成功制取了氨气。
在加热的过程中,氯化铵和氢氧化钠反应产生氨气,该气体经过急冷后收集在试管中。
4.2 氨气的性质根据湿pH试纸的颜色变化,可以得出氨气呈碱性。
此外,氨气与盐酸反应会产生白色氯化铵沉淀。
5. 安全注意事项1. 操作过程中需注意个人防护,避免氨气直接接触皮肤和眼睛;2. 加热时应小心操作,避免溅出或爆炸;3. 实验结束后,将试管中的氨气排空,避免滞留。
6. 结论通过本实验,制取了氨气并观察了其性质。
氨气表现出碱性,并能与盐酸反应产生氯化铵沉淀。
7. 参考文献[参考文献一][参考文献二][参考文献三]。
引言概述:氨气是一种常用的实验室气体,广泛应用于化学、环境科学、农业等领域。
本文将详细介绍氨气的实验室制备方法,以及相关的操作注意事项和安全措施。
正文内容:一、制备方法选择1.1氨气的传统制备方法1.1.1通过氨基酸的热分解制备氨气1.1.2通过铵盐的分解制备氨气1.1.3通过铝合金与碱的反应制备氨气1.2最新的氨气制备方法1.2.1电解法制备氨气1.2.2光照法制备氨气1.2.3催化法制备氨气二、传统制备方法的详细步骤2.1氨基酸的热分解制备2.1.1选择合适的氨基酸2.1.2调节反应条件2.1.3进行反应过程监控2.1.4分离纯化氨气产物2.2铵盐的分解制备2.2.1选择合适的铵盐2.2.2调节反应条件2.2.3进行反应过程监控2.2.4分离纯化氨气产物2.3铝合金与碱的反应制备2.3.1选择合适的铝合金和碱2.3.2调节反应条件2.3.3进行反应过程监控2.3.4分离纯化氨气产物三、最新制备方法的详细步骤3.1电解法制备3.1.1选择合适的电解质溶液3.1.2设置合适的电流密度和电解时间3.1.3采用合适的电极材料3.1.4分离纯化氨气产物3.2光照法制备3.2.1选择合适的催化剂和光源3.2.2设计合适的反应装置3.2.3控制反应条件3.2.4分离纯化氨气产物3.3催化法制备3.3.1选择合适的催化剂3.3.2调节反应条件3.3.3进行反应过程监控3.3.4分离纯化氨气产物四、操作注意事项和安全措施4.1实验室内通风保持良好4.2制备过程中避免产生气体泄漏4.3控制反应温度和压力4.4使用适当的工具和设备4.5防护措施和应急处理五、总结本文详细介绍了氨气的实验室制备方法,包括传统制备方法和最新的制备方法。
在选择制备方法时需要考虑反应条件、材料选择和产物纯化等因素。
同时,实验操作过程中需要注意安全措施和操作注意事项,以确保实验室操作的安全性和高效性。
随着科技的进步,氨气的实验室制备方法还会不断地发展和改进,为相关领域的研究和应用提供更好的条件和工具。