氨气的实验室制法
- 格式:ppt
- 大小:453.50 KB
- 文档页数:12


实验室制氨气的方程式实验室制备氨气的方程式是一项重要的化学实验,氨气是一种无色气体,具有刺激性的气味。
它在工业上广泛应用于制造化肥、合成纤维和制备其他化学物质。
制备氨气的方法有很多,其中最常用的方法是通过氨水和酸的反应来制备。
制备氨气的方程式可以表示为:NH3 + HCl → NH4Cl这是一种酸碱反应,反应物是氨水(NH3)和盐酸(HCl),生成物是氯化铵(NH4Cl)。
这个方程式表示了氨气的制备过程。
首先,我们需要准备氨水。
氨水是一种溶于水的氨气溶液,可以在化学实验室或药店购买到。
接下来,我们需要将氨水与盐酸混合。
在实验室中,我们通常会使用氯化铵作为制备氨气的反应物。
氯化铵是一种白色结晶固体,可以在化学实验室或药店购买到。
在制备氨气的过程中,氯化铵会与盐酸反应,产生氨气。
实验步骤如下:将一定量的氯化铵加入一个试管中。
慢慢加入盐酸到试管中,同时观察试管中的气体产生情况。
当试管中出现气泡并产生气体时,表示氨气已经制备成功。
在这个实验中,氯化铵和盐酸发生反应,产生氨气和水。
氨气是无色的气体,会从试管中释放出来。
由于氨气具有刺激性的气味,所以在实验过程中需要注意安全,避免吸入过多的氨气。
制备氨气的反应方程式是化学实验室中常用的一种方法。
通过这种方法,我们可以制备大量的氨气,用于工业生产或其他化学实验。
同时,这个实验也可以帮助学生理解酸碱反应和气体的制备过程。
总之,制备氨气的方程式是一种重要的化学实验,通过这个实验,我们可以制备出用于工业生产和其他化学实验的氨气。
这个实验需要注意安全,避免吸入过多的氨气。
同时,这个实验也可以帮助学生理解酸碱反应和气体的制备过程。

实验室制取氨气化学反应方程式《实验室制取氨气:神奇的化学反应》嘿,你知道吗?在实验室里,我们可以像变魔术一样制取氨气呢!这可太有趣啦。
氨气呀,是一种有特殊气味的气体。
就像你闻到臭鸡蛋味会皱眉头一样,氨气的味道也很刺鼻,不过这也让它特别好辨认。
那在实验室里到底怎么把它制取出来的呢?这就用到了一个超级酷的化学反应方程式:2NH₄Cl + Ca(OH)₂ = CaCl₂ + 2H₂O +2NH₃↑。
我来给你讲讲这个反应里的那些“小角色”吧。
氯化铵(NH₄Cl)就像是一个装满原料的小仓库。
它是白色的晶体,看起来普普通通的,可是在这个制取氨气的过程里,它可是非常重要的呢。
氢氧化钙(Ca(OH)₂)呢,就像一个得力的助手。
它是白色粉末状的固体。
这两个东西放在一起的时候啊,就像两个小伙伴手拉手,然后就发生了神奇的变化。
想象一下,氯化铵和氢氧化钙在试管里相遇,就像两个小战士开始执行任务。
它们开始互相作用,然后就产生了氯化钙(CaCl₂)。
氯化钙就像是这个反应的“副产品”,就像我们吃苹果削下来的苹果皮一样。
还有水(H₂O),水在这个反应里就像一个安静的旁观者,不过它也是这个反应的一部分呢。
最后就是我们的主角——氨气(NH₃)啦,它就像一个调皮的小精灵,从反应里冒了出来。
我记得有一次在实验室里,我和我的小伙伴们一起做这个制取氨气的实验。
我的同桌小明特别兴奋,他一边拿药品一边说:“哇,今天我们要把氨气这个小怪物给制造出来啦!”我笑着说:“哈哈,你可别把它想得太可怕,这是科学实验呢。
”我们小心翼翼地把氯化铵和氢氧化钙按照正确的比例混合在一起,就像厨师在精心调配食材一样。
当我们开始加热的时候,奇迹发生了。
我看到试管里开始有一些小气泡冒出来,我赶紧对旁边的小红说:“看呀,氨气要出来了,这就像魔法开始生效了一样呢!”小红也眼睛放光,说:“好神奇啊,这些小气泡就是氨气吗?”我回答说:“对呀,等会儿味道就出来啦,你就知道是它没错了。

实验室制取少量氨气的化学方程式实验室制取少量氨气的化学方程式如下:NH4Cl + NaOH → NH3 + H2O + NaCl这个方程式描述了氨气的制备过程。
首先,将氯化铵(NH4Cl)与氢氧化钠(NaOH)混合反应。
这个反应会产生氨气(NH3)、水(H2O)和氯化钠(NaCl)。
这个化学方程式可以通过以下几个步骤解释:1. NH4Cl溶于水形成氨氯化铵离子(NH4+和Cl-)。
这个盐类晶体是白色固体,常用于实验室中作为制备氨气的原料。
2. NaOH溶于水形成氢氧根离子(OH-)和钠离子(Na+)。
氢氧根离子是碱性的,它可以与氨氯化铵中的铵离子反应。
3. 在反应过程中,氢氧根离子与氨氯化铵中的铵离子发生置换反应。
氢氧根离子取代了铵离子,形成氨气和水。
4. 氨气是一种无色气体,具有刺激性气味。
它较轻,可以从反应混合物中逸出。
5. 同时,反应还产生了氯化钠,它是无色晶体盐。
通过这个化学方程式,我们可以看到氨气的制备过程。
实验室中可以根据需要控制反应物的量来制备所需的少量氨气。
此外,这个方程式还展示了化学反应中离子间的置换作用,以及气体的生成和溶液中盐类的生成。
这个方程式符合标题中心扩展的描述。
它描述了实验室制取少量氨气的化学过程,并提供了详细的反应方程式和解释。
通过这个方程式,读者可以了解氨气制备的基本原理和过程。
同时,文章结构清晰,使用了恰当的段落和标题,使得内容易于阅读和理解。
实验室制取少量氨气的化学方程式可以通过混合氯化铵和氢氧化钠来实现。
这个方程式描述了反应的具体过程,包括离子间的置换反应和气体的生成。
这个方程式符合标题中心扩展的要求,提供了清晰的解释和详细的描述。
通过这个方程式,读者可以更好地理解氨气制备的原理和过程。

中学化学氨气的实验室制法实验教案实验目的:通过实验,了解氨气的制备方法,掌握实验室制备氨气的基本步骤和操作技巧,培养实验操作和观察数据分析的能力。
实验器材:氨水(浓度为10%)、氢氧化钠固体、灼烧瓶、输液器、燃气瓶、玻璃棒。
实验原理:氢氧化钠固体和氨水反应得到氨气:2NH4OH(aq)→ (NH4)2O(g)+ H2O(g)实验步骤:1. 预备试剂:- 准备10%浓度的氨水溶液。
- 将适量的氢氧化钠固体放入灼烧瓶中备用。
2. 实验操作:- 将灼烧瓶放置在排风扇下方,确保使用实验室通风良好。
- 将氨水溶液倒入燃气瓶中。
- 将输液器的一端插入燃气瓶中,另一端悬空于灼烧瓶内。
- 用玻璃棒轻轻拨动灼烧瓶底部,使氢氧化钠颗粒与氨水溶液混合。
- 观察灼烧瓶中的实验现象,记录实验数据。
3. 实验注意事项:- 氨气具有刺激性气味,实验操作时要保持通风。
- 燃气瓶中的氨水溶液要小心倒入,避免溅出和直接接触皮肤。
- 操作完毕后,及时关闭燃气瓶和排风扇。
实验结果与数据记录:- 实验现象:在灼烧瓶中可以观察到气泡产生,并且有气味散发出来。
- 实验数据:记录气泡的产生时间,并记录气味的强烈程度。
实验讨论与分析:将氢氧化钠固体与氨水反应后,产生氨气和水蒸气。
由于氨气具有刺激性气味,实验中容易通过气味来判断氨气的产生是否成功。
实验数据中气泡的时间和气味的强烈程度可以作为判断氨气生成的依据。
实验延伸:- 观察氨气的可燃性,将一根点燃的火柴靠近灼烧瓶中的氨气,观察是否能够点燃气体。
- 探究氨气与一些酸性气体的反应,例如二氧化碳气体,观察是否产生反应。
实验安全性:- 实验操作中要保持通风,避免长时间接触氨气。
- 处理实验废液时要小心操作,避免溅出和直接接触皮肤。
实验总结:通过本次实验,我们成功地制备了氨气,并观察到了氨气产生的实验现象。
同时,我们了解了氨气的制备原理和实验操作技巧。
实验中要注意实验室的通风以及使用化学品时的安全操作。

氨的实验室制法化学方程式在实验室里,我们可得小心翼翼,像在做一个重要的实验,毕竟今天咱们要聊的可是氨的制法。
这玩意儿可是化学界的明星,特别是在农业和工业上可谓是无人不知,无人不晓。
说到氨,大家可能都知道它的化学式是NH₃,听起来是不是挺高大上的?但其实它的制作过程就像咱们在厨房做菜,简单又有趣。
咱们得准备点原料。
这里可得注意,氨的主要成分是氮和氢。
氮咱们可以从空气中获取,毕竟空气里有大约78%的氮气,真是大海捞针,唾手可得。
而氢气呢?可以通过水的电解来搞定,水就是生活的源泉,真是个好东西。
我们把水放在一个容器里,接上电,哇,气泡就冒出来了,这不就是氢气吗?别小看这些气泡,它们可是大有来头的。
好,材料都备齐了,接下来就是“厨艺”上场的时候了。
我们把氮气和氢气按照一定的比例混合,嘿,这时候就需要点高温和高压的“调味”了。
把这混合气体放在反应器里,像是把食材放进锅里,一开火,嘿,这火可得够猛,反应就开始了。
温度上升,压力增大,这时候的反应就像是过年的饺子,水开了,开始翻滚,翻腾得不亦乐乎。
过了一会儿,嘿,看看锅里,反应完毕,咱们的氨就“出锅”了。
它像个调皮的小家伙,马上要从反应器中冒出来。
不过可不能太急,这时候得把气体冷却一下。
冷却的过程就像是放凉蛋糕,慢慢让它沉淀下来,最终形成氨气。
轻轻一闻,哇,那个气味可真特别,虽说有点刺鼻,但真是浓烈的化学气息。
氨气出来后,咱们可得好好收拾一下。
可以通过吸收剂把它收集起来,常用的就是水,氨水可好用了。
这一过程就像是把新鲜的果汁装进瓶子里,得小心翼翼,别洒了,咱们可得把这“美味”好好珍藏。
氨水在咱们生活中可是处处可见,比如说清洁剂里,它的去污效果可是一绝。
哎,说到这,大家可能会想,氨到底有什么用呢?这可真是个好问题。
氨在农业上是个宝贝,作为化肥,它能让农作物长得更加旺盛。
氨里的氮元素是植物生长不可或缺的营养,种下去的种子就像是打了鸡血,噌噌长高。
工业上也离不开氨,它是合成各种化学品的基础原料,比如塑料、纤维、染料等,真是无处不在。

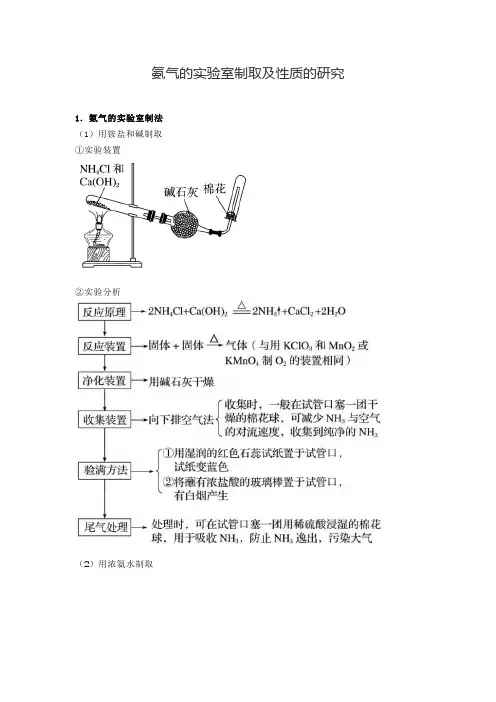
氨气的实验室制取及性质的研究1.氨气的实验室制法(1)用铵盐和碱制取①实验装置②实验分析(2)用浓氨水制取2.喷泉实验中学教材中喷泉实验装置如上图所示。
实验操作是:打开橡皮管上的夹子,挤压滴管的胶头,则烧杯中的水由玻璃管进入烧瓶,形成喷泉。
(1)喷泉实验的原理因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,大气压将烧杯中的水压入烧瓶而形成喷泉。
(2)能形成喷泉的条件从原理上讲,气体要易溶于水或易与水反应,以形成足够大的压强差;从实验条件上讲,烧瓶内气体要充满,气体和仪器均要干燥,装置的气密性要好。
(3)形成喷泉的气体与液体组合①极易溶于水的气体(NH3、HCl等)与水可形成喷泉;②酸性气体与NaOH溶液组合能形成喷泉。
(4)喷泉实验成功的关键①盛气体的烧瓶必须干燥;②气体要充满烧瓶;③装置不能漏气(实验前应先检查装置的气密性);④所用气体能大量溶于所用液体或气体与液体能快速反应。
(5)常见的喷泉实验装置喷泉实验的本质是形成压强差而引发液体上喷,为此可设计多种不同的装置和采用不同的操作(如使气体溶于水、热敷、生成气体、发生气体体积减小的反应等)来产生喷泉。
装置Ⅰ:打开止水夹,挤压胶头滴管的胶头,使少量水进入烧瓶,导致大量的NH3溶解。
烧瓶内形成负压而产生喷泉。
装置Ⅱ:挤压气球,即可使少量的溶液沿导管进入烧瓶,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。
装置Ⅲ:去掉了胶头滴管。
打开止水夹,用手(或热毛巾等)捂热烧瓶,氨气受热膨胀,使氨气通过导管与水接触,即产生喷泉。
(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶,烧瓶内氨气溶于水)装置Ⅳ:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明显增大,将液体压入烧瓶而产生喷泉。
装置Ⅴ:在水槽中加入使水温度升高的物质,致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置Ⅵ:向烧瓶中通入H2S(或SO2),然后通入SO2(或H2S),有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液喷到烧瓶内。

实验室制氨气【实验目的】1.掌握氨气的实验室制法。
2.建立实验室制备气体装置选择的思维模型。
3.培养学生科学探究与实验创新的化学核心素养。
【实验内容】(1)实验原理:(用化学方程式表示)(2)装置:①发生装置:固体 + 固体→气体(加热)②净化装置:通常用碱石灰干燥氨气,不能用五氧化二磷、浓硫酸和无水氯化钙干燥。
(3)实验操作a. 取少量固体于试管中;b. 滴加过量的浓NaOH溶液,并加热;c. 然后将湿润的红色石蕊试纸靠近试管口实验现象:产生无色刺激性气体,能使湿润红色石蕊试纸变蓝(4)收集方法:向下排空气法收集,试管口塞一团疏松的棉花团,目的是防止氨气与空气形成对流,以收集到较纯净的氨气。
(5)验满方法①方法一:用镊子夹住一片湿润的红色石蕊试纸放在试管口,若试纸变蓝,说明已经收集满。
②方法二:用蘸取浓盐酸的玻璃棒靠近试管口,若有白烟生成,说明已经收集满。
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O(6)尾气处理:多余的氨气要吸收掉(可在导管口放一团用水或稀硫酸浸润的棉花球)以避免污染空气。
在吸收时要防止倒吸,常采用的装置如图所示:【思考讨论】1、试管口为什么向下倾斜?避免试管中水蒸气冷凝后形成水珠,倒流至试管底部使试管受热不均而炸裂。
2、棉花的作用是什么?若为干燥的棉花则起到减缓氨与空气对流的作用;若为蘸有水或稀硫酸的棉花,则还可以吸收多余的NH3。
3、收集的氨气如何干燥?碱石灰(固体氧化钙、固体氢氧化钠)不能用无水CaCl2干燥NH3(形成CaCl2· 8NH3),不能用浓硫酸和P2O5干燥氨气4、多余的氨气如何处理?用浓硫酸(或水)吸收多余的氨气【特别提醒】①本实验中试剂的选取:NH4Cl可用(NH4)2SO4等代替,但不能用NH4HCO3或NH4NO3代替,因为NH4HCO3、NH4NO3受热分解产生杂质气体。
②消石灰不能用KOH或NaOH代替,因为KOH和NaOH易吸水、易结块,不利于产生NH3,且高温下腐蚀试管。

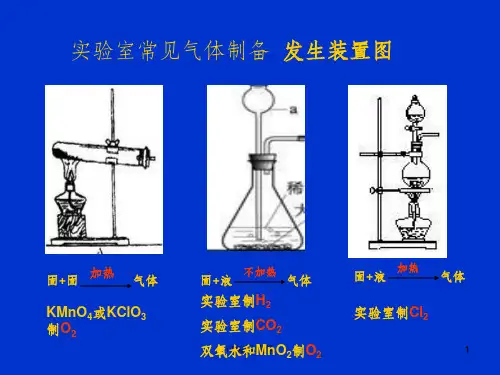
常见气体的实验室制法
实验室中常用气体的制法
在实验室中,我们经常需要使用各种气体来进行实验研究。
以下介绍几种常见气体的实验室制法。
1. 氧气(O2)制法
氧气可以通过加热氢氧化物(如KClO3)制得。
首先,将粉末的KClO3放入试管中,并加热至其熔化和分解。
氧气在这种反应中被释放出来,可以通过将反应管插入水中捕集。
KClO3 → KCl + 3/2 O2
2. 氢气(H2)制法
氢气可以通过金属与酸反应制得。
将锌粉加入稀盐酸中,产生的氢气可以通过在反应瓶中收集。
Zn + 2HCl → ZnCl2 + H2
3. 氨气(NH3)制法
氨气可以由铵盐的碱化反应制得。
将氨水和氢氧化铵混合,在通入稀盐酸时产生氨气。
反应液中剩余的氢氧化铵可以排入排水管中。
NH4OH + NH4Cl + HCl → NH3 + H2O + NH4Cl
4. 氯气(Cl2)制法
氯气可以通过加热混合物(如氯化铁和硫酸)而制得。
将磨碎的氯化铁混合稀硫酸,然后加热。
氯气随热量被释放出来,并可以通过在反应瓶中收集来进行捕获。
2FeCl3 + 6H2SO4 → 2FeSO4 + 6HCl + 3H2SO4 + 3O2
以上是几种常见气体的实验室制法。
在实验室制取气体时,应当注意实验室安全并正确地进行操作。
同时,制得的气体也应该妥善处理,避免对环境和人体造成不良影响。