2005版药典药品微生物限度检查法
- 格式:ppt
- 大小:462.00 KB
- 文档页数:83


微⽣物限度检查概述及⽅法微⽣物限度检查概述及⽅法第⼀部分药品微⽣物限度检查原理;⼀微⽣物学基本原理(⼀)、微⽣物的概念和类别;所谓微⽣物(microorgamisms)是⼀群个体微⼩结构简单⾁眼不能直接看到,必须借助显微镜以及其它⼿段才能辨别微⼩⽣物。
1、结构类型按微⽣物细胞结构和组成不同可分原核细胞型微⽣物:代表(细菌)真核细胞型微⽣物:代表(真菌)⾮细胞型微⽣物:代表(病毒)2、营养类型根据微⽣物的不同营养要求,可分为⾃养型和异养型两类,⼜以所利⽤能源的来源不同,分为化能营养型和光能营养型。
药品中所污染的微⽣物,从营养型⾓度看,他⼤多数异养型,且以腐⽣性和兼性寄⽣性化能异养型为主,容易⽤⼈⼯培养繁殖,是药品进⾏⽆菌及限度检查的最基本原理。
3、影响微⽣物⽣长繁殖的因素1)物理因素:温度、湿度、渗逶压、辐射2)化学因素:营养物质、酸碱度、氧、有毒物质:其影响微⽣物⽣长的机制主要有a 使菌体蛋⽩变性或沉淀b ⼲扰微⽣物酶系统各的影响其代谢c 损伤微⽣物细胞膜,使内容物逸出。
3)⽣物因素。
在微⽣物之间,微⽣物与寄主动植物之间均存在着各种互相作⽤的关系,主要为寄⽣、共⽣、拮抗关系等。
噬菌体与寄主菌、细菌素对某些细菌的抗菌作⽤,就是⽣物因素的具体表现。
四、微⽣物代谢及其在⽣长检定中的意义微⽣物⽣化鉴定试验,所使⽤的基本原理,就是利⽤微⽣物所物有的代谢反应,其中⼤部分波及到酶的反应1)微⽣物主要代谢内容A、呼吸作⽤-根据微⽣物呼吸作⽤最终电⼦受体性质分为呼吸作⽤,⽆氧呼吸作⽤及发酵作⽤三种,⽆本质区别,都是物质被氧化,同时另⼀物质被还原只是物质被氧化分解程度和释放⽔平不同。
相关的⽣化鉴反应如过氧化氢酶试验,硝酸盐还原试验,氰化钾试验等。
B、糖的分解有关的⽣化鉴定反应如糖(醇、苷)类发酵试验,葡萄糖的氧化/发酵试验,甲基试验,甲基红试验,VP试验C、蛋⽩质和氨基酸的分解相关⽣化鉴定试验如吲哚试验、明胶液化试验、硫化氢试验等。




中国药典微生物限度检查法
中国药典是中华人民共和国国家药品监督管理局编制的用于药品质量标准和规范的权威性文献。
其中,微生物限度检查是对药物产品中的微生物污染进行评估和控制的重要环节。
中国药典中的微生物限度检查法主要包括以下几个方面:
1.检测项目:微生物限度检查主要关注细菌、真菌和酵母菌
的存在与数量。
通常会检测大肠杆菌、铜绿假单胞菌、霉
菌和酵母菌等常见微生物。
2.样品准备:样品准备过程中,要根据具体要求制备适当稀
释的样品溶液。
根据不同产品的特点和要求,可能需要使
用适当的培养基进行预处理。
3.检测方法:中国药典中提供了一系列的微生物限度检测方
法,包括涂片法、水洗法、滤膜法等。
这些方法可以根据
不同的样品类型和特性选择适合的检测方法。
4.培养和观察:按照检测方法的要求,将样品接种在适当的
培养基上,进行培养并观察一定时间。
观察期间,需要注
意各种细菌、真菌和酵母菌的生长情况。
5.计数和判定:根据培养结果,进行微生物数量的计数,并
与规定的限度标准进行比较。
根据比较结果,判定样品是
否符合微生物限度标准。
通过微生物限度检查,可以评估药物产品中的微生物污染状况,并确保其在接受者使用时的安全性。
中国药典中的微生物限度
检查法为药品质量控制提供了重要的指导和标准。

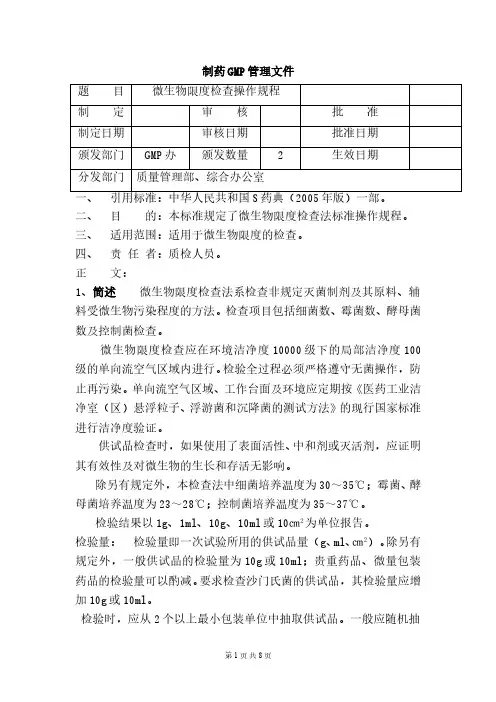
制药GMP管理文件题 目微生物限度检查操作规程制 定审 核批 准制定日期审核日期批准日期颁发部门GMP办 颁发数量2生效日期分发部门质量管理部、综合办公室一、引用标准:中华人民共和国S药典(2005年版)一部。
二、目 的:本标准规定了微生物限度检查法标准操作规程。
三、适用范围:适用于微生物限度的检查。
四、责 任 者:质检人员。
正 文:1、简述 微生物限度检查法系检查非规定灭菌制剂及其原料、辅料受微生物污染程度的方法。
检查项目包括细菌数、霉菌数、酵母菌数及控制菌检查。
微生物限度检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内进行。
检验全过程必须严格遵守无菌操作,防止再污染。
单向流空气区域、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度验证。
供试品检查时,如果使用了表面活性、中和剂或灭活剂,应证明其有效性及对微生物的生长和存活无影响。
除另有规定外,本检查法中细菌培养温度为30~35℃;霉菌、酵母菌培养温度为23~28℃;控制菌培养温度为35~37℃。
检验结果以1g、1ml、10g、10ml或10㎝2为单位报告。
检验量: 检验量即一次试验所用的供试品量(g、ml、㎝2)。
除另有规定外,一般供试品的检验量为10g或10ml;贵重药品、微量包装药品的检验量可以酌减。
要求检查沙门氏菌的供试品,其检验量应增加10g或10ml。
检验时,应从2个以上最小包装单位中抽取供试品。
一般应随机抽取不少于检验用量(两个以上最小包装单位)的3倍量供试品。
2、供试液的制备根据供试品的理化特性与生物学特性,采取适宜的方法制备供试液。
供试液制备若需用水浴加温时,温度不应超过45℃供试液从制备至加入检验用培养基,不得超过1小时。
除另有规定外,常用的供试液制备方法如下。
(1),液体供试品 取供试品10ml,加PH7.0无菌氯化钠-蛋白胨缓冲液至100ml,混匀,作为1:10的供试液了。


《中华人民共和国药典》2005年版一部勘误表页数品名误正11三七【含量测定】测定法“…三者的总量不得少于5.0%。
”【含量测定】测定法“…的总量不得少于5.0%。
”20山豆根【含量测定】第8行“…吸取供试品溶液2~6μl,”【含量测定】第8行“…精密吸取供试品溶液2~6μl,”27川乌【鉴别】(3)“加硫酸液(0.25mol/L)20ml,”【鉴别】(3)“加0.25mol/L 硫酸液20ml,”41云芝【含量测定】单糖精密量取总糖项下的滤液40ml,按总糖项下方法,自“加酚酞指示液l~2滴……”起,同法操作。
【含量测定】单糖精密量取总糖项下的滤液40ml,加酚酞指示液l~2滴,用氢氧化钠试液调节pH值至中性,按总糖项下方法,自“精密加入碘滴定液(0.1mol/L)25m1……”起,同法操作。
52丹参【检查】重金属及有害元素照铅、镉、砷、汞、铜测定法(附录ⅨB原子吸收分光光度法或附录ⅪD电感耦合等离子体质谱法)测定,【检查】重金属及有害元素照铅、镉、砷、汞、铜测定法(附录ⅨB原子吸收分光光度法或电感耦合等离子体质谱法)测定,56水飞蓟【含量测定】第4行“理论板数按水飞蓟宾或异水飞蓟宾峰计算应不低于5000。
”【含量测定】第4行“理论板数按水飞蓟宾峰计算应不低于5000。
”第6行“精密称取水飞蓟宾和异水飞蓟宾混合对照品12mg,”第6行“精密称取水飞蓟宾对照品12mg,”第15行“以水飞蓟宾和异水飞蓟宾峰面积之和计算,”第15行“以水飞蓟宾两个峰面积之和计算,”57水蛭【含量测定】公式中“W”[删去]第16行“W—取样量。
”59甘草【检查】重金属及有害元素照铅、镉、砷、汞、铜测定法(附录ⅨB原子吸收分光光度法或附录ⅪD电感耦合等离子体质谱法)测定,【检查】重金属及有害元素照铅、镉、砷、汞、铜测定法(附录ⅨB原子吸收分光光度法或电感耦合等离子体质谱法)测定,60甘草【含量测定】甘草苷第9行“再称重”【含量测定】甘草苷第9行“再称定重量”第14行“含甘草甘( C21H22O9) 不得少于1.0%”第14行“甘草苷( C21H22O9) 不得少于1.0%”63石膏【检查】砷盐“依法检查(附录ⅨF),”【检查】砷盐“依法检查(附录ⅨF第二法),”68白术【鉴别】(2)“…在与对照品色谱相应的位置上,”【鉴别】(2)“…在与对照药材色谱相应的位置上,”69白芍【检查】重金属及有害元素照铅、镉、砷、汞、铜测定法(附录ⅨB原子吸收分光光度法或附录ⅪD电感耦合等离子体质谱法)测定,【检查】重金属及有害元素照铅、镉、砷、汞、铜测定法(附录ⅨB原子吸收分光光度法或电感耦合等离子体质谱法)测定,81地龙【检查】重金属“…依法检查(附录ⅨE),”【检查】重金属“…依法检查(附录ⅨE第二法),”86西瓜霜【检查】重金属“含量金属不得过百万分之十。

二 部凡例目次(增修订的附录)附录Ⅰ制剂通则Ⅰ A 片剂Ⅰ B 注射剂Ⅰ C 酊剂Ⅰ D 栓剂Ⅰ E 胶囊剂Ⅰ F 软膏剂乳膏剂糊剂Ⅰ G 眼用制剂Ⅰ H 丸剂Ⅰ J 植入剂(增订)Ⅰ K 糖浆剂Ⅰ L 气雾剂粉雾剂喷雾剂Ⅰ M 膜剂Ⅰ N 颗粒剂Ⅰ O 口服溶液剂口服混悬剂口服乳剂Ⅰ P 散剂Ⅰ Q 耳用制剂Ⅰ R 鼻用制剂Ⅰ S 洗剂冲洗剂灌肠剂Ⅰ T 搽剂涂剂涂膜剂Ⅰ U 凝胶剂Ⅰ V 贴剂附录Ⅳ分光光度法Ⅳ A 紫外-可见分光光度法Ⅳ C 红外分光光度法Ⅳ D 原子吸收分光光度法Ⅳ E 荧光分析法Ⅳ F 火焰光度法附录Ⅴ色谱法Ⅴ B 薄层色谱法Ⅴ D 高效液相色谱法Ⅴ E 气相色谱法Ⅴ G 毛细管电泳法Ⅴ H 分子排阻色谱法附录ⅥⅥ E 旋光度测定法Ⅵ G 黏度测定法Ⅵ H pH值测定法附录ⅦⅦ H 脂肪与脂肪油测定法附录ⅧⅧ L 干燥失重测定法Ⅷ N 炽灼残渣检查法Ⅷ P 残留溶剂测定法(原有机溶剂残留量测定法)Ⅷ Q 热分析法Ⅷ R 制药用水中总有机碳测定法(增订)附录ⅨⅨ A 溶液颜色检查法Ⅸ C 注射剂中不溶性微粒检查法Ⅸ D 结晶性检查法Ⅸ E 粒度和粒度分布测定法Ⅸ F X射线粉末衍射法Ⅸ G 渗透压摩尔浓度测定法Ⅸ H 可见异物检查法(原澄明度检查法)Ⅸ J 质谱法(增订)附录ⅩⅩ A 崩解时限检查法Ⅹ C 溶出度测定法Ⅹ D 释放度测定法Ⅹ E 含量均匀度检查法Ⅹ G 片剂脆碎度检查法Ⅹ H 吸入气雾剂、吸入粉雾剂、吸入喷雾剂的雾滴(粒)分布测定法Ⅹ J 锥入度测定法(增订)Ⅹ K 贴剂黏附力测定法(增订)附录ⅪⅪ A 抗生素微生物检定法Ⅺ C 异常毒性检查法Ⅺ D 热原检查法Ⅺ E 细菌内毒素检查法Ⅺ G 降压物质检查法Ⅺ H 无菌检查法Ⅺ J 微生物限度检查法Ⅺ K 过敏反应检查法(增订)附录ⅫⅫ O 降钙素生物检定法(增订)Ⅻ P 生长激素生物测定法(增订)附录ⅩⅥ制药用水附录ⅩⅦ灭菌法附录ⅩⅨⅩⅨ A 药品质量标准分析方法验证指导原则ⅩⅨ B 药物制剂人体生物利用度和生物等效性试验指导原则ⅩⅨ C 原料药与药物制剂稳定性试验指导原则ⅩⅨ D 缓释、控释和迟释制剂指导原则ⅩⅨ E 微囊、微球与脂质体制剂指导原则ⅩⅨ F 药品杂质分析指导原则(增订)ⅩⅨ G 正电子类放射性药品质量控制指导原则(增订)ⅩⅨ H 含锝[99m Tc]放射性药品质量控制指导原则(增订)ⅩⅨ J 药物引湿性指导原则(增订)返回顶端凡 例《中华人民共和国药典》简称《中国药典》,是国家监督管理药品质量的法定技术标准。