配位反应的副反应和副反应系数
- 格式:ppt
- 大小:294.00 KB
- 文档页数:69
![[所有分类]第9章 配位反应知识分享](https://uimg.taocdn.com/694ff50cba68a98271fe910ef12d2af90242a8eb.webp)

大学分析化学—名词解释误差和分析数据处理:准确度:分析结果与真实值接近的程度,其大小可用误差表示。
精密度:平行测量的各测量值之间互相接近的程度,其大小可用偏差表示。
系统误差:是由某种确定的原因所引起的误差,一般有固定的方向(正负)和大小,重复测定时重复出现。
包括方法误差、仪器或试剂误差及操作误差三种。
偶然误差:是由某些偶然因素所引起的误差,其大小和正负均不固定。
空白试验:在不加入试样的情况下,按与测定试样相同的条件和步骤进行的分析试验,称为空白试验。
有效数字:是指在分析工作中实际上能测量到的数字。
通常包括全部准确值和最末一位欠准值(有±1个单位的误差)。
t分布:指少量测量数据平均值的概率误差分布。
可采用t分布对有限测量数据进行统计处理。
置信水平与显著性水平:指在某一t值时,测定值x落在μ±tS范围内的概率,称为置信水平(也称置信度或置信概率),用P表示;测定值x落在μ±tS范围之外的概率(1-P),称为显著性水平,用α表示。
置信区间与置信限:系指在一定的置信水平时,以测定结果x为中心,包括总体平均值μ在内的可信范围,即μ=x±uσ,式中uσ为置信限。
分为双侧置信区间与单侧置信区间。
显著性检验:用于判断某一分析方法或操作过程中是否存在较大的系统误差和偶然误差的检验。
包括t检验和F检验。
滴定分析法概论:滴定度:是每毫升标准溶液相当于被测物质的质量(g或mg),以符号T T/B表示,其下标中T、B分别表示标准溶液中的溶质、被测物质的化学式。
T T/B=m B/V T,单位为g/ml或mg/ml 分布系数:是溶液中某型体的平衡浓度在溶质总浓度中所占的分数,又称为分布分数以δi 表示。
化学计量点:滴定剂的量与被测物质的量正好符合化学反应式所表示的计量关系的一点。
滴定终点:滴定终止(指示剂改变颜色)的一点。
滴定误差:滴定终点与化学计量点不完全一致所造成的相对误差。
可用林邦误差公式计算。



第7章 配位滴定法一、考试大纲要求(一)掌握1.掌握EDTA 滴定法的基本原理,能正确选择滴定条件。
2.掌握指示剂变色原理。
3.掌握EDTA 标准溶液的配制、标定。
(二)熟悉1、熟悉常用金属指示剂变色范围和使用条件。
2、熟悉Ca 2+、Mg 2+、Zn 2+、Al 3+等离子的测定。
(三)了解了解滴定终点误差。
二、重点与难点(一)重点1.配合物的条件稳定常数:条件稳定常数的计算和应用。
2.配位滴定法滴定曲线:滴定曲线的计算、突跃范围、化学计量点pM /值。
3.金属指示剂:变色原理、应用条件、应用对象。
4.标准溶液的配制与标定:基准物、标定条件。
5.滴定方式:滴定方式的选择、条件控制和应用范围。
(二)难点1.配位反应的副反应及副反应系数:副反应类型、副反应系数的计算。
2.滴定条件的选择:滴定终点误差、酸度的选择、掩蔽剂的选择。
三、主要公式1.金属-EDTA 配合物的稳定常数 ]][[][Y M MY K MY =2.累积稳定常数 nn n n L M ML K K K L M ML K K L M ML K ]][[][]][[][]][[][212221211======βββ3.各级配合物的浓度与游离金属离子浓度[M]和游离配合剂浓度[L]的关系nn n L M ML L M ML L M ML ]][[][]][[][]][[][2221βββ===4.副反应系数 ][][Y Y Y '=α 5.弱酸的酸效应系数6656546543654326543212345(H)6[H ][H ][H ][H ][H ]1[H ]Y a a a a a a a a a a a a a a a a a a a a a K K K K K K K K K K K K K K K K K K K K K α++++++=++++++6.共存离子效应系数 NY N Y K N ][1)(+=α7.滴定体系中同时发生酸效应和共存离子效应,则总的副反应系数 1)()(-+=NY Y H Y Y ααα 8.单一金属离子M 的副反应系数 n n L M L L L ][][][1221)(βββα++++= 9.多种金属离子的总副反应系数 )1()()(21P L M L M M -+++= ααα10.条件稳定常数:]][[][Y M Y M K MY'''=' MY Y M MY MYK K αααlg lg lg lg lg +--=' 11.化学计量点时金属离子的浓度 )lg (21][)()(MYsp M MYsp M sp K pC M p K C M '+=''=' 12.终点时金属离子的浓度 ()p lg lg t MIn In H M K α=- 13.林邦(Ringbom )误差公式 %1001010)(//⨯'-=∆-∆MYsp M pMpM K C TE四、例题详解1.在pH =10.0的缓冲介质中,以0.01000mol/L 的EDTA 滴定50.00mL 同浓度金属离子M 2+溶液,已知在此条件下配位反应进行完全,当加入EDTA 溶液从49.95mL 到50.05mL 时,计量点前后的pM 改变了2个单位,计算配位化合物MY 2—的稳定常数K MY 为若干。





第十二章配位滴定法§12-1 概述配位滴定法是以配位反应为基础的滴定分析方法。
它是用配位剂作为标准溶液直接或间接滴定被测物质。
在滴定过程中通常需要选用适当的指示剂来指示滴定终点。
本章重点介绍以乙二胺四乙酸(EDTA)为滴定剂的配位滴定分析方法。
一、配位滴定剂(EDT A)大多数金属离子都能与多种配位剂形成稳定性不同的配合物,但不是所有的配位反应都能用于配位滴定。
能用于配位滴定的配位反应除必须满足滴定分析的基本条件外,还能生成稳定的、可溶于水的中心离子与配体比例恒定的配合物。
由多基配体与金属离子形成的具有螯合环结构的配合物称为螯合物。
螯合物稳定性高,螯合比恒定,能满足滴定分析的基本要求。
目前应用最多的滴定剂是乙二胺四乙酸等氨羧有机配位体,它们能与大多数的金属离子形成稳定的可溶的螯合物,能满足配位滴定的要求。
因此配位滴定法主要是指形成螯合物的配位滴定法。
乙二胺四乙酸简称EDTA,或EDTA酸,常用H4Y表示。
其结构式为:在水溶液中,乙二胺四乙酸两个羧基上的质子转移到氮原子上,形成双偶极离子:在酸度较高的溶液中,H4Y的两个羧基可再接受两个H+而形成H6Y2+,这样它就相当于一个六元酸,有六级离解平衡。
H4Y在水中的溶解度低(22 0C时每100ml水溶解0.02g),所以常用的是其二钠盐Na2H2Y·2H2O,(也称EDTA)作为滴定剂。
它在水溶液中的溶解度较大,22 0C时每100ml水可溶解11.2g,此时溶液的饱和浓度约为0.3mol·L-1,pH值约为4.4。
在水溶液中,EDTA有H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-、Y4-七种型体存在,但是在不同的酸度下,各种型体的浓度是不同的,他们的浓度分布与溶液pH的关系如图12-1所示。
由图可见,在pH<1的强酸性溶液中,EDTA主要以H6Y2+型体存在;在pH为2.67~6.16的溶液中,主要以H2Y2-型体存在;在pH>10.26的碱性溶液中,主要以Y4-型体存在。
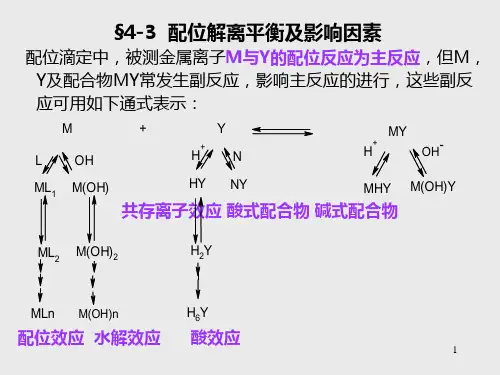
2.2化学平衡目录目录C O N T E N T S配位反应与配位剂01EDTA与金属离子的配合物及其稳定性02外界条件对EDTA与金属离子配合物稳定性的影响03条件稳定常数04M + Y == MY 待测物滴定剂(M 为金属离子,Y 为配位剂)1.无机配位剂Cu NH 33H 3NH 32+(如F -, NH 3, SCN -, CN -, Cl -)● 形成的配合物不稳定● 存在逐级配位现象2.有机配位剂CH 22H 2NN H 2CuH 2CH 2H 2NN H 2● 多齿配体,形成鳌合物,络合物的络合比固定● 鳌合物稳定高,络合反应完全程度高;可以得到明显的滴定终点(如乙二胺en ,草酸根等)一、配位反应与配位剂*氨羧配位剂*u 含有氨基二乙酸-N(CH 2COOH)2基团的有机配位剂。
u 含有络合能力很强的氨氮、羧氧两种配位原子,几乎能与所有的金 属离子络合形成的稳定络合物。
u 种类很多,近四十种,应用最广泛的是乙二胺四乙酸。
E thylene d iamine t etraacetic a cid, EDTA:··::::1. EDTA 的性质H 4Y + 2H + == H 6Y2+(1)在水中的溶解度很小,其二钠盐 Na 2H 2Y·2H 2O 溶解度大 (饱和溶液浓度0.3 mol·L -1,pH 约为4.5)(2) 六元酸,可用 H 6Y 2+ 表示,有六级解离和七种存在形式。
H 6Y 2+H 5Y +H 4Y H 3Y -H 2Y 2-HY 3-Y 4-p K a1=0.9p K a2=1.6p K a3=2.07p K a4=2.75p K a5=6.24p K a6=10.34二、EDTA 与金属离子的配合物及其稳定性pH < 1 强酸性溶液→ H 6Y 2+ pH 2.67~6.16 → 主要 H 2Y 2- pH > 10.26碱性溶液 → Y 4-最佳配位型体配合物的稳定性受到酸度的严重影响!各型体浓度取决于溶液pH 值2. EDTA 与金属离子的配合物性质 [M][Y][MY]K 稳p与大多数金属离子都能形成配位比为1∶1的配合物;p与大多数金属离子形成的配合物具有较大的稳定性(形成五元环结构);p 反应快,络合物大多带电荷,水溶性好;p无色金属离子形成无色螯合物,有色金属离子形成有色螯合物。
副反应系数的定义公式
1.线性关系的副反应系数:
在线性关系中,副反应系数可以通过斜率来表示。
设输入变量为X,
输出变量为Y,副反应系数为C。
则副反应系数C可以通过以下公式计算:C=ΔY/ΔX
其中,ΔY表示输出变量Y的变化量,ΔX表示输入变量X的变化量。
此处的副反应系数C即为线性关系的斜率。
2.非线性关系的副反应系数:
非线性关系中,副反应系数可以通过变化率来表示。
设输入变量为X,输出变量为Y,副反应系数为C。
则副反应系数C可以通过以下公式计算:C=dY/dX
其中,dY表示输出变量Y的微小变化量,dX表示输入变量X的微小
变化量。
此处的副反应系数C即为非线性关系的变化率。
3.电子学中的副反应系数:
在电子学中,副反应系数可以用来描述电路中不同元件之间的相互作用。
常见的副反应系数包括α(增益衰减系数)和β(电流分配系数)。
α是指输入电流与输出电流之间的关系。
设输入电流为I_in,输出
电流为I_out,副反应系数为α。
则副反应系数α可以通过以下公式计算:
α = I_out / I_in
β是指输入电流与输出电压之间的关系。
设输入电流为I_in,输出电压为V_out,副反应系数为β。
则副反应系数β可以通过以下公式计算:
β = V_out / I_in
这些公式提供了副反应系数的一些定义和计算方式。
根据实际问题和所研究的系统,可以选择合适的公式来计算副反应系数。
副反应系数的值可以用于分析系统的响应和相互作用,对于控制系统和信号处理系统等领域非常重要。