过渡期元素核外电子排布
- 格式:doc
- 大小:27.00 KB
- 文档页数:3

原子核外电子排布与元素周期律一、核外电子的排布规律⑴核外电子运动的特征:质量小,运动空间小,运动速度快,没有确定的轨道。
(2)电子云:电子在核外空间作高速运动,没有确定的轨迹,好象带负电荷的云雾笼罩在原子核的周围,人们形象地称之为电子云。
(3)电子层:根据电子的能量差别和通常运动区域离核的远近不同,核外电子处于不同的电子层。
(4)电子层排布倾向能量最低:核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量逐步升高的电子层里。
(5)各电子层容纳的电子数:各电子层最多容纳的电子数是2n 2个,最外层电子数不超过8个(K 层不超过2个),次外层电子数不超过18个,倒数第三层不超过32个。
(6)电子层排布的表示方法:原子结构示意图1、排布规律⑴核外电子排布与能量关系电子离核距离: 近 → 远 电子能量: 低 → 高 ⑵核外电子的分层排布 ① 核外电子层能量不同 电子层离核距离: 近 → 远 电子能量: 低 → 高电子层数(n ): 1 (K) 2(L) 3 (M) 4 (N) 5 (O)② 电子排布规律Ⅰ 能量最低原理:先排满低能量电子层,再依次排布在能量较高的电子层中。
Ⅱ 各电子层最多容纳的电子数:2n 2 Ⅲ 最外层电子数≤8 Ⅳ 次外层电子数≤18 Ⅴ 倒数第三层电子数≤32注意:以上三条规律不是孤立的,而是相互制约,必须同时满足。
2、常见元素微粒结构特点稀有气体元素原子的电子层结构与同周期的非金属元素的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同。
如:(1)核外有2个电子微粒(与He 原子电子层结构相同的离子):H -、Li +、Be 2+ (2)核外有10个电子微粒(与Ne 原子电子层结构相同的微粒):阳离子:+Na 、+2Mg 、+3Al 、+4NH 、+O H 3;阴离子:N -3、O -2、F -、OH -、NH -2;分子:Ne 、HF 、H 2O 、NH 3、CH 4(3)核外有18个电子微粒(与Ar 原子电子层结构相同的微粒):离子:Cl -、S 2-、P 3-、K +、Ca 2+ 分子:Ar 、HCl 、H 2S 、SiH 4、H 2O 2、PH 3、C 2H 6 (4)前18号元素的原子构的特殊性○111 H ○2最外层有1个电子的元素:H 、Li 、Na ○3最外层有2个电子的元素:Be 、Mg 、He ○4最外层电子数等于次外层电子数的元素:Be 、Al 。

过渡元素核外电子排布规律
过渡元素的核外电子排布规律为:①都是1s,②均不稳定.1、过渡元素原子中的s 电子数比较少,一般只有2~3个,故在形成化合物时其电子排布都具有共同性质—单核外s 电子为满壳层结构;2、过渡元素的最高正氧化态为+7价,其最低氧化态为-3价,从而使得这些元素形成离子化合物或过氧化物时,其核外电子排布呈周期性变化.
a、c、d 三种元素的原子核外电子排布规律如下:(1) a 的最外层有6个电子,处于第4周期;(2) b 的最外层有8个电子,处于第5周期;(3) c 的最外层有7个电子,处于第6周期。

元素周期表各原子结构示意图第1周期各原子核外电子排布情况[1] K 氢核外电子数依次是:1[2]He 氦核外电子数依次是:2第2周期各原子核外电子排布情况[3Li 锂核外电子数依次是:2 1[4Be 铍核外电子数依次是:2 2[5] B 硼核外电子数依次是:2 3[6] C 碳核外电子数依次是:2 4[8] O 氧核外电子数依次是:2 6[9] F 氟核外电子数依次是:2 7[10]Ne 氖核外电子数依次是:2 8第3周期各原子核外电子排布情况[11]Na 钠核外电子数依次是:2 8 1[12]Mg 镁核外电子数依次是:2 8 2[13]Al 铝核外电子数依次是:2 8 3[14]Si 硅核外电子数依次是:2 8 4[15] P 磷核外电子数依次是:2 8 5[16] S 硫核外电子数依次是:2 8 6[17]Cl 氯核外电子数依次是:2 8 7[18]Ar 氩核外电子数依次是:2 8 8第4周期各原子核外电子排布情况[19] K 钾核外电子数依次是:2 8 8 1[20]Ca 钙核外电子数依次是:2 8 8 2[21]Sc 钪核外电子数依次是:2 8 9 2[22]Ti 钛核外电子数依次是:2 8 10 2[23]V 钒核外电子数依次是:2 8 11 2*[24]Cr 铬核外电子数依次是:2 8 13 1 [25]Mn 锰核外电子数依次是:2 8 13 2[27]Co 钴核外电子数依次是:2 8 15 2[28]Ni 镍核外电子数依次是:2 8 16 2*[29]Cu 铜核外电子数依次是:2 8 18 1[30]Zn 锌核外电子数依次是:2 8 18 2[31]Ga 镓核外电子数依次是:2 8 18 3[32]Ge 锗核外电子数依次是:2 8 18 4[33]As 砷核外电子数依次是:2 8 18 5[34]Se 硒核外电子数依次是:2 8 18 6[35]Br 溴核外电子数依次是:2 8 18 7[36]Kr 氪核外电子数依次是:2 8 18 8 第5周期各原子核外电子排布情况[37]Rb 铷核外电子数依次是:2 8 18 8 1[38]Sr 锶核外电子数依次是:2 8 18 8 2[40] Zr 锆核外电子数依次是:2 8 18 10 2[41] Nb 铌核外电子数依次是:2 8 18 12 1[42]Mo 钼核外电子数依次是:2 8 18 13 1[43]T c 锝核外电子数依次是:2 8 18 13 2[44]Ru 钌核外电子数依次是:2 8 18 15 1[45]Rh 铑核外电子数依次是:2 8 18 8 16 1[46]Pd 钯核外电子数依次是:2 8 18 18[47]Ag 银核外电子数依次是:2 8 18 18 1[48]Cd 镉核外电子数依次是:2 8 18 18 2[49]In 铟核外电子数依次是:2 8 18 18 3[50]Sn 锡核外电子数依次是:2 8 18 18 4[51]Sb 锑核外电子数依次是:2 8 18 18 5[52]Te 碲核外电子数依次是:2 8 18 18 6[53]I 碘核外电子数依次是:2 8 18 18 7[54]Xe 氙核外电子数依次是:2 8 18 18 8第6周期各原子核外电子排布情况[56]钡核外电子数依次是:2 8 18 18 8 2[57]镧核外电子数依次是:2 8 18 18 9 2[58]铈核外电子数依次是:2 8 18 19 9 2[59]镨核外电子数依次是:2 8 18 21 8 2[60]钕核外电子数依次是:2 8 18 22 8 2[61] 钷核外电子数依次是:2 8 18 23 8 2[62] 钐核外电子数依次是:2 8 18 24 8 2 [63铕核外电子数依次是:2 8 18 25 8 2[64]钆核外电子数依次是:2 8 18 25 9 2[65]铽核外电子数依次是:2 8 18 27 8 2[66]镝核外电子数依次是:2 8 18 28 8 2[67]钬核外电子数依次是:2 8 18 29 8 2[68]铒核外电子数依次是:2 8 18 30 8 2[69]铥核外电子数依次是:2 8 18 31 8 2[70]镱核外电子数依次是:2 8 18 32 8 2[71]Lu镥核外电子数依次是:2 8 18 32 9 2[72]铪核外电子数依次是:2 8 18 32 10 2[73]钽核外电子数依次是:2 8 18 32 11 2[74]钨核外电子数依次是:2 8 18 32 12 2[75]铼核外电子数依次是:2 8 18 32 13 2[76]锇核外电子数依次是:2 8 18 32 14 2[77]铱核外电子数依次是:2 8 18 32 15 2[78]铂核外电子数依次是:2 8 18 32 17 1[79]金核外电子数依次是:2 8 18 32 18 1[81]铊核外电子数依次是:2 8 18 32 18 3[82]铅核外电子数依次是:2 8 18 32 18 4[83]铋核外电子数依次是:2 8 18 32 18 5[84]钋核外电子数依次是:2 8 18 3218 6[85]砹核外电子数依次是:2 8 18 3218 7[86]Rn 氡核外电子数依次是:2 8 18 32 18 8 第7周期各原子核外电子排布情况[87]钫核外电子数依次是:2 8 18 32 18 8 1[88]镭核外电子数依次是:2 8 18 32 18 8 2[89]锕核外电子数依次是:2 8 18 32 18 9 2[90]钍核外电子数依次是:2 8 18 32 18 10 2[91]镤核外电子数依次是:2 8 18 32 20 9 2[92]铀核外电子数依次是:2 8 18 32 21 9 2[93]镎核外电子数依次是:2 8 18 32 22 9 2[94]钚核外电子数依次是:2 8 18 32 24 8 2[95]镅核外电子数依次是:2 8 18 32 25 8 2[96]锔核外电子数依次是:2 8 18 32 25 9 2[97]锫核外电子数依次是:2 8 18 32 27 8 2[98]锎核外电子数依次是:2 8 18 32 28 8 2[99]锿核外电子数依次是:2 8 18 32 29 8 2 [100]镄核外电子数依次是:2 8 18 32 30 8 2 [101]钔核外电子数依次是:2 8 18 32 31 8 2 [102]锘核外电子数依次是:2 8 18 32 32 8 2 [103]铹核外电子数依次是:2 8 18 32 32 9 2 [104]钅卢核外电子数依次是:2 8 18 32 32 10 2 [105]钅杜核外电子数依次是:2 8 18 32 32 11 2 [106]钅喜核外电子数依次是:[107]钅波核外电子数依次是:[108]钅黑核外电子数依次是:[109]钅麦核外电子数依次是:[110] 核外电子数依次是:[111] 核外电子数依次是:[112] 核外电子数依次是:[114] 核外电子数依次是:。
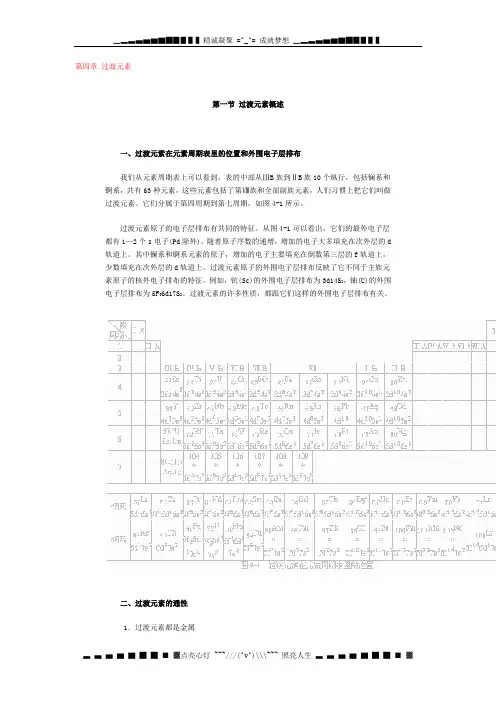
第四章过渡元素第一节过渡元素概述一、过渡元素在元素周期表里的位置和外围电子层排布我们从元素周期表上可以看到,表的中部从ⅢB族到ⅡB族10个纵行,包括镧系和锕系,共有63种元素,这些元素包括了第Ⅷ族和全部副族元素,人们习惯上把它们叫做过渡元素。
它们分属于第四周期到第七周期,如图4-1所示。
过渡元素原子的电子层排布有共同的特征。
从图4-1可以看出,它们的最外电子层都有1—2个s电子(Pd除外),随着原子序数的递增,增加的电子大多填充在次外层的d 轨道上。
其中镧系和锕系元素的原子,增加的电子主要填充在倒数第三层的f轨道上,少数填充在次外层的d轨道上。
过渡元素原子的外围电子层排布反映了它不同于主族元素原子的核外电子排布的特征。
例如,钪(Sc)的外围电子层排布为3d14S2,铀(U)的外围电子层排布为5F36d17S2。
过渡元素的许多性质,都跟它们这样的外围电子层排布有关。
二、过渡元素的通性1.过渡元素都是金属过渡元素都是金属,所以人们又把它们叫做过渡金属。
它们原子的最外层电子数不超过2个,容易失去,原子间也容易形成金属键,固态时呈金属晶体。
过渡金属的原子跟同周期主族元素的金属原子相比,一般具有较小的原子半径。
过渡金属有较大的密度,较高的熔点和沸点。
例如,铂的密度是21.45克/厘米3,约是铝的8倍;钨的熔点是3410℃,是所有金属里最难熔的。
此外,过渡金属还往往具有较高的硬度,较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能,并且可以组成具有多种特性的合金。
例如金、银等金属有优异的延展性,可以抽成极细的金属丝,轧成极薄的金属箔;银、铜等金属具有良好的导电、导热性能,铂、钛、铬、镍等金属都有良好的耐腐蚀性能,等等。
2.过渡元素常有多种可变化合价过渡元素在形成化合物时,最外层的s电子和次外层的d电子等都有可能参加成键。
因此,过渡元素往往有变价。
表4-1列出了第四周期过渡元素常见的化合价(下划横线的是比较稳定的价态)。

第53节过渡元素简介一、过渡元素简介过渡元素在元素周期表中的位置和外围电子层排布从元素周期表上可以看到,表的中部从ⅢB 族到ⅡB 族10个纵行,包括镧系和锕系,共有63种元素,这些元素包括了第VI 族和全部副族元素,人们习惯上把它们叫做过渡元素。
过渡元素的价层电子构型为1~101~2(1)ds n n (Pd 为0ns )。
在元素周期表中,它们处于s 区元素和p 区元素之间。
从性质上看,s 区元素的单质均为活泼元素,形成的化合物以离子型为主,其氧化数单一,离子没有颜色;p 区元素只有部分是金属元素,形成的化合物多为共价型,含有多种氧化数;d 区介于s 区和p 区之间。
因此,人们又称d 区元素为过渡元素。
它们分属于第四周期到第七周期,如图11-1所示过渡元素原子的电子层排布有共同的特征。
从图中可以看出,它们的最外电子层上都有1~2个s 电子(Pd 除外),随着原子序数的递增,增加的电子大多填充在次外层的d 轨道上其中镧系和锕系元素的原子,增加的电子主要填充在倒数第三层的f 轨道上,少数填充在次外层的d 轨道上。
过渡元素原子的外围电子层排布反映了它不同于主族元素原子的核外电子排布的特征。
例如,钪(Sc )的外围电子层排布为3d4s2,铀(U )的外围电子层排布为5f6d7s2。
过渡元素的许多性质,都跟它们的外围电子层排布有关。
二、过渡元素的通性过渡元素原子的最外层一般只有1~2个电子,在化学反应中较易失去,故它们都是金属元素。
相对于主族元素而言,过渡元素的特性及其性质变化规律主要表现在以下几个方面1.单质的物理性质过渡元素的单质有些是高熔点、高沸点、密度大、硬度大、导电和导热性良好的金属。
在金属元素中,熔点最高的是钨,密度最大的是锇,硬度最大的是铬。
例如:铂的密度是21.45g/cm 3,约是铝的8倍;钨的熔点是3410℃,是所有金属中最难熔的。
造成这些特性的原因是过渡元素的单质因原子半径小,采取最紧密堆积,原子之间除了有电子外,还用部分d电子参与成键,在金属键之外有部分共价键,因此结合牢固。

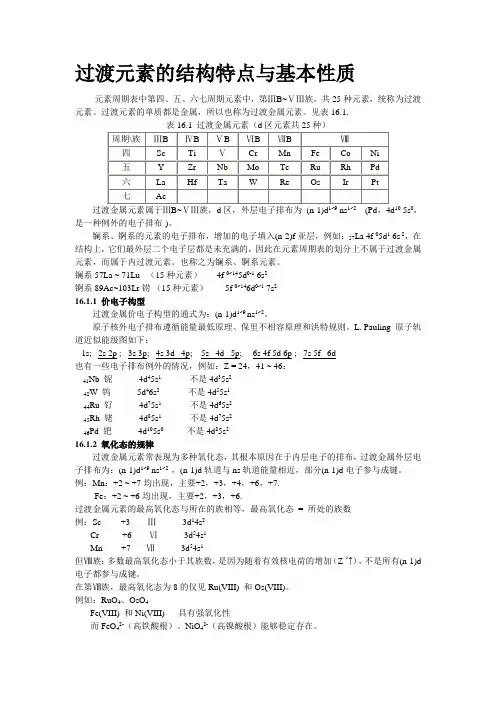
过渡元素的结构特点与基本性质元素周期表中第四、五、六七周期元素中,第ⅢB~ⅤⅢ族,共25种元素,统称为过渡元素。
过渡元素的单质都是金属,所以也称为过渡金属元素。
见表16.1.5s0,是一种例外的电子排布)。
镧系、锕系的元素的电子排布,增加的电子填入(n-2)f亚层,例如:57La 4f 05d1 6s 2,在结构上,它们最外层二个电子层都是未充满的,因此在元素周期表的划分上不属于过渡金属元素,而属于内过渡元素。
也称之为镧系、锕系元素。
镧系57La ~ 71Lu (15种元素) 4f 0~145d0-1 6s2锕系89Ac~103Lr铹(15种元素)5f 0~146d0~1 7s216.1.1 价电子构型过渡金属价电子构型的通式为:(n-1)d1~9 ns1~2。
原子核外电子排布遵循能量最低原理、保里不相容原理和洪特规则。
L. Pauling 原子轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有一些电子排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s24616.1.2 氧化态的规律过渡金属元素常表现为多种氧化态,其根本原因在于内层电子的排布,过渡金属外层电子排布为:(n-1)d1~9 ns1~2 ,(n-1)d轨道与ns轨道能量相近,部分(n-1)d电子参与成键。
例:Mn:+2 ~ +7均出现,主要+2,+3,+4,+6,+7.Fe:+2 ~ +6均出现,主要+2,+3,+6.过渡金属元素的最高氧化态与所在的族相等,最高氧化态= 所处的族数例:Sc +3 Ⅲ3d14s2Cr +6 Ⅵ3d54s1Mn +7 Ⅶ3d54s1但Ⅷ族:多数最高氧化态小于其族数,是因为随着有效核电荷的增加(Z *↑),不是所有(n-1)d 电子都参与成键。

备课资料一、能级交错现象能级交错是指电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。
如4s 反而比3d 的能量小,填充电子时应先充满4s 而后才填入3d 轨道。
过渡元素钪的外层电子排布为4s 23d 1,失去电子时,按能级交错应先失去3d 电子,成为4s 23d 0,而从原子光谱实验得知,却是先失4s 上的电子成为4s 13d 0。
这是由于3d 电子的存在,削弱了原子核外对4s 电子的吸引而易失去的。
过渡元素离子化时,大体是先失去ns 电子,但也有先失去(n-1)d 电子的,像钇等。
能级交错的顺序不是绝对不变的,在原子序数大的原子中,3d 轨道可能比4s 轨道的能量低。
鲍林多电子原子能级和徐光宪公式处理多电子原子问题时,认为其他电子对某个电子i 的排斥,相当于其他电子屏蔽住原子核,抵消了一部分核电荷对电子i 的吸引力,称为其他电子对电子i 的屏蔽作用(screening effect ),引进屏蔽常数σ(screening constant )表示其他电子所抵消掉的核电荷。
这样多电子原子中电子i 的能量公式可表示为:J 1818.2)Z (E 1822i -⨯⨯--=nσ(9.7) 式中(Z-σ)=Z′称为有效核电荷(effective nuclear charge)。
多电子原子电子的能量和Z 、n 、σ有关。
Z 愈大,相同轨道的能量愈低,如基态氟原子1s 电子的能量比基态氢原子1s 电子的能量低;n 愈大,能量愈高;起屏蔽作用的电子愈多,总的屏蔽作用愈强。
σ愈大,能量愈高。
影响σ有以下因素:(1) 外层电子对内层电子的屏蔽作用可以不考虑,σ=0;(2) 内层(n-1层)电子对最外层(n 层)电子的屏蔽作用较强,σ=0.85,离核更近的内层(n-2层)电子对最外层电子的屏蔽作用更强,σ=1.00;(3) 同层电子之间也有屏蔽作用,但比内层电子的屏蔽作用弱,σ=0.35,1s 之间σ=0.30。


《原子核外电子排布与元素周期律》讲义一、原子核外电子排布在探讨元素周期律之前,我们先来了解一下原子核外电子的排布规律。
原子是由居于中心的原子核和核外电子组成的,而电子在原子核外的分布并非是随意的,而是遵循一定的规律。
首先,电子在原子核外是分层排布的。
我们可以将这些层称为电子层,从内到外分别用数字 1、2、3、4、5、6、7 来表示,也可以用字母 K、L、M、N、O、P、Q 来表示。
离原子核越近的电子层,能量越低;离原子核越远的电子层,能量越高。
其次,各电子层最多容纳的电子数是有规律的。
第 n 电子层最多容纳 2n²个电子。
例如,第一层(K 层)最多容纳 2 个电子,第二层(L 层)最多容纳 8 个电子,第三层(M 层)最多容纳 18 个电子,以此类推。
另外,最外层电子数不超过 8 个(当只有一个电子层时,最外层电子数不超过2 个)。
这是因为当最外层电子数达到8 个(或2 个)时,原子处于相对稳定的状态。
原子核外电子的排布情况对原子的化学性质有着重要的影响。
例如,金属原子最外层电子数一般较少,容易失去电子;而非金属原子最外层电子数一般较多,容易得到电子。
为了更直观地表示原子核外电子的排布,我们通常会使用原子结构示意图。
原子结构示意图是用小圆圈表示原子核,圆圈内的数字表示质子数,弧线表示电子层,弧线上的数字表示该层上的电子数。
二、元素周期律元素周期律是指元素的性质随着原子序数的递增而呈现周期性变化的规律。
这里所说的性质包括原子半径、化合价、金属性和非金属性等。
1、原子半径原子半径的大小取决于两个因素:一是电子层数,电子层数越多,原子半径越大;二是核电荷数,核电荷数越大,对核外电子的吸引力越大,原子半径越小。
当电子层数相同时,核电荷数越大,原子半径越小。
同一周期的元素,从左到右,原子半径逐渐减小。
这是因为随着核电荷数的增加,原子核对核外电子的吸引力增强,使得原子半径逐渐减小。
同一主族的元素,从上到下,原子半径逐渐增大。

元素在周期表中位置、结构、性质规律总结摘要根据元素的核外电子排布特点,结合元素的某些化学性质,如化合价,晶体特点等,确定元素在周期表中的位置,从而确定该元素。
关键词核外电子排布;化合价;晶体物质结构是化学基本理论的重点和难点之一,在历年高考中均占有一定的比重。
特别是在新课程改革的方针下,选修3作为高考选修模块之一,更是不容忽视。
笔者根据多年的教学经验,总结出以下规律,供大家参考和学习。
一、从电子排布规律推断元素1.最外层电子数在3~7之间的元素一定是主族元素主族元素与过渡元素的主要区别就在于主族元素的次外层电子达到了2电子或8电子的稳定结构(短周期元素),以及8电子、18电子或32电子的稳定结构(长周期元素),而过渡元素不仅次外层电子数,甚至倒数第3层电子数都未达到饱和状态(IB、IIB元素除外)。
所以,在化学反应中,主族元素的价电子只是最外层电子,而过渡元素的最外层、次外层,甚至倒数第三层的电子都可能是价电子,但是,过渡元素的最外层电子数只在1~2之间变化。
因此最外层电子数在3~7之间的元素一定是主族元素。
如铬、锌、镓、溴的原子结构示意图分别如下:但铬是VIB族元素,锌是IIB族元素,均是过渡元素,而镓是ⅢA族元素,溴是VIIA族元素,均是主族元素。
2最外层电子数在1~2之间的元素分情况讨论⑴只有一层电子的且最外层是2个电子,该元素是氦。
⑵最外层电子数在1~2之间,次外层没有电子、2电子或是8个电子,该元素可能是ⅠA族元素(最外层1个电子)或ⅡA族元素(最外层2个电子,氦除外),其他条件的次外层电子数一定是过渡元素。
如钾、钙、铁、铜的原子结构示意图分别如下:这四种元素的最外层电子数都在1~2之间变化,但钾是ⅠA族元素,钙是ⅡA族元素,都是主族元素,铁是VIII族元素,铜是ⅠB族元素,均是过渡元素。
3.最外层电子数比次外层电子数多的元素一定在第2周期第2周期元素次外层是2电子结构,最外层电子数在1~8之间变化,除锂以外,其他元素的最外层电子数都比次外层电子数多。
一、原子核外电子排布的原理
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。
1.最低能量原理
电子在原子核外排布时,要尽可能使电子的能量最低。
怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。
这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。
电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。
当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势。
一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。
这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p……
2.保里不相容原理
我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向。
在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的。
根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。
也就是说,每一个轨道中只能容纳两个自旋方向相反的电子。
这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间)。
根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;f亚层有5个轨道,总共可以容纳10个电子。
我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n2个电子。
3.洪特规则
从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于
全满(s2、p6、d10、f14)
半满(s1、p3、d5、f7)
全空(s0、p0、d0、f0)时比较稳定。
这类似于我们坐电梯的情况中,要么电梯是空的,要么电梯里都有一个人,要么电梯里都挤满了两个人,大家都觉得比较均等,谁也不抱怨谁;如果有的电梯里挤满了两个人,而有的电梯里只有一个人,或有的电梯里有一个人,而有的电梯里没有人,则必然有人产生抱怨情绪,我们称之为不稳定状态。
二、核外电子排布的方法
对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s 亚层2个,p亚层6个,d亚层10个,f亚层14个。
最外层电子到底怎样排布,还要参考洪特规则,如24号元素铬的24个核外电子依次排列为
1s22s22p63s23p64s23d4
根据洪特规则,d亚层处于半充满时较为稳定,故其排布式应为:
1s22s22p63s23p64s13d5
最后,按照人们的习惯“每一个电子层不分隔开来”,改写成
1s22s22p63s23p63d54s1
即可。
三、核外电子排布在中学化学中的应用
1.原子的核外电子排布与轨道表示式、原子结构示意图的关系:原子的核外电子排布式与轨道表示式描述的内容是完全相同的,相对而言,轨道表示式要更加详细一些,它既能明确表示出原子的核外电子排布在哪些电子层、电子亚层上,还能表示出这些电子是处于自旋相同还是自旋相反的状态,而核外电子排布式不具备后一项功能。
原子结构示意图中可以看出电子在原子核外分层排布的情况,
但它并没有指明电子分布在哪些亚层上,也没有指明每个电子的自旋情况,其优点在于可以直接看出原子的核电荷数(或核外电子总数)。
2.原子的核外电子排布与元素周期律的关系
在原子里,原子核位于整个原子的中心,电子在核外绕核作高速运动,因为电子在离核不同的区域中运动,我们可以看作电子是在核外分层排布的。
按核外电子排布的3条原则将所有原子的核外电子排布在该原子核的周围,发现核外电子排布遵守下列规律:原子核外的电子尽可能分布在能量较低的电子层上(离核较近);若电子层数是n,这层的电子数目最多是2n2个;无论是第几层,如果作为最外电子层时,那么这层的电子数不能超过8个,如果作为倒数第二层(次外层),那么这层的电子数便不能超过18个。
这一结果决定了元素原子核外电子排布的周期性变化规律,按最外层电子排布相同进行归类,将周期表中同一列的元素划分为一族;按核外电子排布的周期性变化来进行划分周期
如第一周期中含有的元素种类数为2,是由1s1~2决定的
第二周期中含有的元素种类数为8,是由2s1~22p0~6决定的
第三周期中含有的元素种类数为8,是由3s1~23p0~6决定的
第四周期中元素的种类数为18,是由4s1~23d0~104p0~6决定的。
由此可见,元素原子核外电子排布的规律是元素周期表划分的主要依据,是元素性质周期性变化的根本所在。
对于同族元素而言,从上至下,随着电子层数增加,原子半径越来越大,原子核对最外层电子的吸引力越来越小,最外层电子越来越容易失去,即金属性越来越强;对于同周期元素而言,随着核电荷数的增加,原子核对外层电子的吸引力越来越强,使原子半径逐渐减小,金属性越来越差,非金属性越来越强。