注射液配伍稳定性考察注射液配伍稳定性考察
- 格式:docx
- 大小:19.52 KB
- 文档页数:5


药物研究注射用比阿培南配伍稳定性考察王 蓓1,张 菁2,马卫红3(1.石药集团中诺药业(石家庄)有限公司,河北石家庄050091;2.河北省药品检验所,河北石家庄050011;3.石药集团维生药业(石家庄)有限公司,河北石家庄050035)[摘要] 目的 考察注射用比阿培南的配伍稳定性。
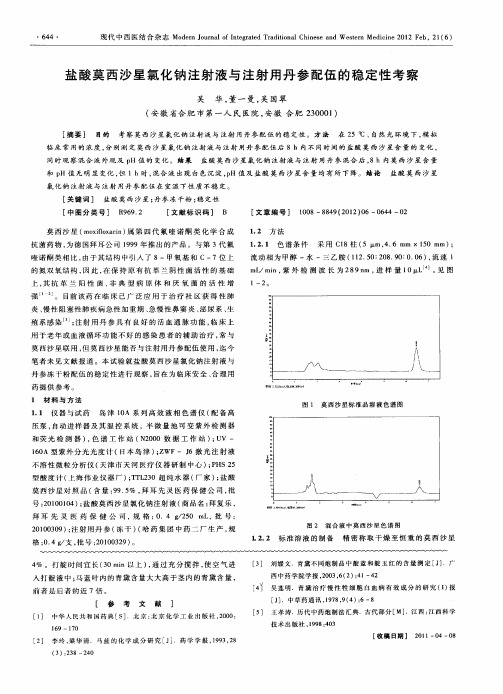
方法 采用H PLC法测定注射用比阿培南与5%葡萄糖注射液、10%葡萄糖注射液等6种注射液配伍时其含量和有关物质,考察其外观、不溶性微粒及p H值的变化。
结果 注射用比阿培南与5%葡萄糖注射液、10%葡萄糖注射液等6种注射液配伍时,外观、p H值、含量、有关物质基本不变,不溶性微粒符合药典规定。
结论 本实验为临床合理用药提供了可靠依据。
[关键词] 注射用比阿培南;配伍;稳定性[中图分类号] R969.2 [文献标识码] B [文章编号] 1008-8849(2010)19-2423-02比阿培南为新型的1 甲基碳青霉烯类抗生素,由美国惠氏公司研制开发,2001年11月授权日本明治治果公司在日本上市,于2002年3月在日本批准上市,本品供静脉滴注使用,本品较目前已上市的碳青霉烯类抗生素具有较大的临床应用优势。
体外试验表明,比阿培南对需氧性革兰阳性菌、阴性菌以及厌氧菌具有广谱强效抗菌作用,同时对耐亚胺培南、美洛培南、头孢他啶、氧氟沙星和庆大霉素的绿脓杆菌也有很强的抗菌活性[1]。
此外比阿培南对肾脱氢肽酶和金属 -内酰胺酶较其他已上市的碳青酶烯类青霉素稳定[2-3]。
笔者对比阿培南与注射液配伍变化进行全面考察,旨在为临床合理用药提供依据。
1 仪器与试药安捷伦1100色谱系统;岛津M u lti spec-1501;GW F-5J微粒分析仪(天津市天河医疗仪器研制中心);p H S-25数显p H计(上海精密仪器科学有限公司);M ETTLERAE163电子天平;5%葡萄糖注射液、10%葡萄糖注射液、0.9%氯化钠注射液、5%葡萄糖氯化钠注射液、复方氯化钠注射液和乳酸钠林格注射液均为国内厂家生产;比阿培南对照品(含量:99 3%,批号:070504,河北省药品检验所标定),注射用比阿培南(石药集团,批号:060701),水为重蒸馏水,乙腈为色谱纯,醋酸钠、醋酸为分析纯。

注射用氨曲南、阿奇霉素在转化糖注射液中的配伍稳定性考察汪燕【摘要】目的考察注射用氨曲南与阿奇霉索在转化槠注射液中的配伍稳定性,为临床合理用药提供科学依据.方法采用HPLC法测定注射用氨曲南与阿奇霉素在转化糖注射液中配伍后8 h内的含量变化,并观察和检测配伍液的外观及pH变化.结果注射用氨曲南、阿奇霉素分别与转化糖注射液中配伍后,8 h内的含最变化不大,阿奇霉素分别为99.76%,99.52%.99.57%,99.60%,pH及外观无明显变化;氨曲南分别为99.78%,99.70%,99.05%,97.25%,配伍液在4-8 h有少量沉淀产生,pH无明显变化.结论室温条件下注射用氨曲南与阿奇霉素在转化糖注射液的配伍液中稳定.%Objective To study the compatibility of aztreonam for injection with azithromycin in the invert sugar injection for the clinical use of drugs to provide a scientific basis. Methods HPLC determination was used observe content changes within 8 h and to observe and detect the appearance of fluid compatibility and PH changes. Results There was little change in the content within on. Azithromycin were 99.76% , 99.52% , 99. 57% ,and 99.60% respectively. There was no significant change in pH and appearance. Aztreonam were 99.78% , 99.70% , 99.05% ,and 97. 25% respectively. In the compatibility of liquid in the 4 ~ 8 h there was a small amount of precipitation, without significant changes in PH. Conclusion At room temperature azithromycin and aztreonam injection are stable in invert sugar solution.【期刊名称】《安徽医药》【年(卷),期】2012(016)005【总页数】3页(P607-609)【关键词】注射用氨曲南;阿奇霉素;转化糖注射液;配伍稳定性;HPLC【作者】汪燕【作者单位】安徽医科大学附属安庆医院,安徽,安庆,246003【正文语种】中文氨曲南是单酰胺环类(Monobactams)的新型β-内酰胺抗生素,临床用于由敏感的革兰阴性菌所致的感染。

盐酸莫西沙星氯化钠与3种注射液配伍的化学稳定性考察目的:考察盐酸莫西沙星氯化钠与维生素C、氯化钾、地塞米松注射液配伍的稳定性。
方法:采用紫外分光光度法测定盐酸莫西沙星氯化钠与维生素C等注射液配伍前后溶液的含量,并观察配伍液的外观、pH值、微粒以及含量的变化。
结果:盐酸莫西沙星氯化钠与维生素C等配伍后,5 h内溶液的含量、pH值、微粒等均没有明显的变化。
结论:盐酸莫西沙星氯化钠与维生素C等配伍后,溶液基本稳定,上述药物可以配伍使用。
[关健词]盐酸莫西沙星氯化钠;维生素C;氯化钾;地塞米松;配伍稳定性盐酸莫西沙星氯化钠为临床上使用较普遍的具有广谱活性和杀菌作用的8-甲氧基氟喹诺酮类抗菌药物[1],主要用于革兰阳性菌、革兰阴性菌、厌氧菌、抗酸菌和非典型微生物如支原体、衣原体和军团菌的感染。
临床上常与维生素C[2,3]、氯化钾、地塞米松注射液配伍使用,为此,笔者模拟临床处方,考察了盐酸莫西沙星氯化钠与维生素C、氯化钾、地塞米松[4]药物的配伍稳定性,为临床使用盐酸莫西沙星氯化钠与维生素C、氯化钾、地塞米松配伍提供实验依据。
1 仪器与试药1.1 仪器UV-160A紫外分光光度计(日本岛津);320电子天平(瑞士Mettler);ZWF-4D Ⅱ注射液微粒分析仪(天津天河医疗仪器研制中心);pHS-3C酸度计(上海精密科学仪器有限公司)。
1.2 试药盐酸莫西沙星氯化钠注射液(拜耳医药保健股份公司,批号BXBUHJ4);维生素C注射液(山西晋新双鹤药业有限责任公司,批号200606251);10%氯化钾注射液(扬州中宝制药厂,批号20061019)、地塞米松磷酸钠注射液(苏州第六制药厂,批号20060723);盐酸莫西沙星对照品(北京拜耳医药保健有限公司提供);0.9%氯化钠注射液(六安华源制药厂,批号20061128);其他试剂均符合《中国药典》2005版要求。
2 方法与结果2.1 测定波长的选择称取盐酸莫西沙星对照品适量,用盐酸溶液(0.1 mol/L)溶解并稀释至10 μg/ml,即得盐酸莫西沙星对照液。
维生素C注射液与两种注射液配伍的稳定性考察张念森;冯萍;胡小梅;朱学凯;廉倩倩;牛玉美【摘要】目的:考察维生素C注射液与维生素K1注射液和肌苷注射液配伍的稳定性。
方法:在室温下,将维生素C注射液与维生素K1注射液和肌苷注射液按1∶1(V/V)比例配伍混合后,24h内观察配伍液的外观、pH值及含量的变化,采用高效液相色谱法和碘量法分别测定维生素K1和维生素C的含量。
结果:在室温下,24h维生素C和维生素K1的配伍液出现浑浊;而与肌苷注射液的配伍外观无变化,但pH值及含量有变化,就是溶液的稳定性发生变化。
结论:在室温下24h内维生素C注射液与维生素K1注射液配伍禁忌,维生素C注射液与肌苷注射液不宜配伍。
【期刊名称】《北方药学》【年(卷),期】2014(000)009【总页数】2页(P17-17,18)【关键词】维生素C注射液;维生素K1;肌苷注射液;配伍;稳定性【作者】张念森;冯萍;胡小梅;朱学凯;廉倩倩;牛玉美【作者单位】山东省滨州医学院附属医院静配中心滨州 256600;山东省滨州医学院附属医院静配中心滨州 256600;山东省滨州医学院附属医院静配中心滨州256600;山东省滨州医学院附属医院静配中心滨州 256600;山东省滨州医学院附属医院静配中心滨州 256600;山东省滨州医学院附属医院静配中心滨州 256600【正文语种】中文【中图分类】R927.11维生素C[1] 注射液是临床上常用的还原剂,用于治疗坏血病,也可用于各种急慢性传染性疾病及紫癜等辅助治疗,还可用于慢性铁中毒和特发性高铁血红蛋白症的治疗。
维生素K1注射液为临床上使用较普遍的常用促凝血药物,特别是外科手术后较常用。
肌苷能参与体内能量代谢与蛋白质的合成,活化丙酮酸氧化酶,并能使细胞在缺氧状态下继续代谢,常用于白细胞或血小板减少症、各种急慢性肝脏疾病、肺源性心脏病等心脏疾病。
维生素C注射液与二者在临床上经常配伍,但与二者配伍的稳定性报道较少。
左氧氟沙星与奥硝唑氯化钠注射液配伍稳定性考察发表时间:2013-02-25T10:36:47.343Z 来源:《医药前沿》2012年第35期供稿作者:赵金晶[导读] 目的考察左氧氟沙星注射液与奥硝唑氯化钠注射液配伍后的稳定性。
赵金晶(第二军医大学附属长海医院肿瘤科 200082)【摘要】目的考察左氧氟沙星注射液与奥硝唑氯化钠注射液配伍后的稳定性。
方法采用紫外分光光度法测定盐酸左氧氟沙星注射液与奥硝唑/氯化钠注射液配伍后的浓度变化,同时观察配伍液的外观性状变化,并测定pH值。
结果室温条件下8h内配伍液的外观浊状、pH值及左氧氟沙星与奥硝唑的质量浓度均无明显变化。
结论左氧氟沙星与奥硝唑/氯化钠注射液在临床应用中可配伍使用,护理人员应充分掌握药品的药品性状和配伍禁忌,密切观察患者输液情况。
【关键词】左氧氟沙星奥硝唑稳定性【中图分类号】R96【文献标识码】A【文章编号】2095-1752(2012)35-0131-02 Study on Stability of Compatibility of Levofloxacin with Ornidazole and Sodimn Chloride Injection 【Abstract】 Objective:To study the stability of levofloxacin injection mixed with ornidazole and sodium chloride injection.Methods:Concentration changes of the mixed solution of levofloxacin hydrochloride with ornidazole and sodium chloride injection were detected by ultraviolet spectrophotometry,then the pH value,the appearance and the insoluble microparticles of the solution were also detected.Results:The contents,external appearance and PH value of the mixed solution showed no significant changes in 8 h.Conclusion:levofloxacin injection mixed with ornidazole and sodium chloride injection could be stable for clinical application.【Key words】 levofloxacin ornidazole stability 左氧氟沙星(Levofloxacin)为第三代喹诺酮类药物,具有抗菌谱广,抗菌作用强的特点,主要用于呼吸系统、泌尿系统、消化系统等细菌感染[1]。
注射液配伍稳定性考察注射液配伍稳定性考察
呋塞米注射液与盐酸多巴胺注射液配伍稳定性考察
【摘要】目的考察呋塞米注射液与盐酸多巴胺注射液在5%葡萄糖注射液中配伍的稳定性。
方法通过对常温下临床常用剂量的呋塞米注射液(60 mg)、盐酸多巴胺注射液(40 mg)在250 mL 5%葡萄糖注射液中配伍后,4 h内外观的观察、溶液pH 值、微粒数量以及各组分含量的变化来考察这两种药物的配伍稳定性。
结果混合溶液4 h内,外观、pH值,含量测定均无显著变化,不溶性微粒无明显变化,且符合中国药典对注射液的相关规定。
结论在实验剂量或低于实验剂量下,两药在250 mL
5%葡萄糖注射液中4 h内可稳定配伍。
【关键词】呋塞米盐酸多巴胺配伍禁忌稳定性
呋塞米注射液与盐酸多巴胺注射液是临床上经常联合应用于急性肾衰竭、心功能衰竭、水肿及各种原因导致的急性少尿或无尿等疾病治疗的两个药物。
据有关资料,浓度为10 mg/mL的盐酸多巴胺和浓度为10 mg/mL的呋塞米的配伍是属于配伍禁忌类[1]。
为探明这两种药物在临床配伍于输液中滴注使用时是否存在理化方面的变化,本实验模拟临床配伍条件进行药物配伍稳定性考察。
1 仪器与试药
1.1 药品与试剂
呋塞米注射液(20 mg/2 mL,含量97.4%,广东南国药业,批号060923);盐酸多巴胺注射液(20 mg/2 mL,广州白云山明兴制药厂,批号060504);5%葡萄糖注射液(250 mL/瓶,广东大冢制药有限公司,批号061206);呋塞米原料(含量99.6%,
常州亚邦制药,批号060702)。
1.2 仪器
UV 2401紫外分光光度计(日本岛津),DF 808A型高精密度pH/离子计(广东省增城市技术经济开发服务中心),ZWF J6型激光注射液微粒分析仪(天津市天河医疗仪器研制中心),AEG 220G电
子分析天平(日本岛津)。
2 方法与结果
2.1 样品溶液的配制
模拟临床用药浓度及输液配制操作,取呋塞米注射液3支,用注射器注入含5%葡萄糖注射液(5%GS)250 mL的PLA瓶中,摇匀后,再注入盐酸多巴胺注射液2支,摇匀,
保持PLA瓶密封,即得。
2.2 外观及pH值变化
将上述混合液置室温条件下,分别在0、1、2、3、4 h观察外观变化并测定pH值。
结果:配伍溶液为无色澄明溶液,在4 h内外观颜色均无变化;pH值无明显变化,范围
为6.76~6.95。
2.3 不溶性微粒检查
将上述混合液置室温条件下,分别在0、1、2、3、4 h取样检查不溶性微粒。
结果:≥10 μm、≥25 μm不溶性微粒无明显变化,且均符合中国药典对于注射液的相关
规定[2]。
2.4 呋塞米的含量测定
2.4.1 试验溶液的配制
对照品溶液:称取呋塞米原料10 mg,精密称定,置25 mL量瓶中,加无水乙醇溶解并稀释至刻度,摇匀,得贮备液(Ⅰ)。
精密量取贮备液(Ⅰ)1 mL,置50 mL量瓶中,加5%GS稀释至刻度,摇匀,得对照品溶液。
阴性对照液:取盐酸多巴胺原料20 mg,精密称定,置25 mL量瓶中,加5%GS稀释至刻度,摇匀;精密量取1 mL,置50 mL量瓶中,用5%GS稀释至刻度,摇匀,得阴性对
照液。
供试品溶液:取呋塞米注射液,精密量取1.0 mL,置100 mL量瓶中,加5%GS稀释后,再加入盐酸多巴胺注射液2 mL,以5%GS 稀释至刻度,摇匀,即得。
2.4.2 测定波长的选择
取对照品溶液、阴性对照液,以5%GS为空白,分别于190~400 nm范围内扫描,结果见图1。
为消除盐酸多巴胺的干扰,本文选择330 nm作为呋塞米的测定波长。
1:呋塞米;2:多巴胺
图1 呋塞米紫外光谱图(略)
Fig.1 UV spectrum of furosemide
2.4.3 标准曲线的制备精密量取呋塞米对照品贮备液(Ⅰ)0.5、1.0、2.0、2.5、
3.0 mL,分别置25 mL量瓶中,用5%GS稀释至刻度,摇匀。
以5%GS为空白,于330 nm 波长处测定吸光度值。
以质量浓度(ρ)对吸光度(A)做工作曲线,进行线性回归,
得方程:A=0.0142ρ+0.0003,r=1.0000。
表明呋塞米在0~54 μg/mL范围内线性关
系良好。
2.4.4 稳定性试验精密量取呋塞米对照品贮备液2.5 mL,置25 mL 量瓶中,用5%GS 稀释至刻度,制成含呋塞米45 μg· mL-1的溶液。
于室温下放置,分别于0、1、2、4、
6、24 h测定吸光度。
结果表明该溶液在24 h内稳定。
2.4.5 回收率试验取供试品溶液9份,每份1.0 mL,置25 mL量瓶中,按低、中、高水平分成3组,每组3份,分别加入呋塞米对照品贮备液(Ⅰ)0.5、1.5、2.5 mL,加5%GS稀释至刻度,摇匀,按标准曲线项下操作测定吸光度,计算回收率。
9份样品溶液的回收率均在95%~105%的范围内,平均为101.2%,RSD为0.90%。
2.4.6 样品
测定
模拟临床用药浓度配备样品溶液3份:精密量取呋塞米注射液1.2 mL,至50 mL量瓶中,加5%GS稀释后,再精密加入盐酸多巴胺注射液0.8 mL,用5%GS稀释至刻度,摇匀。
室温下放置,分别于0、1、2、3、4 h精密量取5 mL,置25 mL量瓶中,加5%GS 稀释至刻
度,按标准曲线项下操作测定吸光度,根据回归方程计算样品溶液的浓度;并以0 h时的含量为100%,计算放置后各取样点的相对百分含量,结果见表1。
配伍后室温放置4 h,呋塞米的含量无明显变化。
表1 配伍后呋塞米的含量变化(略)
Tab.1 the content change of furosemide after mixing with dopamine injection
2.5 盐酸多巴胺含量变化
因为配伍混合液中呋塞米的含量无明显变化,所以本实验通过测定280nm波长处混合液的吸光度来考察盐酸多巴胺的含量变化。
模拟临床用药浓度配备样品溶液,精密量取呋塞米注射液0.6 mL,至25 mL量瓶中,加5%GS稀释后,再精密加入盐酸多巴胺注射液0.4 mL,用5%GS稀释至刻度,摇匀(n=3)。
室温放置,于0,1,2,3,4 h各取2.5 mL,置50 mL量瓶中,加5%GS稀释至刻度。
以5%GS为空白,在280 nm处测定吸收值,将所得的数据进行单因素方差分析,结果表明盐酸多巴胺含量无显著变化,见表2、表3。
表2 混合注射液4 h内的吸光度(λ=280 nm,n=3)(略)
Tab.2 the absorbance of the mixing injection within 4 hours(λ=280 nm,n=3)
表3 单因素方差分析(略)
Tab.3 one way analysis of variance
2.6 配伍溶液紫外吸收光谱的变化
在含量测定的同时对配伍后的混合溶液进行扫描,结果表明混合溶液的紫外吸收光谱在4 h内无明显变化,未出现新的吸收峰。
3 讨论
上述试验结果表明,盐酸多巴胺注射液(40 mg)与呋塞米注射液(60 mg)在250 mL 5%葡萄糖注射液中混合4 h,性状、pH值、含量及紫外光谱图均无显著变化,不溶性微粒的检查结果符合相关规定[2]。
因此,本文认为在试验浓度下(呋塞米0.23 mg/mL,多巴胺0.15 mg/mL),3种注射液混合后4 h内稳定。
本实验根据临床常规的用药剂量,拟定呋塞米(60 mg)+盐酸
多巴胺(40 mg)+5%GS 250 mL的实验配伍方案。
在实验过程中采用稀配法,即先加入一种药物,用5%GS 稀释混匀后,再加入另一种药物,可防止药物在高浓度配伍后发生变化。
因临床上使用这两种药物时,从配备到滴注结束通常不超过3 h,所以观察到4 h的
变化情况已能满足临床使用时间的要求。
盐酸多巴胺是一种弱酸性物质,其分子中带有两个游离的酚羟基,易被氧化为醌类,最后形成黑色聚合物,在碱性条件下尤为明显[3]。
呋塞米注射液呈弱碱性,与盐酸多巴胺直接混合可使其发生氧化反应,可能就是文献报道的二者按10 mg/mL浓度配伍有禁忌的原因。
在本实验中,呋塞米及盐酸多巴胺的浓度较低,混合液呈中性(pH6.9),4 h内溶液性状未发生变化。
若呋塞米低于实验剂量,配伍液将呈中性到弱酸性,从而可推断在低于实验剂量的情况下,两药在4 h内也可稳定配伍。
【参考文献】
[1]沈建平,宗希乙.306种注射液临床配伍应用检索手册[M].北京:中国医药
科技出版社,2004:72.
[2]国家药典委员会.中华人民共和国药典:2005年版二部[S].北京:化学工业
出版社,2005:附录61.
[3]陆晓骅,鲍思蔚,顾文武,等.盐酸多巴胺与呋塞米、甲磺酸酚妥拉明在生理盐水中配伍问题的探讨[J].上海医药,2001,22(5):221-222.。