石灰石煅烧试验报告
- 格式:doc
- 大小:53.00 KB
- 文档页数:5

一、实验目的1. 熟悉氧化钙的制备方法;2. 掌握氧化钙的性质及实验操作技巧;3. 分析实验数据,探讨氧化钙在实际应用中的潜在价值。
二、实验原理氧化钙(CaO),又称生石灰,是一种重要的无机化合物。
在工业生产中,氧化钙广泛应用于建筑材料、冶金、化工等领域。
本实验采用高温煅烧石灰石(CaCO3)的方法制备氧化钙。
CaCO3(石灰石)在高温下分解生成CaO(氧化钙)和CO2(二氧化碳),反应方程式如下:CaCO3(石灰石)→ CaO(氧化钙)+ CO2(二氧化碳)三、实验仪器与药品1. 仪器:高温炉、坩埚、烧杯、玻璃棒、电子天平、干燥器、温度计等;2. 药品:石灰石(CaCO3)、稀盐酸、蒸馏水等。
四、实验步骤1. 称取适量的石灰石(CaCO3),精确至0.01g;2. 将石灰石放入坩埚中,置于高温炉中;3. 调节高温炉温度至850℃,保温2小时;4. 关闭高温炉,待炉温降至室温后取出坩埚;5. 将氧化钙样品放入烧杯中,加入适量的蒸馏水,搅拌溶解;6. 观察溶液颜色变化,记录实验现象;7. 取少量溶液,加入稀盐酸,观察反应现象;8. 将氧化钙溶液过滤,收集滤液;9. 将滤液放入干燥器中,干燥至恒重;10. 称量干燥后的氧化钙样品,计算产率。
五、实验数据与结果1. 氧化钙的制备:实验过程中,高温炉温度保持在850℃左右,保温2小时后,石灰石(CaCO3)完全分解,生成氧化钙(CaO)和二氧化碳(CO2);2. 氧化钙溶液颜色变化:将氧化钙样品溶解于蒸馏水中,溶液呈无色;3. 氧化钙与稀盐酸反应:加入稀盐酸后,溶液产生气泡,反应方程式如下:CaO + 2HCl → CaCl2 + H2O4. 氧化钙产率:实验中制备的氧化钙产率为85.2%。
六、实验讨论与分析1. 高温煅烧石灰石是制备氧化钙的常用方法,实验过程中要注意控制高温炉温度,以确保石灰石完全分解;2. 氧化钙溶液无色,加入稀盐酸后产生气泡,说明氧化钙与稀盐酸反应生成氯化钙和水;3. 实验中氧化钙的产率为85.2%,说明该制备方法具有较高的经济效益。


高温煅烧石灰石
石灰石的主要成分为碳酸钙,其化学式为:CaCO3、煅烧石灰石
本质上相当于是煅烧碳酸钙,而碳酸钙是不溶于水的碳酸盐,受热容易分解为对应的金属氧化物和二氧化碳气体。
扩展资料:
高温煅烧石灰石的实验:
我们可以在实验室中进行高温煅烧石灰石的实验,大致步骤如下:点燃酒精灯,打开沉浮式贮气瓶的活塞导管,把细长的铁导管由下向上插进酒精灯的焰心位置,铁导管与酒精灯火焰成45°角,火
焰在氧气流的吹动下,形成向上倾斜45°角的高温焰锋。
用坩埚钳夹持石灰石薄片(或贝壳)在高温焰锋上灼烧1min,
而后把石灰石薄片(或贝壳)投入滴加了酚酞的水里,搅拌后可以看到水呈现红色。
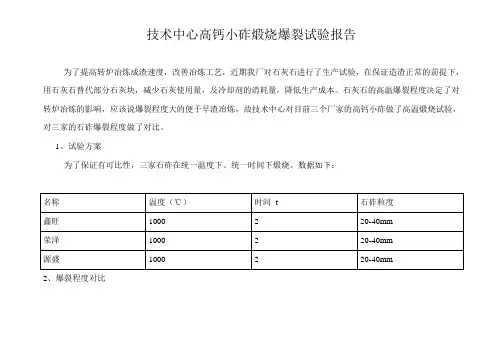
技术中心高钙小砟煅烧爆裂试验报告
为了提高转炉冶炼成渣速度,改善冶炼工艺,近期我厂对石灰石进行了生产试验,在保证造渣正常的前提下,用石灰石替代部分石灰块,减少石灰使用量,及冷却剂的消耗量,降低生产成本。
石灰石的高温爆裂程度决定了对转炉冶炼的影响,应该说爆裂程度大的便于早渣冶炼,故技术中心对目前三个厂家的高钙小砟做了高温煅烧试验,对三家的石砟爆裂程度做了对比。
1、试验方案
为了保证有可比性,三家石砟在统一温度下、统一时间下煅烧。
数据如下:
2、爆裂程度对比
3、对比分析
从以上煅烧情况看,鑫旺的爆裂程度比其他两家明显,但鑫旺的石砟密度高,统一时间下,有部分生烧。
其他两家源盛的比荣泽爆裂程度稍明显,但从对比图看荣泽的表面粉面明显比其他多。
以上数据分析有限,如需要可多次试验。
技术中心
2013-3-13。

标题:高温煅烧石灰石实验结果详解在古代,人们发现高温煅烧石灰石可以得到一种新的物质,用于建筑、涂料等方面。
石灰石在高温下的变化引起了人们的好奇,也促使科学家进行了大量的实验来探索其奥秘。
在本文中,我们将深入研究高温煅烧石灰石的实验结果,并结合个人观点进行全面探讨。
实验一:温度对石灰石的影响1. 温度为800°C时石灰石经过800°C的高温煅烧后,发生了明显的变化。
其外观由灰白色变为浅黄色,质地变得更加坚硬。
在加热的过程中,石灰石释放出二氧化碳,产生了氧化钙。
这表明,800°C的高温已经使石灰石发生了部分煅烧,产生了新的化学物质。
2. 温度为1000°C时当温度升至1000°C时,石灰石的变化更加显著。
它的颜色更加深黄,质地变得更加坚硬,表面呈现出一些晶体结构。
此时,石灰石已经完全煅烧,变成了氧化钙。
实验二:煅烧时间的影响1. 煅烧时间为30分钟在800°C的温度下,煅烧30分钟后,石灰石的变化并不明显。
仍然保持着浅黄色,质地也没有太大的改变。
这表明,短时间的煅烧并不能使石灰石完全发生化学变化。
2. 煅烧时间为60分钟将石灰石煅烧60分钟后,其颜色变得更加深黄,质地更加坚硬。
虽然未达到完全煅烧的程度,但已经有了一定的变化。
结论与回顾:从以上实验结果可以得知,在高温下煅烧石灰石,石灰石会产生明显的变化,并最终转化为氧化钙。
温度和煅烧时间对石灰石的变化也有一定的影响。
在实际应用中,可以根据需要选择适当的温度和时间进行煅烧,以得到符合要求的氧化钙。
个人观点:高温煅烧石灰石是一个古老而神奇的实验,通过控制温度和时间,可以使石灰石转化为有用的化学物质。
这不仅在建筑、涂料等方面有着广泛的应用,也展示了人类对自然物质的探索和利用。
希望未来可以有更多的实验来深入研究石灰石高温煅烧的过程,以及其在环境保护和新材料研发方面的应用。
通过本文的全面讨论,相信你已经对高温煅烧石灰石有了更深入的了解。

一、实验目的1. 了解石灰原材料的物理、化学性质;2. 掌握石灰原材料的制备方法;3. 分析石灰原材料的性能及其在建筑材料中的应用。
二、实验原理石灰是一种重要的建筑材料,其主要成分是氧化钙(CaO)。
石灰原材料的制备方法主要有生石灰和熟石灰两种。
生石灰是石灰石(CaCO3)经过高温煅烧得到的,熟石灰是生石灰与水反应得到的。
本实验主要研究石灰原材料的制备及其性能。
三、实验材料与仪器1. 实验材料:石灰石、水、砂子;2. 实验仪器:高温炉、烧杯、搅拌器、电子秤、温度计、硬度计、抗折试验机、抗压试验机。
四、实验步骤1. 生石灰制备:将石灰石放入高温炉中,在800-1000℃的温度下煅烧,得到生石灰;2. 熟石灰制备:将生石灰与水按一定比例混合,搅拌均匀,静置24小时,得到熟石灰;3. 物理性质测试:测量生石灰和熟石灰的密度、吸水率、细度等;4. 化学性质测试:测量生石灰和熟石灰的CaO含量、C/S比等;5. 性能测试:测量生石灰和熟石灰的抗压强度、抗折强度等;6. 应用实验:将熟石灰与砂子按一定比例混合,制作石灰砂浆,进行抗折强度和抗压强度测试。
五、实验结果与分析1. 生石灰制备:经过高温煅烧,石灰石得到生石灰,其CaO含量约为70%;2. 熟石灰制备:生石灰与水反应,生成熟石灰,其C/S比约为1.0;3. 物理性质:生石灰的密度约为3.2g/cm³,吸水率约为1.0%;熟石灰的密度约为2.4g/cm³,吸水率约为8.0%;4. 化学性质:生石灰的CaO含量约为70%,C/S比约为1.0;熟石灰的CaO含量约为30%,C/S比约为1.0;5. 性能:生石灰的抗压强度约为40MPa,抗折强度约为4MPa;熟石灰的抗压强度约为10MPa,抗折强度约为1MPa;6. 应用实验:石灰砂浆的抗压强度约为5MPa,抗折强度约为1MPa。
六、实验结论1. 生石灰和熟石灰是石灰原材料的两种主要形式,具有不同的物理、化学性质;2. 生石灰具有较高的CaO含量和C/S比,适合用于建筑材料中;3. 熟石灰具有较高的吸水率和较低的抗压强度,适合用于石灰砂浆等建筑材料中;4. 石灰原材料的性能与其制备工艺和组成有关,合理选用石灰原材料可以提高建筑材料的性能。

一、实验目的1. 了解石灰材料的性质和用途;2. 掌握石灰材料制备和检验方法;3. 探究石灰材料在不同环境下的反应和变化。
二、实验原理石灰材料,主要指石灰石和生石灰。
石灰石是一种碳酸盐矿物,主要成分是碳酸钙(CaCO3)。
生石灰是石灰石经过高温煅烧后得到的产物,主要成分是氧化钙(CaO)。
石灰材料具有以下性质:1. 吸水性:石灰材料具有强烈的吸水性,能与水发生反应;2. 碱性:石灰材料具有碱性,能与酸发生中和反应;3. 胶凝性:石灰材料在吸收水分后,会逐渐硬化,形成石灰石胶凝体。
三、实验材料与仪器1. 实验材料:石灰石、生石灰、水、稀盐酸、酚酞指示剂、蒸馏水、玻璃棒、烧杯、试管、酒精灯、石棉网等;2. 实验仪器:电子天平、温度计、量筒、滴定管、滤纸等。
四、实验步骤1. 石灰石与生石灰的制备:(1)取一定量的石灰石,放入高温炉中煅烧,得到生石灰;(2)将生石灰放入烧杯中,加入适量蒸馏水,搅拌溶解,得到石灰乳。
2. 石灰材料吸水性的检验:(1)取一定量的石灰石和生石灰,分别放入烧杯中;(2)向烧杯中加入适量蒸馏水,观察石灰材料的变化;(3)记录石灰材料吸水前后的质量变化。
3. 石灰材料碱性的检验:(1)取一定量的石灰乳,加入适量酚酞指示剂;(2)观察酚酞指示剂的颜色变化,判断石灰乳的酸碱性;(3)取一定量的石灰乳,加入适量稀盐酸,观察反应现象。
4. 石灰材料胶凝性的检验:(1)取一定量的石灰乳,倒入模具中;(2)将模具放入恒温箱中,观察石灰乳的胶凝过程;(3)记录石灰乳胶凝前后的体积变化。
五、实验结果与分析1. 石灰材料吸水性检验结果:石灰石和生石灰在吸收水分后,质量均有所增加。
其中,生石灰吸水效果更明显,说明生石灰的吸水性优于石灰石。
2. 石灰材料碱性的检验结果:酚酞指示剂在石灰乳中呈现红色,说明石灰乳具有碱性。
加入稀盐酸后,石灰乳颜色逐渐变浅,直至无色,说明石灰乳能与酸发生中和反应。
3. 石灰材料胶凝性的检验结果:石灰乳在恒温箱中逐渐硬化,形成石灰石胶凝体。

小粒度石灰石煅烧活性石灰研究石灰回转窑煅烧工艺对石灰石入窑粒度有着严格的要求,一般石灰石粒度比不宜大于3。
酒钢西沟矿供我公司石灰石粒度为10~65mm,石灰石粒度比大,如直接入窑煅烧,在煅炼过程中容易造成物料偏析,破坏物料塌落式运动轨迹;碎料被包裹在中间或和压在料层低端,影响分解速度,石灰石分解率下降,成品率降低[1];煅烧出的石灰中粉灰多,0~10mm 的粉灰占比20%~25%,石灰CaO 含量下降,不仅影响炼钢灰质量,还造成原料浪费。
为此,我们进行了小粒度石灰石煅烧试验,并在此基础上提出了三级筛分、分级煅烧的工艺方案。
一、煅烧试验试验采用西沟矿10~65mm 石灰石筛下10~20mm小粒度石灰石,其化学成分:CaO含量53%,MgO含量1.1%,SiO2含量1.3%。
(一)试验方法试验在马弗炉内进行,通过温度控制,在马弗炉内放入一定量的10~20mm 石灰石。
一般温度取1000℃、1050℃、1100℃、1150℃,煅烧时间取80min、120min、160min。
(二)试验结果及分析也随之由低到高;当温度达到1050℃并持续升高时,石灰活性度又呈下降趋势。
因此,最佳的煅烧温度在1000~1150 ℃之间,煅烧时间控制在2~2.3h,在此煅烧条件下生产出的石灰质量好、生烧率低、活性度能达到290ml 以上,完全能够满足烧结厂和炼钢厂使用要求。
试验结果表明,回转窑煅烧小粒度石灰石,进而实行石灰石分级煅烧的工艺方案是可行的。
二、原料预处理系统设备及预热器改造方案(一)原料预处理系统设备改造目前我公司上料系统配套有3台滚筒筛,滚筒筛无法实现分级筛分,故需要将滚筒筛分系统改为分级振动筛分系统。
在筛分设备的选型上,建议选择具备三级筛分效果的分级筛,将10mm以下粉料筛下入石灰石粉地仓,供烧结制粉用,10~20mm的入原料专用地仓,20~65mm 石灰石入原料专用地仓。
同时,配套安装相应的辅助设备及单机除尘、收尘管道等环保设施。
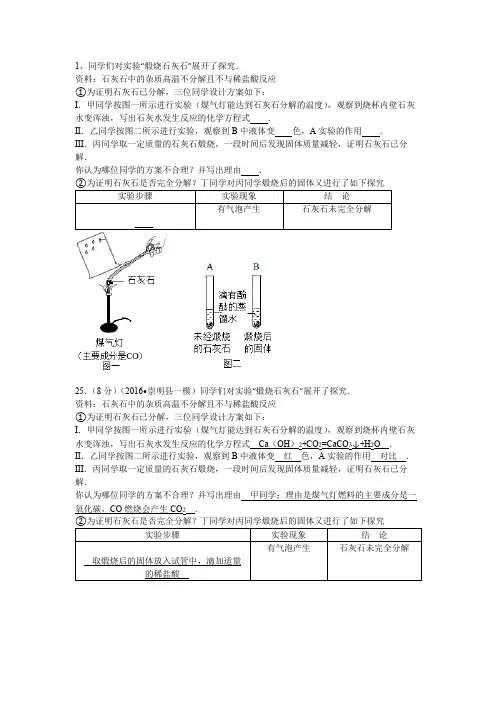
1、同学们对实验“煅烧石灰石”展开了探究.资料:石灰石中的杂质高温不分解且不与稀盐酸反应①为证明石灰石已分解,三位同学设计方案如下:I.甲同学按图一所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式.II.乙同学按图二所示进行实验,观察到B中液体变色,A实验的作用.III.丙同学取一定质量的石灰石煅烧,一段时间后发现固体质量减轻,证明石灰石已分解.你认为哪位同学的方案不合理?并写出理由.25.(8分)(2016•崇明县一模)同学们对实验“煅烧石灰石”展开了探究.资料:石灰石中的杂质高温不分解且不与稀盐酸反应①为证明石灰石已分解,三位同学设计方案如下:I.甲同学按图一所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O.II.乙同学按图二所示进行实验,观察到B中液体变红色,A实验的作用对比.III.丙同学取一定质量的石灰石煅烧,一段时间后发现固体质量减轻,证明石灰石已分解.你认为哪位同学的方案不合理?并写出理由甲同学;理由是煤气灯燃料的主要成分是一氧化碳,CO燃烧会产生CO2.【分析】①Ⅰ、石灰水变浑浊是由于二氧化碳和澄清石灰水发生了反应,该反应生成了难溶于水的碳酸钙,可以据此解答该题;Ⅱ、氧化钙可以和水反应生成氢氧化钙,而氢氧化钙溶液呈碱性,可以使酚酞试液变红,可以据此解答;Ⅲ、煤气灯的主要成分为一氧化碳,而一氧化碳燃烧生成了二氧化碳,可以据此解答该题;②根据碳酸盐遇到酸会生成二氧化碳气体.【解答】解:①Ⅰ、石灰水变浑浊是由于二氧化碳和澄清石灰水发生了反应,该反应生成了难溶于水的碳酸钙,其化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;Ⅱ、氧化钙可以和水反应生成氢氧化钙,而氢氧化钙溶液呈碱性,可以使酚酞试液变红,所以可以观察到试管B中液体变红,试管A起到了对照作用;Ⅲ、煤气灯的主要成分为一氧化碳,而一氧化碳燃烧生成了二氧化碳,所以澄清石灰水变浑浊不一定是来源于碳酸钙的分解,所以甲同学的方案不合理;②为证明石灰石是否完全分解,取煅烧后的固体放入试管中,滴加适量的稀盐酸,有气泡产生,石灰石未完全分解.故答案为:(1)Ⅰ、Ca(OH)2+CO2=CaCO3↓+H2OⅡ、红;对比(或比较,合理均可)Ⅲ、甲同学;理由是煤气灯燃料的主要成分是一氧化碳,CO燃烧会产生CO2(写全给分)②取煅烧后的固体放入试管中,滴加适量的稀盐酸.【点评】本题难度不是很大,掌握溶液的酸碱性、二氧化碳的化学性质、碳酸盐的化学性质等是正确解题的关键.2、Y型管是实验改进中经常使用的仪器,用下图所示装置(夹持固定仪器省略)来探究二氧化碳的相关性质.在不打开装置的情况下,将Y型管a向右倾斜,使稀硫酸流入装有碳酸钠的试管中,再恢复至图示装置的角度,即可产生二氧化碳.(提示:棉花的作用是防止反应速度过快,导致泡沫堵塞导管).①观察Y型管B的现象,可以证明二氧化碳的性质是,干燥的紫色石蕊试纸用于证明.在Y型管B中,只要用二张湿润紫色石蕊试纸,即可证明二氧化碳的密度大于空气,则湿润紫色石蕊试纸放置方法是.②预测Y型管C中可能出现的现象是.③证明CO2不能燃烧,不能支持燃烧的操作方法是.④有同学认为在A、B装置处添加E装置可以使实验更严密,E装置中无水硫酸铜的作用是,该药品不能用生石灰替代,用化学方程式解释主要原因是.【分析】①二氧化碳可与湿润的石蕊滤纸条中的水发生反应生成碳酸,碳酸可使石蕊变红,二氧化碳不能使石蕊变红;要证明二氧化碳密度比空气大,且不改变装置,可分别在Y型管管口和底部放置湿润紫色石蕊滤纸条进行实验,观察现象.②根据二氧化碳的性质分析.③证明CO2不能燃烧,可以使燃着的木条熄灭.④根据制取二氧化碳时可以带出少量水蒸汽以及二氧化碳后被生石灰吸收分析.【解答】解:①二氧化碳可与湿润的石蕊滤纸条中的水发生反应生成碳酸,碳酸可使石蕊变红,而二氧化碳不能使石蕊变红;证明二氧化碳的密度大于空气,可以将一张湿润紫色石蕊试纸放在Y型管管口,一张湿润紫色石蕊试纸放在Y型管底部.②二氧化碳与水发生反应生成碳酸,碳酸可使石蕊变红,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,所以澄清石灰水先变浑浊,过量的二氧化碳又可使石灰水变澄清;③证明CO2不能燃烧,可以将燃着的木条伸入D集气瓶中,木条会熄灭.④制取二氧化碳时可以带出少量水蒸汽,二氧化碳与水蒸气反应生成碳酸,也可能使干燥的紫色是蕊试纸变色,所以在A、B装置处添加E装置可以使实验更严密,E装置中无水硫酸铜的作用是吸收水分;如果无水硫酸铜用生石灰替代,会发生CaO+H2O=Ca(OH)2和CO2+Ca(OH)2=CaCO3↓+H2O反应,将二氧化碳吸收.故答案为:①二氧化碳与水反应;二氧化碳不能使干燥紫色石蕊试纸变红色;将一张湿润紫色石蕊试纸放在Y型管管口,一张湿润紫色石蕊试纸放在Y型管底部(合理给分)②石蕊变红色,澄清石灰水先变浑浊(后变澄清);③燃着的木条伸入D集气瓶中,熄灭.(合理给分)④吸收水分;CaO+H2O=Ca(OH)2;CO2+Ca(OH)2=CaCO3↓+H2O.【点评】本题考查了学生二氧化碳的性质分析解题和设计实验的能力,能训练学生的思维和应用知识解答问题的能力.3、某学习小组准备探究气体的测定和数据处理方法.【提出问题】利用碳酸钙与稀盐酸反应来测定生成CO2的量.【实验设计】通过下列两个实验分别测定CO2的质量和体积.【分析处理】实验一:①将小烧杯中的稀盐酸分几次加入到大烧杯中,并不断搅拌,判断反应后盐酸过量的依据是.②若稀盐酸足量,计算理论上能产生二氧化碳的物质的量实验二:③先连接好装置,再(填操作),然后装好药品,最后将20mL稀盐酸快速推入锥形瓶中.若缓慢推入,则可能造成的后果是.根据以上实验过程和数据综合分析,最终生成CO2的体积是mL.【反思与评价】⑤经过分析,下列说法错误的是.A.实验一的操作简单,便于读数B.实验一最终得到的数据和通过计算得出的理论值完全相等C.实验二在密闭体系内反应,更环保D.实验二中若将碳酸钙粉末改成块状的大理石,更安全.4、用碳、一氧化碳还原氧化铜的仪器、装置如图.(连接装置的橡皮管省略)请回答以下问题:①一氧化碳还原氧化铜的实验中,除A装置外,还需选用的仪器、装置组合是(填字母),选用该仪器、装置的目的是、.②碳还原氧化铜的实验中(将A中的酒精灯换成酒精喷灯),反应的化学方程式是.③用碳和一氧化碳还原氧化铜的两个实验中,装置A中观察到的现象是.④现有一包混有少量碳粉的氧化铜粉末,为了测定其碳粉的质量分数,称取m g样品进行高温加热,实验过程中获取两组数据:Ⅰ.反应前后仪器a中质量减少x g;Ⅱ.吸收生成物的仪器中质量增加y g.假设反应充分,称量准确,你认为应选择哪组数据进行计算会更为合理准确?你的理由是,请列出计算碳粉质量分数的式子.(用m、x、y表示).【分析】(1)根据最后一次加入稀盐酸后,电子天平上的示数不再发生变化进行解答;(2)根据石灰石和盐酸反应放出二氧化碳气体的化学方程式进行计算;(3)根据制取气体要先检查装置的气密性进行解答;(4)根据从第10分钟后气体的体积不再变化进行解答;(5)根据实验的图的优点在密闭体系内反应更加环保,现象更加直观进行解答.【解答】解:【分析处理】实验一:①将小烧杯中的稀盐酸分几次加入到大烧杯中,并不断搅拌,判断反应后盐酸过量的依据是最后一次加入稀盐酸后,电子天平上的示数不再发生变化.②nCaCO3==0.05mol.设产生的二氧化碳为xmolCaCO3+2HCl=CaCl2+H2O+CO2↑1 10.05mol x则,解得x=0.05mol故若稀盐酸足量,理论上能产生二氧化碳的物质的量为0.05mol.实验二:③先连接好装置,再检查装置气密性,然后装好药品,最后将20mL稀盐酸快速推入锥形瓶中.若缓慢推入,则可能造成的后果是锥形瓶内产生大量气体,压强变大,导致盐酸无法推入.根据以上实验过程和数据综合分析,最终生成CO2的体积是90mL﹣20mL=70mL.【反思与评价】⑤A.实验一的操作简单,便于读数,说法正确;B.实验一最终得到的数据和通过计算得出的理论值完全相等,说法错误;C.实验二在密闭体系内反应,更环保,说法正确;D.实验二中若将碳酸钙粉末改成块状的大理石,更安全,说法正确.故选:B.故答案为:(1)最后一次加入稀盐酸后,电子天平上的示数不再发生变化(或“不再减小”或“没有气泡产生”)(3)检查装置气密性;锥形瓶内产生大量气体,压强变大,导致盐酸无法推入;(4)70;(5)B.【点评】掌握装置气密性检验一般方法,本题主要考查分析和应用信息解答实际问题的能力,要结合物质的性质和反应规律进行综合分析.5、如图装置可用于探究可燃物的燃烧条件(夹持仪器略去)实验操作步骤及现象如下:第1步:检查装置气密性;第2步:如图所示加入药品;第3步:向B试管冷水中的白磷通氧气,白磷不燃烧;第4步:待A试管中不再产生氧气时,再向B试管中加入90℃的热水,白磷不燃烧第5步:向B试管热水中的白磷通氧气,白磷燃烧,产生白烟.①写出A试管中发生反应的化学方程式;第步和第5步26.(8分)如图装置(夹持仪器略去)可用于探究碳及其氧化物的某些性质.①甲处发生的化学方程式为;②丙处可观察黑色的氧化铜变为色,发生反应的化学方程式为;③丁处可观察到澄清石灰水变浑浊,发生反应的化学方程式为,该现象能否证明一氧化碳还原氧化铜的气体产物为二氧化碳?理由是;④从环保角度考虑,指出该装置的不足之处.【分析】大理石中的碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;高温条件下,二氧化碳和碳反应生成一氧化碳;高温条件下,一氧化碳和氧化铜反应生成铜和二氧化碳;二氧化碳能使澄清石灰水变浑浊;一氧化碳有毒,扩散到空气中会污染环境.【解答】解:①甲处中的碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,发生反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;②丙处可观察黑色的氧化铜变为红色,是因为氧化铜和一氧化碳反应生成了铜和二氧化碳,发生反应的化学方程式为:CO+CuO Cu+CO2;③丁处可观察到澄清石灰水变浑浊,是因为氢氧化钙和二氧化碳反应生成了碳酸钙和水,发生反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;该现象不能证明一氧化碳还原氧化铜的气体产物为二氧化碳,理由是甲处生成的CO2在乙处可能没有完全反应,丁中使澄清石灰水变浑浊的CO2可能是甲处生成的CO2;④从环保角度考虑,该装置的不足之处是缺少尾气处理装置.故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;红;CO+CuO Cu+CO2;Ca(OH)2+CO2═CaCO3↓+H2O;不能,甲处生成的CO2在乙处可能没有完全反应,丁中使澄清石灰水变浑浊的CO2可能是甲处生成的CO2;缺少尾气处理装置.【点评】实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.6、工业上利用高温分解石灰石(主要成分CaCO3,杂质不参与任何反应),得到生石灰.现实验室利用此原理来分析石灰石的纯度,使用100g原料,完全分解后得到固体64.8g,计算:(写出计算过程)(1)反应中得到的二氧化碳气体的物质的量为多少摩尔?(2)原料中的碳酸钙纯度为多少?7、生命离不开水,生活中也离不开水:①电解水可以说明水是由氢、氧元素组成的,写出水电解的方程式;②我们一般用到的水往往都是自来水,下图是课本中“自来水厂生产流程图”:步骤五可用O3来消毒,O3是(填写化学式)的同素异形体.步骤四的作用和实验室里(填写操作名称)作用相似.该图圈中“未净化的污水”最好改为.③在某些国家极度缺乏淡水,可利用海水淡化得到淡水.若1吨含可溶性物质3.5%的海水蒸发后浓度变为5%,则得到淡水吨.目前海水淡化用的较多的是“闪蒸”方法,是指一定温度的海水在压力突然降低的条件下,部分海水急骤蒸发的现象.多级闪蒸海水淡化是将经过加热的海水,依次在多个压力逐渐降低的闪蒸室中进行蒸发,将蒸汽冷凝而得到淡水.有关该方法说法正确的是(选填编号).A.送入闪蒸室前,要将海水加热至沸腾B.该方法可以将海水蒸干,可得到更多的淡水C.蒸发后的海水,还可作为生产食盐的原料D.该方法无需将海水进行预处理,就可生产.【分析】①根据通电能使水电解,在两极生成氢气和氧气解答;②根据臭氧和氧气为同素异形体解答;根据步骤四是将不溶性固体和液体分离解答;根据该图圈中“未净化的污水”最好改为自然界中较为纯净的水源解答;③根据蒸发前后溶质质量不变解答;【解答】解:①通电能使水电解,在两极生成氢气和氧气,化学方程式为:2H2O 2H2↑+O2↑;②臭氧和氧气为同素异形体;步骤四是将不溶性固体和液体分离,步骤四的作用和实验室里过滤作用相似.该图圈中“未净化的污水”最好改为自然界中较为纯净的水源;③设得到淡水的质量为x1t×3.5%=(1t﹣x)×5%x=0.3t海水淡化用的较多的是“闪蒸”方法,是指一定温度的海水在压力突然降低的条件下,部分海水急骤蒸发的现象.多级闪蒸海水淡化是将经过加热的海水,依次在多个压力逐渐降低的闪蒸室中进行蒸发,将蒸汽冷凝而得到淡水,由此可以看出:蒸发后的海水,还可作为生产食盐的原料是正确的.答案:①2H2O 2H2↑+O2↑;②O2;过滤;自然界中较为纯净的水源;③0.3;C【点评】解答本题要掌握净化水的方法等方面的知识,只有这样才能对相关方面的问题做出正确的判断.8、对一瓶久置出现变质的氢氧化钙固体进行如下探究活动.探究活动一:氢氧化钙样品是否完全变质.(1)用化学方程式表示氢氧化钙变质的原因:.取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数.实验装置(气密性良好)如图1所示.(3)将稀盐酸滴入样品中,产生气体的化学方程式为,反应一段时间后,当观察到(填实验现象),才停止滴加稀盐酸.(4)实验中量筒的作用是.(5)实验结束后,量筒内进入水的体积如图2所示,其读数为mL.【分析】(1)根据图象中的数据可以看出生成二氧化碳的质量为8.8g;(2)根据二氧化碳的质量和化学方程式计算参加反应的碳酸钠的质量,然后计算碳酸钠的质量分数;(3)根据质量守恒定律计算所得溶液的质量.【解答】解:(1)从图象中的数据可以看出,生成二氧化碳的质量为8.8g;(2)设参加反应的碳酸钠的质量为xNa2CO3+2HCl=2NaCl+H2O+CO2↑106 44x 8.8g=x=21.2g所以纯碱样品中所含Na2CO3的质量分数为:×100%=92.2%;(3)所得到的溶液质量为:23+150+160﹣8.8=324.2g.故答案为:(1)8.8g;(2)92.2%;(3)324.2g.【点评】本题主要考查化学方程式的书写和有关化学方程式的计算,完成此题,可以依据已有的知识进行.。

试验报告记录编号:BBAABB010/01-020-01A试验地点第二炼钢厂转炉作业区试验时间2013.1至2014.8厂家名称物资名称石灰石炼钢厂:为推进渣辅料的降本增效,2013年1月至2014年8月15日,120吨转炉试用石灰石共计550吨,石灰石理化指标如下表1:表1.石灰石理化指标成分(质量分数)/% 粒度CaO SiO2 S P <10mm 10mm-30mm >30mm ≥53.0≤1.2≤0.040≤0.008≈5% ≈90% ≈5%实验过程中平均每炉加入量在300~1000kg,现将试用过程中的数据予以整理、总结、分析,并与预期目标进行对比,实验总结如下:1、实验的预目的本次实验的目的主要如下:1)石灰石代替铁矿石降温实现降低铁矿石消耗的成本2)石灰石代替部分石灰冶炼进行降本增效2、试用过程中的实际效果1、石灰石代替铁矿石的降温效果为了验证石灰石在实际使用中的降温效果,转炉作业区按照不同的加入量,不同温度区间对石灰石的温降效果进行了跟踪验证,实际的数据如下表2。
表2.石灰石降温数据石灰石加入前的温度区间(O C)规定加入量(kg)加入前平均温度(O C)加入后平均温度(O C)平均温降(O C)1660~1670 500 1663 1658 6 700 1665 1657 81000 1668 1657 111670~1680 500 1673 1669 4 700 1676 1670 6 1000 1679 1671 8由表2的数据可以看出,加入石灰石前温度区间在1660~1670 ℃时,石灰石的温降效率达到了1.14 ℃/100kg,达到了预期效果;石灰石在冶炼过程中作为冷却剂加入时,570kg石灰石相当于300kg矿石的冷却效果,可降低钢水温度约5℃。
其中:570Kg石灰的价格为:0.57吨×90元/吨=51.3元300kg球团矿的价格为:0.3吨×970元/吨=291元在使用石灰石的炉次中,它的作用主要体现在降温效果上。

生石灰检验报告1. 背景介绍生石灰,又称石灰石煅烧所得的氧化钙,因其具有良好的石灰性质,被广泛应用于建筑、农业、化工等行业。
本报告旨在对生石灰进行检验,以评估其质量和可靠性。
2. 检验目的本次生石灰检验的主要目的是确认样品是否符合相关标准要求,具体包括以下几个方面:•检测生石灰的化学成分及含量;•测试生石灰的物理性质,如颗粒大小、比重等;•检验生石灰的水分含量;•评估生石灰的质量和可靠性。
3. 检验方法3.1 化学成分分析检测生石灰的化学成分需要使用化学分析方法,常用的方法有以下几种:•萤石滴定法:用萤石作为指示剂,用稀硝酸滴定生石灰样品,根据消耗的萤石溶液体积计算出生石灰中氧化钙的含量;•火花频谱法:将生石灰样品置于电弧中,通过对产生的火花频谱进行分析,确定化学成分;•X光衍射法:通过探测物质所发出的X光进行化学成分分析。
3.2 物理性质测试测定生石灰的物理性质需要使用一系列专业仪器,并进行相应的实验操作。
主要测试项目包括:•颗粒大小分析:使用粒度分析仪测定生石灰样品中颗粒的大小分布情况,得出平均颗粒大小和颗粒分布范围;•比重测定:通过称量生石灰样品在空气中的质量和在水中的质量,计算出其比重;•孔隙率测试:利用孔隙度测定仪测量生石灰样品的孔隙率。
3.3 水分含量检测生石灰的水分含量是衡量其质量和稳定性的一个重要指标,可使用以下方法进行检测:•烘箱法:将生石灰样品置于特定温度下,经过一段时间后再称量样品的质量,计算出水分含量;•气相色谱法:通过气相色谱仪测定生石灰样品中水分的含量。
4. 检验结果与讨论经过以上的检验方法,我们得到了以下生石灰样品的检验结果:•化学成分分析:氧化钙(CaO)含量为XX%,符合标准要求;•物理性质测试:平均颗粒大小为Xμm,颗粒分布范围为X-Xμm,比重为Xg/cm³,孔隙率为X%;•水分含量检测:水分含量为X%。
根据以上检验结果,可以得出结论:本次生石灰样品符合相关标准要求,化学成分、物理性质及水分含量均在合理范围内。
第1篇实验名称:石灰材料性质研究一、实验目的1. 了解石灰材料的来源、组成及用途。
2. 掌握石灰材料的物理性质和化学性质。
3. 研究石灰材料在不同条件下的反应及变化。
二、实验原理石灰材料主要成分为氧化钙(CaO),俗称生石灰。
生石灰遇水后,会发生水化反应生成氢氧化钙(Ca(OH)2),俗称熟石灰。
熟石灰与空气中的二氧化碳(CO2)反应,会生成碳酸钙(CaCO3),俗称石灰石。
三、实验用品1. 生石灰2. 熟石灰3. 碳酸钙粉末4. 水5. 澄清石灰水6. 烧杯7. 试管8. 滴管9. 滤纸10. 酒精灯11. 移液管四、实验步骤1. 物理性质观察(1)观察生石灰的颜色、形状、质地等物理性质。
(2)观察熟石灰的颜色、形状、质地等物理性质。
(3)观察碳酸钙粉末的颜色、形状、质地等物理性质。
2. 化学性质研究(1)生石灰与水反应取一定量的生石灰放入烧杯中,加入适量水,观察反应现象,并记录。
(2)熟石灰与二氧化碳反应取一定量的熟石灰放入试管中,加入适量澄清石灰水,观察反应现象,并记录。
(3)碳酸钙粉末与盐酸反应取一定量的碳酸钙粉末放入烧杯中,加入适量盐酸,观察反应现象,并记录。
3. 实验现象分析(1)生石灰与水反应:生石灰遇水后,迅速放热,产生大量气泡,形成白色沉淀。
(2)熟石灰与二氧化碳反应:熟石灰与澄清石灰水反应,产生白色沉淀,使澄清石灰水变浑浊。
(3)碳酸钙粉末与盐酸反应:碳酸钙粉末与盐酸反应,产生气泡,溶液变浑浊。
五、实验结论1. 生石灰遇水会发生水化反应,生成氢氧化钙。
2. 熟石灰与二氧化碳反应,生成碳酸钙。
3. 碳酸钙粉末与盐酸反应,生成二氧化碳气体。
六、实验讨论1. 生石灰、熟石灰和碳酸钙粉末在物理性质和化学性质上有所不同,通过实验可以观察到明显的差异。
2. 生石灰遇水放热,反应剧烈,需要注意安全。
3. 熟石灰与二氧化碳反应,生成碳酸钙,可用于制备建筑材料。
4. 碳酸钙粉末与盐酸反应,产生二氧化碳气体,可用于检验二氧化碳的存在。
石灰试验检测报告一、实验目的:本次实验的目的是对石灰进行检测分析,探究其化学成分和物理性质。
二、实验设备与试剂:设备:量筒、试管、玻璃棒、燃烧瓶、温度计等。
试剂:石灰(氧化钙,CaO)、稀盐酸(HCl)、稀硫酸(H2SO4)、溴酸(HBrO3)等。
三、实验步骤与方法:1.化学成分分析a.取一个试管,将石灰粉末加入到试管中。
b.用滴管取一滴稀盐酸滴到试管中,观察是否有气体产生。
c.用滴管取一滴稀硫酸滴到试管中,观察是否有气体产生。
d.用滴管取一滴溴酸滴到试管中,观察是否有气体产生。
2.物理性质检测a.取一定量的石灰粉末放入燃烧瓶中。
b.使用火柴点燃燃烧瓶中的石灰粉末。
c.观察在燃烧过程中是否产生明亮的火光。
d.利用温度计测量燃烧瓶内部的温度变化。
四、实验结果与数据分析:1.化学成分分析根据实验观察,稀盐酸与石灰发生反应时有气体产生,推测石灰中可能含有氢氧化钙(Ca(OH)2)。
而稀硫酸和溴酸与石灰无明显反应,说明石灰中没有含有碳酸钙(CaCO3)。
2.物理性质检测在石灰粉末燃烧过程中观察到了明亮的火光,说明石灰能够产生强烈的燃烧现象。
利用温度计测量燃烧瓶内部的温度变化,可以得到燃烧过程中的温度变化图表。
五、结论:通过本次石灰试验检测分析,得到了以下结论:1.石灰中可能含有氢氧化钙(Ca(OH)2)。
2.石灰具有良好的燃烧性能,并能产生明亮的火光。
3.石灰在燃烧过程中会得到较高的温度。
六、实验总结:本次实验通过对石灰的化学成分和物理性质进行检测分析,了解到了石灰的部分特点。
石灰作为一种常见的化学物质,在工业生产和农业生产中有着广泛的应用。
而本次实验只是对石灰进行了初步的分析探究,未来还可以进一步进行更细致的研究和应用。
石灰石烧裂率测试实验报告
选取三种色泽的石头(白色为方解石、浅灰色、深灰色为普通石灰石),进行烧裂率对比测试。
一、测试步骤如下:
1、在石灰石料场选取白色石头一块,浅灰色石头两块,深灰色石头一块(见下图);
2、将三种色泽石头共四块放置于马弗炉热电偶两侧(见下图),缓慢升温至950℃,然后保温两个小时;
3、关闭马弗炉,待温度稍降取出四块团灰置于托盘上观察实验结果(见下图)。
二、实验结果对比如下
1、白色石头(方解石)实验前:
2、浅灰色石头(普通石灰石)实验前:
3、深灰色石头(普通石灰石)实验前:
4、强度测试,轻度挤压前四块石灰状态:轻度挤压后四块石灰状态:
三、实验结论及建议:
1、浅灰色石头为普通石灰石,煅烧后石灰颜色较白,强度符合要求;
2、深灰色石头也是普通石灰石占有一定比例,煅烧后石灰颜色白中带黄,其强度略高于白色石灰;
3、白色石头为方解石,煅烧后石灰颜色较白,表面布满裂纹,轻轻碰触后就碎裂,其强度低。
4、本次实验是在马弗炉内进行的静态、低温(950℃)煅烧实验,若将其置于麦窑的动态、高温(1050℃)工况下,则方解石会在煅烧带因高温分解爆裂、物料间的磨擦撞击下
碎裂,并在石灰冷却风的作用下风化成粉(既使有块状方解石灰出窑,也会在后步提升、运输、筛分、入仓过程中碎裂成小粒或粉状)。
5、方解石在煅烧带碎裂后也会局部气路堵塞,使石灰窑内热气流分布不均、窑压升高而不利于优质、低耗、高效生产,因此应严格进厂原材料控制,杜绝方解石和其他杂石进窑,以充分发挥石灰窑的技术优势。
石灰石煅烧试验报告安钢冶金炉料公司石灰石煅烧试验报告一、目的任务对冶金炉料公司不同供户的石灰石进行试验研究,掌握其样品特性、煅烧性能,并根据这些特性进行分类,为石灰石供户优化选择提供依据。
二、试验设备及仪器箱式电阻炉,天平,化验分析^p 仪器等。
三、取样制样与化验取样:到采石场现场取样,样品块度大于 20mm,在每个采石场沿工作面按等距离跨度取 10 块样品。
制样:在白灰厂化验室制样,用锤子将取来的石灰石样品,制成约 80mm、700g 左右的球形煅烧样品。
同时,将剩余石灰石,用破碎机破碎后,制成青石化验样。
化验:青石样品送地质队化验室化验,化验项目分为CaO、MgO和 SiO2 三项,化验结果直接采用。
煅烧后的石灰,在白灰厂化验室化验活性度。
四、煅烧试验取 6 块同一供户的石灰石样品,在托盘天平上称重,记录重量,当箱式电阻炉升温至550℃时,将样品入炉,保持一定的升温速率(升温约30 分钟到1050℃),当升温至1050℃时箱式电阻炉自动恒温,在此温度下煅烧60 分钟,断电降温60 分钟(炉内温度降至600℃以下),将煅烧后的石灰取出,在室内冷却至室温后称重,并送化验室化验石灰活性度。
五、试验数据煅烧试验数据表煅烧前煅烧后石灰石石灰石石灰石煅烧后样品采样地石灰石石灰重CaO含石灰活MgO含量SiO2 含编号点块数量量备注重量量性度(g) (g)016新兴4205 3059 249 026育新4059 2913 327 036石堂4110 3048 250 046英雄4005 2905 273 055东傍佐2528 248 066一块黄鑫发4210 3081 270 076卜居头4220 3061 270 086宏达4216 3052 290 096南街北4189 3133 2616后街4145 3147251126一块裂东脑4158 2824243136马辛庄4060 2945285146铜冶4040 2902243六、数。
石灰石煅烧试验报告试验目的:了解石灰石的煅烧性能,确定其煅烧温度对生产石灰的影响。
试验原理:石灰石在高温下进行煅烧,产生二氧化碳和石灰,并释放出热量。
石灰石主要由碳酸钙(CaCO3)组成,煅烧时,碳酸钙分解成二氧化碳和氧化钙(CaO)。
二氧化碳挥发,氧化钙则称为生石灰,可用于水泥、钢铁、冶金等工业。
试验设备:1800℃高温电炉、研磨器、计时器、天平等。
试验步骤:1. 将石灰石样品研磨成粉末,粒径控制在3mm以下。
2.将石灰石样品放入高温电炉中,加热到1000℃,保持1小时。
3. 以100℃/min的速率将温度升至1200℃,保持1小时。
4.将试验结束后的石灰石样品冷却,并称量质量。
5.对比不同煅烧温度下的石灰石样品质量,分析煅烧温度对产量的影响。
试验结果:根据试验结果,得到以下数据:煅烧温度(℃),石灰石质量(g)-------------,--------------1000,501200,40根据数据可以看出,煅烧温度对石灰石的质量有一定影响。
在相同时间内,较高的煅烧温度导致石灰石的质量减少。
这是因为高温下,碳酸钙分解的速度加快,二氧化碳挥发速度加快,导致石灰石的质量减少。
结论:根据试验结果可以得出结论,煅烧温度越高,石灰石质量越小。
因此,在生产石灰时,选择合适的煅烧温度对于保证石灰石产量是非常重要的。
同时,在石灰石煅烧过程中,还需要考虑其他因素,如煅烧时间、研磨细度等,以便获得更理想的石灰产品。
展望:本次试验只考察了不同温度下的石灰石质量变化,下一步可以对其他因素进行进一步研究,如煅烧时间、研磨细度等的影响。
通过进一步深入的研究,可以得到更全面的石灰石煅烧性能,为石灰产业的发展提供科学依据。
安钢冶金炉料公司
石灰石煅烧试验报告
一、目的任务
对冶金炉料公司不同供户的石灰石进行试验研究,掌握其样品特性、煅烧性能,并根据这些特性进行分类,为石灰石供户优化选择提供依据。
二、试验设备及仪器
箱式电阻炉,天平,化验分析仪器等。
三、取样制样与化验
取样:到采石场现场取样,样品块度大于200mm,在每个采石场沿工作面按等距离跨度取10块样品。
制样:在白灰厂化验室制样,用锤子将取来的石灰石样品,制成约80mm、700g左右的球形煅烧样品。
同时,将剩余石灰石,用破碎机破碎后,制成青石化验样。
化验:青石样品送地质队化验室化验,化验项目分为CaO、MgO和SiO2三项,化验结果直接采用。
煅烧后的石灰,在白灰厂化验室化验活性度。
四、煅烧试验
取6块同一供户的石灰石样品,在托盘天平上称重,记录重量,当箱式电阻炉升温至550℃时,将样品入炉,保持一定的升温速率(升温约30分钟到1050℃),当升温至1050℃时箱式电阻炉自动恒温,在此温度下煅烧60分钟,断电降温60分钟(炉内温度降至600℃以下),将煅烧后的石灰取出,在室内冷却至室温后称重,并送化验室化验石灰活性度。
五、试验数据
煅烧试验数据表表1
六、数据计算
根据表1中的煅烧试验数据,计算烧失率、石灰石分解率、生烧率、白灰CaO含量、MgO含量、SiO2含量。
计算结果见表2。
计算结果表表2
七、数据分析
根据采样地点和有关资料推断,我公司目前焦炭石灰竖炉所采用的石灰石,产出地层分别是中奥陶统马家沟组第五岩性段和第七岩性段。
第五岩性段,其岩性特征为灰色、深灰色中厚层状、隐晶花斑石灰岩,是水泥用石灰岩的主要产出地层,由下而上划分五个亚层,因该岩性段石灰石杂质含量高(尤其是SiO2),一般不用作优质冶金石灰的原料。
第七岩性段,
位于中奥陶统石灰岩地层最上部,为深灰色或灰色纯质石灰原料,局部夹浅黄褐色薄层状白云质灰岩,厚度大,质量佳,层位稳定,根据层位、岩性和化学成分的不同,由下而上划分七个亚层。
从表1和表2的数据可以看出,育新、英雄、南街、后街、石堂、东傍佐石灰石中CaO+MgO含量都大于55%,SiO2含量小于%,石灰中SiO2含量小于%。
而新兴、宏达、马辛庄、铜冶、卜居头、东脑、鑫发石灰石中CaO+MgO 含量都小于55%,SiO2含量大于%,石灰中SiO2含量在石灰石没有完全分解的情况下已大于%(冶金一级灰标准SiO2含量<%)。
从段烧性能上分析,因东脑石灰石样品在煅烧过程中一块破碎,分解率最高,达到%,其他石灰石样品在该煅烧条件下分解率基本维持在60%左右。
分解率大于65%的有东脑、铜冶和育新,分解率大于60%小于65%的有宏达、卜居头、马辛庄、鑫发和英雄,分解率低于60%的有后街、南街北和石堂。
从段烧后的石灰质量分析,活性度大于300ml的有育新,活性度大于250ml小于300ml的有宏达、马辛庄、英雄、鑫发、卜居头、南街北和后街,活性度小于等于250ml的有石堂、新兴、东傍佐、铜冶和东脑。
八、结论
⒈除东脑因一块石灰石在段烧过程中碎裂分解率异常外,其他石灰石分解率均在60%左右,煅烧性能因石灰石产出地层不同,石灰石中杂质含量不同而存在差异,但总体上来看差异性不大。
⒉从产地和有关资料知,育新、英雄、南街、后街、鑫发、石堂和东傍佐为中奥陶统马家沟组第七岩性段石灰岩,除鑫发异常外,其他CaO+MgO 含量高,SiO2等杂质含量低,为煅烧优质冶金石灰的原料。
新兴、宏达、马
辛庄、铜冶、卜居头、东脑为中奥陶统马家沟组第五岩性段石灰岩,石灰石中CaO+MgO含量比第七岩性段石灰岩低,SiO2含量高于国家一级灰标准。
⒊在相同煅烧条件下,13家供户样品煅烧出的石灰活性度与石灰石中CaO和MgO含量的关系规律性不强,与分解率的关系规律性亦不强。
⒋本次试验因取样方法、取样数量、煅烧次数及化验误差等原因,代表性可能不强,试验结果不可避免地存在一定误差,试验数据和结论仅作为参考。
安全生产技术部
物资供销部
政工部
二OO六年六月十九日。