单克隆抗体和重组治疗性蛋白质的聚体分析
- 格式:doc
- 大小:29.00 KB
- 文档页数:11

重组蛋白表征目录1. 重组蛋白介绍重组蛋白治疗药物的生产 . ........................................................................04 ........................................................................04 从药物发现到药物开发 ............................................................................04 蛋白治疗药物的表征 ................................................................................05 执行关键的QA/QC 程序 . ......................................................................... 05 应对重组蛋白药物表征的挑战 (05)2. 生物过程监控 .........................................................................06 生物过程分析技术总结 ............................................................................08 安捷伦应用文献........................................................................................ 083. 完整蛋白质的鉴定、纯度和杂质分析完整蛋白质的鉴定、纯度和杂质分析技术汇总 . ................................09 ......................................11 安捷伦应用文献........................................................................................ 124. 糖基化分析糖链分析技术汇总 . .............................................................................13 . ................................................................................... 17 安捷伦应用文献........................................................................................ 185. 肽图分析肽图分析技术汇总 . .................................................................................19 . ................................................................................... 22 安捷伦应用文献........................................................................................ 226. 电荷异构体电荷异构体分析技术汇总 . ............................................................................ 23......................................................................... 25 安捷伦应用文献........................................................................................ 257. 聚集聚集体分析技术汇总 . ........................................................................................26 ................................................................................28 安捷伦应用文献........................................................................................ 288. 氧化氧化分析技术汇总 . .........................................................................................29 ....................................................................................31 安捷伦应用文献........................................................................................ 319. 氨基酸分析氨基酸分析技术汇总 .............................................................................32 . ....................................................... ........................ 34 安捷伦应用文献. (34)3重组蛋白治疗药物的生产从药物发现到药物开发4过去,大多数药物都是化学合成的小分子。

单克隆抗体的应用与研究单克隆抗体是一种特殊的抗体,由单个克隆的浆细胞所分泌。
相比多克隆抗体,单克隆抗体具有更好的特异性和稳定性,因此在医学、生物学、分子生物学等领域有广泛的应用。
本文将介绍单克隆抗体的研究进展和应用。
一、单克隆抗体的制备单克隆抗体的制备可以分为三个步骤:免疫原制备、免疫动物及其免疫和细胞融合和筛选。
首先需要制备免疫原,这个免疫原通常是目标抗原或者抗体对其特异性的区域片段。
如果是目标抗原,通常要首先纯化得到。
其次,需要为制备单克隆抗体的动物进行免疫。
一般是选择小鼠等实验动物,将免疫原注射到动物身体内,让它们产生特异性抗体。
之后,需要从这些动物体内获取免疫细胞,即B淋巴细胞。
最后,需要使用细胞融合技术通过融合免疫B细胞和癌细胞,来获取产生单克隆抗体的杂交瘤细胞。
这些细胞能够长期分泌具有特异性的抗体,并形成混合瘤。
通常,这些细胞的混合物需要进行严格的筛选和鉴定,以确保其产生的抗体都是特异性单克隆抗体。
二、单克隆抗体的应用1. 诊断和治疗单克隆抗体在临床上的应用越来越广泛。
例如,它们可以用于诊断和治疗晚期癌症。
新兴的单克隆抗体医学治疗(Monoclonal Antibody Therapy,MAT)被评价为一种有希望的抗癌治疗方法,特别是在血液系统的癌症治疗方面。
由于单克隆抗体的特异性,可以通过将它们与药物或放射性同位素结合,使它们更好地治疗癌症。
2. 分子生物学在分子生物学领域,单克隆抗体经常用来在Western blotting和其他分析技术中检验目标蛋白质的存在。
单克隆抗体还可用于免疫共沉淀、免疫沉淀、染色和免疫组化等实验中。
3. 生物分子检测单克隆抗体也广泛应用于药品研究和开发,例如用于高度灵敏的免疫印迹,以检测蛋白质、肽和DNA序列等生物分子。
此外,单克隆抗体还用于流式细胞术、细胞分选、病毒、菌和细胞诊断。
三、单克隆抗体的未来单克隆抗体作为一种新型的生物技术,其应用领域正在不断拓宽。


906[作者简介]韦薇,女,审评员,主要从事药品审评工作。
联系电话:(010)68585566,E-mail :weiw@cde.org.cn 。
重组单克隆抗体相关物质和相关杂质的研究与评价韦薇,罗建辉,尹红章,项金忠(国家食品药品监督管理总局药品审评中心,北京100038)[摘要]重组生物技术制备的单克隆抗体(以下简称重组单抗)是生物制品中一类重要的药物类别。
近年来,由于其精确的靶向杀伤和中和等生物学效应,重组单抗在肿瘤、自身免疫性疾病等方面受到了广泛的研究和应用,并且在神经学、眼科学等其他疾病领域的研究也开始逐步发展起来。
目前,国内生产的重组单抗主要采用真核细胞培养表达的方法,在工艺研发和质量研究方面,药品企业对主要有效成分的结构研究和质量控制关注较多;但是对产品组成中的杂质和相关物质研究较少或关注度不够。
考虑到这些杂质或相关物质是重组单抗产品中的重要组成部分,将会影响到产品的质量、临床应用的安全性和有效性,应在研究中予以重视。
本文对重组单克隆抗体产品中相关杂质和相关物质的研究和评价进行了探讨。
[关键词]重组单抗;产品相关物质;产品相关杂质;工艺相关杂质[中图分类号]R95[文献标志码]C[文章编号]1003-3734(2014)08-0906-06Comments on the development and assessment of the drug impuritiesand substances related to recombinant monoclonal antibodiesWEI Wei ,LUO Jian-hui ,YIN Hong-zhang ,XIANG Jin-zhong(Center for Drug Evaluation ,China Food and Drug Administration ,Beijing 100038,China )[Abstract ]Recombinant monoclonal antibodies have been established as a major product class of biotech-nology-derived medicinal products and widely applied in the clinical fields of oncology ,autoimmune disease as well as neurology ,ophthalmology and so on ,due to their precisely targeted biological activates of cytotoxic and neutrali-zing effect in recent years.Nowadays ,pharmaceutical enterprises of China usually pay more attention towards the structure and quality control of the main substance produced from eukaryotic cells ,rather than the related impurities and substances.However ,these impurities and substances are parts of the product components ,and may impact on product quality 、clinical safety and effectiveness.Therefore ,they should be recognized as equally important as the main substance and be investigated.This article will present comments on the research and evaluation of the related impurities and substances in recombinant monoclonal antibody products.[Key words ]recombinant monoclonal antibody ;product-related substances ;product-related impurities ;process-related impurities重组单抗在表达、制备或是储存过程中,由于各种微环境的影响,如机械剪切、氧化作用、酶的作用等物理、化学或生物因素,导致抗体的降解或发生翻译后修饰,从而获得异质性(heterogeneity ),产生变异体(variants ),如片段化、氧化、脱氨基等。



单克隆抗体等电点
单克隆抗体(mAb)的一个重要特征是它们的等电点(pI),本质上是抗体不带净电荷时的pH值,该值取决于抗体所含的带电氨基酸。
如果周围环境的pH值低于抗体的pI,则该分子带有净正电荷,而当pH值高于pI时,抗体将带有净负电荷。
在评估治疗性抗体的药代动力学(PK)特性时,靶介导的药物处置(TMDD)与非靶标相关机制都会影响整体PK行为,pI是后者的重要因素。
由于大多数细胞表面带负电荷,抗体需要带正电荷以进行有效的液相内吞作用(胞饮作用),因此环境pH值需要低于抗体的pI。
常用的检测单克隆抗体等电点的方式有电聚焦凝胶电泳(IEF)、阳离子交换色谱(CEX)、阴离子交换色谱、毛细管等电聚焦(CIEF),以及成像毛细管等电聚焦(iCIEF)等。
等电点值反映了蛋白质药物电荷与空间构象的均一性。
在实际应用中,单克隆抗体等电点的准确测定对于抗体药物的生产和质量控制至关重要。

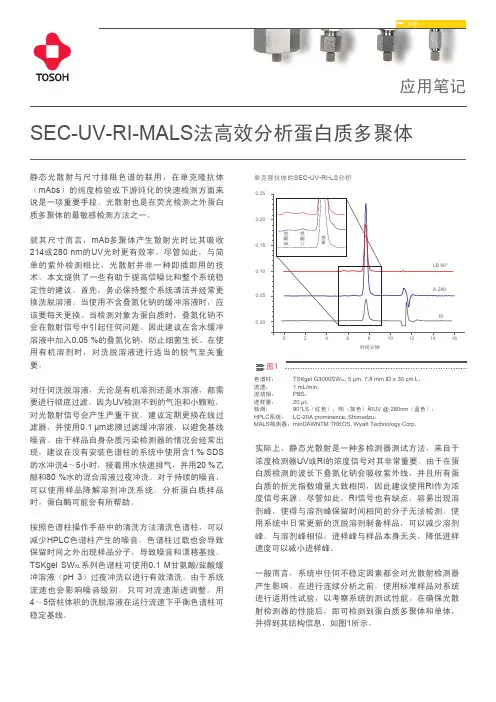
静态光散射与尺寸排阻色谱的联用,在单克隆抗体(mAbs )的纯度检验或下游纯化的快速检测方面来说是一项重要手段。
光散射也是在荧光检测之外蛋白质多聚体的最敏感检测方法之一。
就其尺寸而言,mAb 多聚体产生散射光时比其吸收214或280 nm 的UV 光时更有效率。
尽管如此,与简单的紫外检测相比,光散射并非一种即插即用的技术。
本文提供了一些有助于提高信噪比和整个系统稳定性的建议。
首先,务必保持整个系统清洁并经常更换洗脱溶液。
当使用不含叠氮化钠的缓冲溶液时,应该要每天更换。
当检测对象为蛋白质时,叠氮化钠不会在散射信号中引起任何问题。
因此建议在含水缓冲溶液中加入0.05 %的叠氮化钠,防止细菌生长。
在使用有机溶剂时,对洗脱溶液进行适当的脱气至关重要。
对任何洗脱溶液,无论是有机溶剂还是水溶液,都需要进行彻底过滤。
因为UV 检测不到的气泡和小颗粒,对光散射信号会产生严重干扰。
建议定期更换在线过滤器,并使用0.1 μm 滤膜过滤缓冲溶液,以避免基线噪音。
由于样品自身杂质污染检测器的情况会经常出现,建议在没有安装色谱柱的系统中使用含1 % SDS 的水冲洗4~5小时,接着用水快速排气,并用20 %乙醇和80 %水的混合溶液过夜冲洗。
对于持续的噪音,可以使用样品降解溶剂冲洗系统。
分析蛋白质样品时,蛋白酶可能会有所帮助。
按照色谱柱操作手册中的清洗方法清洗色谱柱,可以减少HPLC 色谱柱产生的噪音。
色谱柱过载也会导致保留时间之外出现样品分子,导致噪音和漂移基线。
TSKgel SW XL 系列色谱柱可使用0.1 M 甘氨酸/盐酸缓冲溶液(pH 3)过夜冲洗以进行有效清洗。
由于系统流速也会影响噪音级别,只可对流速渐进调整。
用4~5倍柱体积的洗脱溶液在运行流速下平衡色谱柱可稳定基线。
1色谱柱:流速:流动相:进样量:检测:HPLC 系统:MALS 检测器:TSKgel G3000SW XL , 5 µm, 7.8 mm ID x 30 cm L ; 1 mL/min ; PBS ; 20 µl ; 90°LS (红色),RI (灰色)和UV @ 280nm (蓝色); LC-20A prominence, Shimadzu ;minDAWNTM TREOS, Wyatt Technology Corp.时间分钟0.250.200.150.100.050.00SEC-UV-RI-MALS 法高效分析蛋白质多聚体单克隆抗体的SEC-UV-RI-LS 分析应用笔记分析实际上,静态光散射是一种多检测器测试方法,来自于浓度检测器UV 或RI 的浓度信号对其非常重要。

D-二聚体检测常见问题近年来,D-二聚体作为体内交联纤维蛋白水解的标志性产物,其临床诊断价值已得到普遍认同。
它以其高度的敏感性和阴性预示能力,在深静脉血栓(DVT)和肺栓塞(PE)的排除、弥散性血管内凝血(DIC)的诊断及溶栓治疗监测等方面具有良好的临床应用价值。
虽然D-二聚体检测已得到推广普及,但在D-二聚体实际应用中,仍存在一些对检测参数的认识误区,致使实验室对一些检测结果难以为临床提供合理解释,对由于方法学不同造成的检测结果差异缺乏足够的理解,给科室质量管理带来困惑。
一、不同试剂检测结果不可比性D-二聚体检测的基本原理均是基于抗原抗体反应。
自1983年Rylatt等最先报道了D-二聚体的单克隆抗体后,有20多种D-二聚体单抗研发问世,目前有超过30种检测方法和20多种单抗被使用。
由于方法学上的原因,不同试剂测定同一份标本中的D-二聚体浓度往往不具有可比性。
其原因主要有:1.单克隆抗体不同这里需要说明的是,我们通常所说的“D-二聚体”,在循环体内并不是一个结构简单均一的物质,而是含有D-二聚体结构的大小不同片段的混合物(如DD、DY、XD、XY、DXD、YXD、DXXD等,分子量为190KDa-720KDa)。
针对不同片段制备的单克隆抗体对同一份血浆中不同片段的结合能力也不同。
目前尚无国际统一标准的单抗,也无统一的参考方法。
另外,在自动化凝血仪上采用的免疫比浊法测定还受到乳胶颗粒特征的影响,各试剂制造商选择乳胶颗粒大小不等,结合单抗能力也有差异,反应后吸光特性也不一样。
单克隆抗体特异性差异和试剂生产工艺的不同,致使各试剂间检测D-二聚体的结果缺乏可比性。
2.报告结果缺乏统一的标准单位D-二聚体检测的报告单位通常包括纤维蛋白原等量单位(FEU)和D-二聚体单位(DDU)两种形式。
FEU是将D-二聚体的量用降解前纤维蛋白原分子的量来表达,因此,用FEU表达的D-二聚体的量相当于用DDU表达的约1.7-2.0倍。

几种单克隆抗体表位的分析方法综述-免疫学论文-基础医学论文-医学论文——文章均为WORD文档,下载后可直接编辑使用亦可打印——摘要:单克隆抗体具有高度均一性及对靶分子的高亲和性、特异性,已广泛应用于自身免疫性疾病、炎性疾病和癌症的治疗。
单克隆抗体与相应抗原的反应性决定于其所识别的抗原表位,确定相应表位在抗原结构上的位置是单克隆抗体筛选中的关键步骤。
本文主要对几种单克隆抗体表位的分析方法,包括ELISA法、生物酶解法及化学切割法、噬菌体随机肽库、X-射线晶体学、丙氨酸扫描、氢氘交换质谱(hydrogen/deuterium exchange mass spectrometry, HDX-MS)、生物信息学表位预测方法的原理、特点及研究进展作一综述。
关键词:单克隆抗体;抗原表位;酶联免疫吸附试验;噬菌体随机肽库;X-射线晶体学;丙氨酸扫描;氢氘交换质谱;生物信息学;单克隆抗体技术的出现不仅促进了免疫学的发展,也促进了许多其他学科的发展,该技术广泛用于医学领域,已成为重要的临床诊断手段和有效的药物治疗方法[1], 特别是治疗性单克隆抗体已成为近几年来生物制药业发展最快的领域之一[2], 同时,也为一些新技术提供了基础平台,如抗体偶联药物[3]、双特异性抗体[4]及新兴的CAR-T细胞治疗[5-6].由于单克隆抗体具有高度均一性及对靶分子的高亲和性、特异性,极大改变了医学实践,提高了病患的生存质量,挽救了更多患者的生命。
单克隆抗体作为一种治疗恶性肿瘤和炎症性疾病的被动免疫制剂进入临床使用,再进一步发展至其他领域,包括神经系统疾病(如阿尔兹海默病等)及自身免疫疾病(如红斑狼疮等)[7].抗体功能取决于其与靶抗原结合的表位,表位是抗原的一部分,与抗体的可变区结合,与不同表位结合发挥特定的功能,这些功能可能表现为抑制活性或激活某个信号等。
单克隆抗体的表位分析能促进抗体治疗的发展,指导疫苗的设计,评估免疫者体内保护性抗体的反应,或是定位抗菌剂作用于病原微生物的靶点[8].单克隆抗体与相应抗原的反应性决定于其所识别的抗原表位,确定相应表位在抗原结构上的位置是单克隆抗体筛选中关键步骤[9].同时,可进一步分析这类表位的差异,正确评价单克隆抗体的特异性和交叉反应性,可用于评价某抗原表位是某种菌株不同血清型的共同表位,还是特异表位。
简述单克隆抗体技术的基本原理单克隆抗体技术是生物技术领域的一项重要技术,在医药研发、诊断和治疗等方面都有着广泛的应用和前景。
单克隆抗体技术的基本原理是通过选择一种特定的免疫细胞,获取它产生的特异性抗体并使其进行不限制性复制,最终获得具有高度特异性和稳定性的单克隆抗体。
下面将详细介绍单克隆抗体技术的基本原理,包括鼠源性、嵌合型和人源性单克隆抗体技术,以及单克隆抗体生产的流程和应用。
一、鼠源性单克隆抗体鼠源性单克隆抗体是最早使用的单克隆抗体,其制备原理是将鼠类动物免疫一种抗原,收集其脾细胞,将其与骨髓瘤细胞融合,产生杂交瘤细胞,然后将杂交瘤细胞单克隆化,即从杂交瘤中分离出单个克隆细胞并培养扩大。
鼠源性单克隆抗体的优点是制备简单、产量高,但由于小鼠免疫系统与人类的巨大差异,鼠源性抗体往往容易引起免疫原性反应,从而限制了其在临床应用中的使用。
二、嵌合型单克隆抗体为了克服鼠源性单克隆抗体的局限性,研究人员提出了嵌合型单克隆抗体技术。
嵌合型单克隆抗体是由人源性的Fc区和鼠源性的可变区域组成,它可以确保高度特异性和稳定性的又可以降低免疫原性反应。
嵌合型单克隆抗体的制备方法是将人源性的IgG1的Fc片段与包含鼠源性单克隆抗体的可变区域进行基因重组,最终获得嵌合型单克隆抗体。
嵌合型单克隆抗体优点是高度特异性和稳定性、免疫原性反应小。
嵌合型单克隆抗体的制备过程较为复杂,且其效价可能比鼠源性单克隆抗体略低。
随着生物技术的不断发展,研究人员逐渐开始研制具有人源性的单克隆抗体,其能够更加充分地体现在人体内生物学免疫动态,从而降低了潜在的体内免疫原性反应。
人源性单克隆抗体制备方法有两种,一种是在小鼠背景中将人源性单克隆抗体进行筛选和生产,另一种是通过人免疫系统获得人源性单克隆抗体。
人免疫系统产生抗体的原理与小鼠类似,但需要额外进行一系列的筛选和优化步骤,以保证细胞系的干净和稳定性。
由于人源性单克隆抗体与人体内的免疫系统具有良好的兼容性和相似性,因此在临床应用中具有极高的价值。
招聘生物制药岗位笔试题与参考答案(某大型集团公司)(答案在后面)一、单项选择题(本大题有10小题,每小题2分,共20分)1、生物制药领域中,以下哪项技术不属于常用的下游加工技术?A、过滤技术B、离心技术C、层析技术D、PCR技术2、在生物制药过程中,以下哪种物质通常用于去除产品中的宿主细胞残留?A、离子交换树脂B、反渗透膜C、超滤膜D、凝胶过滤柱3、下列哪种技术在生物制药领域用于蛋白质的纯化?A. 聚合酶链式反应(PCR)B. 高效液相色谱(HPLC)C. 基因克隆D. 免疫组织化学4、在生物制药生产过程中,哪一步骤是为了确保产品的无菌状态?B. 培养基制备C. 过滤D. 下游加工5、在生物制药过程中,用于生产单克隆抗体的主要细胞系是:A. CHO (中国仓鼠卵巢) 细胞B. E. coli (大肠杆菌)C. Vero 细胞D. HeLa 细胞6、下列哪项不是基因工程中的常用工具酶?A. 限制性内切酶B. DNA连接酶C. RNA聚合酶D. 反转录酶7、以下哪项不是生物制药过程中常用的细胞培养技术?A. 转染技术B. 诱导多能干细胞技术C. 融合技术D. 转化技术8、以下哪种药物不属于生物制药的范畴?A. 靶向药物B. 免疫调节剂D. 重组蛋白药物9、在生物制药过程中,哪个步骤是确保药物纯度与质量的关键环节?A)发酵培养B)纯化工艺C)制剂成型D)包装与储存 10、以下哪种技术在生物制药领域用于蛋白质的纯化?E)聚合酶链式反应(PCR)F)高效液相色谱(HPLC)G)基因克隆H)免疫组织化学二、多项选择题(本大题有10小题,每小题4分,共40分)1、下列哪些技术属于现代生物制药技术?(多选)A. 基因重组技术B. 细胞融合技术C. 传统发酵技术D. 生物信息学E. 化学合成技术2、关于抗体药物,以下说法正确的是?(多选)A. 抗体药物可以特异性地识别并结合到特定的抗原上B. 所有抗体药物都是通过动物体内产生获得的C. 单克隆抗体药物具有高度的同质性D. 抗体药物通常用于治疗癌症和自身免疫疾病E. 抗体药物的研发周期较短3、以下哪些是生物制药领域中常用的分离纯化技术?()A. 超滤B. 凝胶过滤C. 水蒸气蒸馏D. 膜分离E. 液-液萃取4、以下哪些因素会影响生物制药产品的稳定性?()A. 温度B. 湿度C. 光照D. 压力E. 原料质量5、以下哪些是生物制药中常用的纯化技术?A. 透析技术B. 凝胶过滤色谱C. 离子交换色谱D. 超滤技术6、在生物制药生产过程中,细胞培养基的成分必须包括哪些物质来支持细胞生长?A. 碳水化合物、氨基酸、维生素、无机盐、激素B. 抗生素、防腐剂、表面活性剂C. 纯净水、缓冲物质、生长因子D. 脂肪酸、抗生素、维生素E. 表面活性剂、缓冲物质、激素7、下列哪些因素会影响蛋白质药物的稳定性?A. pH值B. 温度C. 光照D. 蛋白质浓度E. 氧气的存在8、在生物制药过程中,纯化步骤的主要目的是什么?A. 增加产物的产量B. 提高目标蛋白的纯度C. 去除培养基中的杂质D. 减少生产成本E. 确保产品的安全性9、以下哪些是生物制药研发过程中常用的细胞系?()A. 293细胞B. HEK293细胞C. HEK293T细胞D. 3T3细胞E. Hela细胞 10、以下哪些是生物制药生产过程中常用的质控指标?()A. 纯度B. 活性C. 生物安全等级D. 稳定性E. 热原三、判断题(本大题有10小题,每小题2分,共20分)1、所有生物制药产品在上市前都需要经过临床试验,以确保其安全性和有效性。
人C反应蛋白在不同原核表达载体及菌株中的表达及免疫反应性分析李江峰;矫丽媛;赵晓妮;王继华;才蕾【摘要】构建人C反应蛋白(CRP)原核表达载体,并分别将其转化进入E.coli BL21(DE3)和Rosetta gami 2(DE3)pLysS中,诱导CRP重组蛋白的表达;主要运用了基因工程,亲和层析及透析复性等方法。
成功构建了CRP原核表达载体及菌株。
经IPTG诱导后,得到了不同的重组CRP蛋白。
结果表明,相同表达载体在不同的表达菌株中的表达情况有一定差别,分别在大肠杆菌及Rosetta gami2(DE3)pLysS中表达并得到了重组CRP的包涵体,对复性后的CRP重组蛋白进行Westen blotting及ELISA检测,结果表明原核表达的重组CRP蛋白的免疫反应性很低,CRP蛋白发挥免疫活性需要以五聚体形式存在。
%The prokaryotic expression vector of human C-reactive protein(CRP)was constructed and transferred intoEscherichia coli BL21(DE3)and Rosetta gami2(DE3)pLysS,respectively,and then these recombinant strains were induced for the expression of CRP. Mainly gene engineering,affinity chromatography and dialysis refolding methods were employed. The expression vectors and recombinant strains of human CRP were constructed successfully,and the varied CRPs with different protein tags were acquired by IPTG. In conclusion, expressions of the same vector in different strains differed;it expressed in theE. coli BL21(DE3)and Rosetta gami2(DE3)pLysS respectively,and the inclusion bodies of recombinant CRP were obtained. The results of detecting the refolded recombinant CRP by Western blotting and ELISA revealed that the immunoreactivity ofrecombinant CRP in the prokaryotic expression vector was low,and CRP may have the immunoreactivity while it is in the pentamer form.【期刊名称】《生物技术通报》【年(卷),期】2016(032)003【总页数】5页(P166-170)【关键词】C反应蛋白;原核表达;包涵体;复性【作者】李江峰;矫丽媛;赵晓妮;王继华;才蕾【作者单位】广州万孚生物技术股份有限公司,广州 510660;广州万孚生物技术股份有限公司,广州 510660;广州万孚生物技术股份有限公司,广州 510660;广州万孚生物技术股份有限公司,广州 510660;广州万孚生物技术股份有限公司,广州 510660【正文语种】中文1930年,Tillett和Francis首次在急性大叶性肺炎患者的血清中发现了一种能够在Ca2+存在时与肺炎球菌细胞壁中的C-多糖发生特异性沉淀反应的物质,1941年,Avery等测知它是一种蛋白质,故称其为C反应蛋白(CRP)。
蛋白质聚集与胶体性质蛋白质是生命活动中至关重要的一类生物大分子,除了参与促进代谢和细胞信号传导外,还扮演着生物体结构和组织功能的重要角色。
对于人类和许多其他物种而言,蛋白质的聚集现象是生物学中的一个普遍现象,尤其在老年人和病人中更为明显。
然而,这个现象一直被认为是导致早老症和一系列神经退行性疾病的罪魁祸首。
对于蛋白质聚集的过程和机理,科学家们一直在进行广泛的研究。
对于蛋白质聚集的理解有助于我们更好地理解一系列疾病的存储或过程,并有望开发出更有效的治疗方法。
在蛋白质聚集的例子中,胶体性质起到了非常重要的作用。
胶体是指一种混合体系,其中胶态成分和非胶态成分之间存在的相互作用可以阻止物质从混合物中沉淀。
这个定义很抽象,但实际上,许多我们熟知的物质都是胶体。
例如,牛奶就是含有蛋白质的胶体。
牛奶是由乳气(水和溶解的矿物质、糖和维生素)以及千篇一律的蛋白质(酪蛋白和乳清蛋白)组成的混合物。
当牛奶变酸或者过热时,蛋白质开始凝聚形成奶酪,胶体失效,产生沉淀。
回到蛋白质聚集上来,这个过程可以看做是蛋白质分子之间形成胶体,而胶体失效导致沉淀的有害过程。
蛋白质聚集通常涉及到一个称为β-折叠的现象。
一个正常的蛋白质分子具有现代生命体系的秩序。
这种秩序是在蛋白质链细胞合成过程中产生的。
涉及四种不同元素的氨基酸(蛋白质的主要组成部分),这些氨基酸按照特定方式连接,形成一个链。
接下来,这个链会在真核生物的核糖体内进行最后的修饰,从而得到所需的形态。
这个过程通常包含了一种β-折叠,这使蛋白质具有二级、三级和四级结构。
然而,这个过程并不总是完美的,因为在某些条件下,蛋白质可能会以不正常的方式聚合,形成所谓的β-寡聚体或β-纤维。
β-寡聚体和β-纤维在蛋白质聚集方面起到关键的作用。
寡聚体是β-蛋白质分子的低聚体,由单个蛋白质分子聚集形成。
β-纤维由蛋白质聚合而成,具有粘稠性。
这些β-寡聚体以及它们之间相互作用和聚集的方式,是导致一些神经退行性疾病,如阿尔茨海默病的根本原因之一。
asc寡聚化检测原理ASC(Antibody-SEC-Capillary electrophoresis)寡聚化检测是一种用于分析蛋白质寡聚化状态的方法。
在药物研发和生物疗法中,蛋白质的寡聚化状态对于其活性和稳定性具有重要影响。
因此,准确地检测和分析蛋白质的寡聚化状态对于药物研发和生物疗法的成功应用至关重要。
ASC寡聚化检测原理基于SEC(Size Exclusion Chromatography)和CE(Capillary Electrophoresis)两种分离技术的结合。
SEC是一种常用的色谱分离技术,通过分离样品中的分子根据其尺寸的差异进行分离。
而CE是一种基于电泳原理的分离技术,通过在电场中移动带电分子进行分离。
ASC寡聚化检测首先利用SEC将样品中的蛋白质分子根据其大小分离成不同的峰。
然后,将分离后的样品通过CE进行进一步的分离。
在CE过程中,样品中的蛋白质分子根据其电荷和大小被分离成不同的区域。
通过观察不同蛋白质分子的迁移时间和峰面积,可以判断其寡聚化状态。
ASC寡聚化检测方法具有以下优点。
首先,该方法使用了两种不同的分离技术,可以提高分离效果和分析准确性。
其次,该方法对于蛋白质的寡聚化状态具有高灵敏度和高分辨率,可以检测到低浓度和小差异的寡聚化体。
此外,该方法还可以同时分析多个样品,提高了分析效率。
ASC寡聚化检测方法在药物研发和生物疗法中具有广泛应用。
例如,在单克隆抗体研发中,蛋白质的寡聚化状态对于其结构和功能具有重要影响。
通过ASC寡聚化检测方法,可以对单克隆抗体样品进行寡聚化状态的分析,从而优化其生产工艺和质量控制。
ASC寡聚化检测方法还可以应用于蛋白质药物的稳定性研究。
蛋白质的寡聚化状态对于其稳定性具有重要影响。
通过ASC寡聚化检测方法,可以监测蛋白质在不同条件下的寡聚化状态的变化,从而评估其稳定性和储存条件。
ASC寡聚化检测是一种重要的蛋白质分析方法。
该方法通过结合SEC和CE两种分离技术,可以准确地检测和分析蛋白质的寡聚化状态。
单克隆抗体和重组治疗性蛋白质的聚体分析生物制品中的聚体的来源,类型和大小不同,并且是由多种因素引起的。
监管机构特别关注的是具有增强免疫应答从而引起不良临床反应的蛋白质聚体,或可能损害抗体或蛋白药物产品安全性和功效的聚体。
在动物和临床研究中已经报道了蛋白质聚体可以增强免疫反应。
尽管可以预期对人外源蛋白物质的免疫反应,但免疫系统可能会通过耐受性分解机制对具有内源性的聚集蛋白制品产生强烈反应。
在耐受性破坏机制中,蛋白质聚体可在蛋白质复合物的形成中充当促进剂,这些蛋白质复合物可触发B细胞针对该蛋白质抗体的产生,而与T辅助细胞无关。
这类反应的基础来自免疫原概念,其中抗原具有多于半抗原的聚合结构形式存在,在病毒样颗粒组织中间隔5-10nm,大小超过100kDa,可以克服免疫力。
这种情况可能解释了内源性蛋白质的意外中和,并且产生了深远的临床效果。
这种类型的机制最受关注的是高分子量(HMW)聚集体,这些聚体保留了其单体对应物的大多数天然构型,并且可以以这种方式使抗原成核。
另外,显示非天然蛋白质构象的聚体可能被免疫系统视为新抗原,这可能会触发抗抗体形成。
在这里我们提供了有关蛋白质药物中的聚体的表征,检测方法以及药物制造商已实施的各种控制措施的监管观点。
抗体或蛋白聚体的分类聚体的分类是一项复杂的任务,目前还没有全面的分类方法。
分类的困难在于可以对聚合进行多个类别的分组。
下表1列出了生物制药中最常见的聚体类别。
为了有助于理解所讨论的聚体类型,常见的聚体类型有:二聚体,可逆聚体,共价聚体和颗粒,这些都是蛋白聚集中常见的形式。
聚体的其他分类可以基于聚体的大小,因为这可能与潜在的不良临床反应直接相关。
聚体的大小范围从可溶性二聚体和其他多聚体(表观球状直径约5-10nm),包括高分子量(HMW)聚集体到可溶或不溶的有核聚集体,到较大的不溶性物质(被识别为亚可见和可见)颗粒(表观球状直径约20–50µm)。
在可溶性聚集体组中,较大的聚集体(例如HMW物)可能更能引发产生不良临床后果的免疫原性应答。
就其分子量而言,大小大于10的二次方kDa的聚体潜在的不良免疫原性反应潜力,值得更仔细的评估。
聚体除大小外,聚体随时间的大小变化率是一个有用的参数,可以提供聚体的功能特征,其中时间对应蛋白质产品的有效期。
聚体最初可以小二聚体或碎片的形式存在,并朝着更大的聚集结构变化,例如亚可见或可见颗粒(如果这种转变在热力学上温度变得快速)。
在任何给定的时刻,蛋白质可能在有利于蛋白质单体或天然构型的热力学状态与有利于展开的天然蛋白质构型状态之间转变。
在某些的条件下,未折叠的蛋白质可能与其他天然和非天然形式形成复合物,在获得足够的自由能以转变为可能成为新蛋白质实体而形成稳定状态的聚体。
科学家Lumry和Eyring在1960年代研究了这些转变的基础,他们提出了溶液中蛋白质聚体的动力学转变,并在干扰素-γ聚集的情况下进一步转变为一级转变反应动力学。
评估药品聚体总增长率的过程很复杂。
单一药物产品通常具有不均匀的聚体混合物(如上表1)。
稳定的蛋白制品具有异质性溶液中存在的聚体,但与更不稳定的制品相比,其生长速率很小。
聚体的增长速度加快的更加令人担忧,可能需要更积极的控制和聚体控制最小化策略。
蛋白质聚集的来源蛋白质药品的聚体可以有多种来源,并且各种类型的聚体可以存在于所分装的药品瓶中。
蛋白质聚体形成的潜力存在于蛋白质药物制造的各个阶段。
从蛋白质序列和特征开始,每种蛋白质将具有可使其或多或少的稳定物理化学特征。
例如,游离巯基水平升高而发现在培养物中会产生聚集的CHO细胞表达的单克隆抗体(MAb)的聚集情况,如果将硫酸铜添加到培养物中,则可以防止这种情况的发生。
随着多种蛋白质形式与其环境相互作用的可能性增加,蛋白质异质性也可能是蛋白质聚集的一个促成因素。
对于依帕珠单抗,二硫键会有利于共价聚体的形成。
治疗性单克隆抗体通常以高浓度配制,这也有利于增加分子相互作用的发生率,因此有可能形成聚体。
因此,药物制造商花费大量时间和精力来开发一种制剂,制剂将使蛋白质药物产品在其有效期内保持稳定,无论是在溶液中还是冻干产品。
例如,将蔗糖添加至白介素-1受体激动剂或冻干MAb制品以抑制或减少聚体的形成。
生产、保存、运输中的大量冷冻对蛋白的质稳定制备提出了挑战,因为在溶液冷冻期间会发生溶质浓缩作用。
理想的策略是在–80℃下同时冻结整个溶液,并迅速冻结,这样可以最大程度地减少热变迁(例如低共熔)和玻璃化转变。
此策略对于大批量解决方案不切实际。
大量冷冻期间溶质浓度和pH的变化也可促进蛋白质聚集。
大量的解冻也带来这方面的挑战,这主要与冰-液界面的表面吸附有关。
当需要大量冷冻和解冻时,适当的制剂配方就变得至关重要,而赋形剂可以作为蛋白质冷冻保护剂来使用。
分装和生产工操作可能会由于剪切力而使蛋白质发生机械变性,或者会引入杂质,这些杂质会作为蛋白质聚体的成核源。
例如,某些活塞式泵类似于汽车发动机活塞与润滑油相互作用的方式与蛋白质药物产品相互作用。
蛋白药物产品和活塞杆之间的紧密接触会破坏原本稳定的药物产品。
对于抗体药物产品来说就是这种情况,使用吸光度和光遮蔽方法确定其聚体颗粒的水平随着泵送次数的增加而增加。
在活塞脱落的情况下,不锈钢钝化可以降低将不锈钢沉积物引入最终药物中的风险,这种情况可能会导致蛋白质异核化。
新的输送系统增加了容器兼容性,并增加了形成蛋白质聚体的可能性。
小瓶中的玻璃,塞子中的橡胶,塞子和注射器中的硅树脂以及注射器中的钨这些异物,它们可能会进入蛋白质药物产品。
这些异物中许多都是带静电的,因此有可能与蛋白质,蛋白质聚集体和蛋白质聚体的前体发生相互作用,形成异核。
对于预填充的注射器来说就是这样,其中包含在注射器针筒制造过程中脱落的钨颗粒,这些钨颗粒用作聚体的形成。
蛋白质聚体的研究基于聚体动力学模型,蛋白质聚体可能比其单体更具疏水性。
这是因为当蛋白质转变为天然的、部分展开的状态并暴露其疏水残基时,可能会发生蛋白质聚集。
研究表明,聚体比单体使用硫酸铵沉淀效果更好,并且它们与聚偏二氟乙烯(PDVF)膜的结合更牢固。
通常,通过将蛋白质溶液暴露于高温、pH、湿度和光入射的极端条件下来研究聚集体,这就是所谓的强制降解和光降解研究。
基本原理是基于这样的期望:蛋白质以这种方式降解反映了蛋白质药物的有效期中所经历的降解途径。
这些参数在建立稳定性研究程序时也是非常有价值的。
蛋白质聚集研究的另一个重要部分是评估聚体的生物学活性。
与单体蛋白质活性相比,聚体的生物活性的差异会深刻影响蛋白质药物的功效。
在这种情况下,产品功效可能会受到影响。
通常,基于风险的聚体评估可能需要进行特定的研究,以帮助阐明哪种类型的聚体更令人担忧。
对药品在其有效期中所处的不同环境进行全面调查,包括制造、存储、运输、冷冻和解冻周期、氧气暴露、光照和物理作用力等等。
蛋白质聚体的检测生物制药工业中可用于检测,表征,定量和监测生物制药蛋白产品中聚体的分析方法数量在不断的增加。
下表2列出了用于检测,监视和研究聚体的最常用方法。
尽管表述并不全面,但表2提供了分析方法的一般概念及其主要优点和局限性。
可用的测试方法可以分为两类:检测小聚集体的方法,例如二聚体,LMW,HMW,可溶性聚体和蛋白质片段(表2的第一部分),以及检测大聚集体的方法,例如不溶的亚可见和可见的颗粒(表2的第二部分)。
在用于检测小聚集体的一组测试方法中,体积排阻色谱法(SEC)通常用于批次放行期间的常规检测和聚体监测。
不适合批量生产的方法可以用其他表征或验证来测试。
尺寸排阻高压液相色谱法是对二聚体,LMW和HMW物等蛋白质聚体使用最广泛的分析方法。
该方法适具有高灵敏度、精密度、分离度、准确性,可以高通量进行分析测试。
但是,作为色谱方法,它也可能导致聚集,导致样品制备过程中现有聚集物被去除,或者在无法区分或回收HMW物时低估了聚集物的存在。
SEC的主要局限性可能是需要以低浓度(例如1mg/mL)进样。
对于治疗性蛋白质,这通常意味着稀释100倍,导致可逆的可溶性聚集体分解。
这种担忧导致了更普遍的问题,例如,总体概况的相关性如何?它代表最终药品中存在的聚集体吗?如其他地方所述,没有一种能够评估给定蛋白质溶液中存在的所有聚集体的分析方法。
通常需要几种方法的组合来覆盖可能存在的聚集体的微观和宏观范围。
另外,由于每种方法的局限性,可能需要正交实验来确认方法。
例如,SEC结果可能需要使用其他正交方法(例如分析超速离心(AUC))进行确认。
AUC可以用作确认方法,因为它提供了良好的聚体分离,并且不需要样品稀释或样品制备。
在用于聚体表征的方法中,场流分离(FFF)和动态光散射(DLS)能够直接评估溶液中的聚集体(无需稀释)。
FFF的检测范围比SEC 的检测范围宽,但是可以解决浓缩样品的数据分析困难的问题。
DLS 是一种很好的定量方法,读数与表面积成正比,因此,如果大小差异不够大,大聚体可以掩盖小聚体的检测。
热量法对于评估蛋白质溶液的稳定性非常有用,因为它可以检测蛋白质的解离和折叠。
某些方法可以组合使用,以拥有更强大的分析工具,例如质谱联用色谱法,可提供有关化学和物理降解的信息。
此外,根据美国药典(USP),通常使用显微镜和光遮盖法检测和计数亚可见颗粒)<788>章。
两种测试都适用于小批量和大批量产品,但通常在此类测试中使用多个药品瓶样品。
样品首先通过光遮蔽法进行测试。
如果样品未达到规定的限值,则可以使用显微分析方法。
但是,如果有技术原因或正在测试的产品产生干扰,使光遮蔽方法不合适或结果无效,则显微镜方法可能是唯一的测试方法。
浊度法根据参考标准测量溶液的乳浊度或透明度。
光遮蔽,比浊法和DLS的组合已用于评估蛋白质溶液中颗粒形成的过程。
当这些方法与检测到的聚体的表观球状尺寸相关时(如下图1),用于检测和监测直径在几纳米到50纳米之间的小聚体方法的能力就存在差距,这种差距可能会造成因为检测,测量和评估某些小聚体以及较大聚体前体的运动能力可能无法在蛋白质聚体控制策略中实现。
实际上,已经指出表观球状直径约为0.5 µm的聚集体没有得到常规跟踪和分析。
蛋白质聚体的控制制药商采用了各种方法来控制蛋白质药物中的聚体,这取决于聚体的性质和水平,以及它们对特定蛋白质产品的安全性、质量、稳定性的潜在影响。
尽管蛋白质药物产品可能包含的性质和大小与通过适当监控无法控制的某些聚体,但某些聚体可能需要根据其风险评估要求采取积极的控制策略。
在某些情况下,控制措施是为了减少或抑制聚体的形成。
有时,各种条件的改变可以提高易于聚集的蛋白质产品的稳定性,例如在冻融过程中的控制策略也可能包括添加赋形剂。
重组人血小板活化因子就是这种情况,重组人血小板活化因子在储存时通过与二氧化硅颗粒异核形成聚体。