蛋白质复性方法
- 格式:doc
- 大小:33.00 KB
- 文档页数:14


蛋白的变性和复性变性:蛋白质的空间结构是体现生物功能的基础,蛋白质折叠则是形成空间结构的过程。
蛋白质一级结构决定其高级结构的著名学说, 认为蛋白质折叠是受热力学因素控制的. 天然蛋白质处于能量最低(即热力学最稳定)的状态. 一般来说, 天然蛋白质的结构是相对稳定的, 结构的稳定性也是其保持生物个体功能和物种的相对稳定所要求的.蛋白质担负着复杂的生化反应, 同时在生物合成以后, 蛋白质本身也经历着繁杂的生理过程. 蛋白质自翻译以后, 还需进行一系列的翻译后过程, 包括跨膜转运、修饰加工、折叠复性、生化反应、生物降解等. 这些过程似乎都伴随着蛋白质的结构转换, 不但受蛋白质肽链自身的热力学稳定性所控制, 而且还受动力学过程控制.变性原因:蛋白质因受某些物理或化学因素的影响,分子的空间构象被破坏,从而导致其理化性质发生改变并失去原有的生物学活性的现象称为蛋白质的变性作用(denaturation)。
变性作用并不引起蛋白质一级结构的破坏,而是二级结构以上的高级结构的破坏,变性后的蛋白质称为变性蛋白。
引起蛋白质变性的因素很多,物理因素有高温、紫外线、X-射线、超声波、高压、剧烈的搅拌、震荡等。
化学因素有强酸、强碱、尿素、胍盐、去污剂、重金属盐(如Hg2+、Ag+、Pb2+等)三氯乙酸,浓乙醇等。
不同蛋白质对各种因素的敏感程度不同。
蛋白质变性后许多性质都发生了改变,主要有以下几个方面:(一)生物活性丧失蛋白质的生物活性是指蛋白质所具有的酶、激素、毒素、抗原与抗体、血红蛋白的载氧能力等生物学功能。
生物活性丧失是蛋白质变性的主要特征。
有时蛋白质的空间结构只有轻微变化即可引起生物活性的丧失。
(二)某些理化性质的改变蛋白质变性后理化性质发生改变,如溶解度降低而产生沉淀,因为有些原来在分子内部的疏水基团由于结构松散而暴露出来,分子的不对称性增加,因此粘度增加,扩散系数降低。
(三)生物化学性质的改变蛋白质变性后,分子结构松散,不能形成结晶,易被蛋白酶水解。

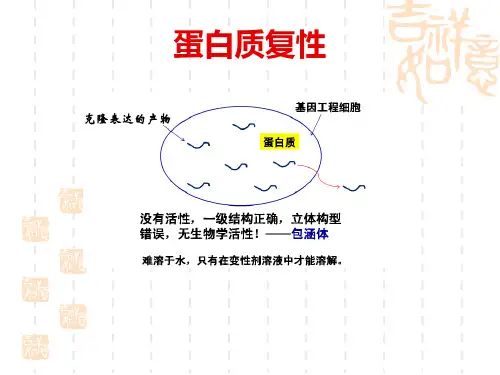
名词解释蛋白质的复性蛋白质的复性:现象与意义在生物化学领域中,蛋白质的复性是一个广泛而重要的研究课题。
复性是指蛋白质经历一系列空间结构和功能的调整,重建其原有的三维结构以及所能发挥的功能。
本文将探讨蛋白质复性的现象、机制以及其在生物体内的意义。
1. 蛋白质的复性现象复性是蛋白质遭受外部环境的一系列不良条件(如高温、极酸或极碱性条件、化学变性剂等)后,通过一定机制修复并重获原有结构与功能的过程。
在这个过程中,蛋白质的一级、二级和三级结构受到损伤,导致其失去正常功能。
蛋白质的复性可以发生在细胞内部和细胞外部。
在细胞内,复性通常由分子伴侣和分子伴侣系统促进,如分子伴侣热休克蛋白HSP70、HSP90等。
这些分子伴侣通过与蛋白质相互作用,引导失去结构的蛋白质重新折叠成正确的形式,并防止其在复性过程中发生聚集。
2. 蛋白质的复性机制复性过程涉及多个事件和步骤,其中最为关键的是解聚和折叠。
解聚是指复性过程中产生的不正常和不稳定的蛋白质聚集体分解为单体。
这个步骤由分子伴侣和其他调节蛋白质负责。
折叠是指蛋白质通过一系列无序到有序的结构变化,重新将其折叠成正确的三维构象。
折叠的过程中,分子伴侣系统与其他辅助蛋白质(如折叠辅助酶和蛋白激酶等)相互作用,协助和促进正确的二级和三级结构的形成。
此外,糖基化也被认为是蛋白质复性的关键机制之一。
在糖基化过程中,糖链与特定氨基酸残基结合,形成糖蛋白复合物。
这种复合物不仅能帮助维持蛋白质的稳定性,还可促进正确的折叠。
3. 蛋白质复性的意义蛋白质的复性在维持生物体内正常的生理功能中起着至关重要的作用。
在细胞内,复性可以防止异常蛋白质的聚集和沉积,减轻内环境的毒性。
此外,蛋白质复性还与许多重要的生物过程密切相关。
例如,蛋白质折叠失常与多种神经性疾病,如阿尔茨海默病和帕金森病相关。
了解复性过程可以帮助我们深入了解这些疾病的发生机制,并为研发相关的治疗方法提供新的思路。
另外,蛋白质复性也对生物技术领域具有重要意义。

蛋⽩质复性⽅法及其注意事项蛋⽩质复性⽅法及其注意事项蛋⽩前期准备(1)查阅⽬标蛋⽩相关⽂献,了解其等电点,标签等注意点。
(2)如果⽬标蛋⽩易降解,可在纯化时加1-2mMDTT,全程低温,及时处理. (3)透析Buffer得选择可参考⽂献。
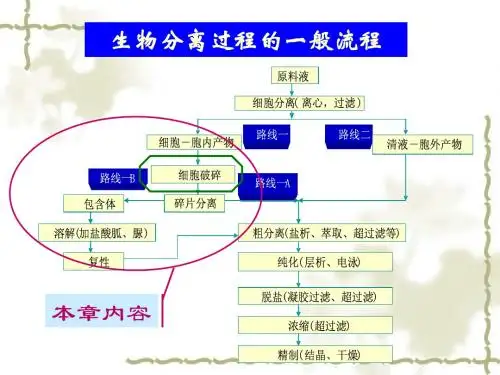
蛋⽩复性包涵体:在某些⽣长条件下,⼤肠杆菌能积累某种特殊得⽣物⼤分⼦,它们致密地集聚在细胞内,或被膜包裹或形成⽆膜裸露结构,这种⽔不溶性得结构称为包涵体(Inclusion Bodies,IB)。
在E、coli中累积得重组蛋⽩会迅速地以包涵体形式被沉淀出来,这些包涵体蛋⽩就是丧失⽣物活性得不可溶得错误折叠蛋⽩得聚集体.包涵体得处理⼀般包括这么⼏步:包涵体得洗涤、溶解、纯化及复性。
如果过表达蛋⽩在包涵体中,那么通常有两个选择可以考虑:(1)退⼀步,优化表达条件;(2)接受包涵体并采取策略来将蛋⽩溶解以及复性.这⾥主要考虑第⼆种⽅案。
包涵体得洗涤破碎细胞都会使细胞内蛋⽩质或核酸⽔解酶释放到溶液中,使⼤分⼦⽣物降解,导致天然物质量得减少,加⼊蛋⽩酶抑制剂等,还可通过选择pH、温度或离⼦强度等,使这些条件都要适合于⽬得物质得提取。
洗涤Buffer:50mM Tris-HCl(pH8、0),2mM EDTA,2mMD TT,150mMNaCl, 1% Triton X—100, 1mg/ml Leupeptin, 1mg/ml Pepstatin,1mMTCEP.超声时⽤40-60ml裂解液,因为我们得超声仪很适合⽤100ml⼩烧杯,装40—60ml裂解液,这样能让超声头离液⾯不⾼不低,不会洒出来、菌多就延长超声时间(全程冰浴).包涵体得溶解1、对于尿素与盐酸胍得选择:尿素与盐酸胍属中强度变性剂,易经透析与超滤除去。
它们对包涵体氢键有较强得可逆性变性作⽤,所需浓度尿素8-10M,盐酸胍6—8M。
尿素溶解包涵体较盐酸胍慢⽽弱,溶解度为70-90%,尿素在作⽤时间较长或温度较⾼时会裂解形成氰酸盐,对重组蛋⽩质得氨基进⾏共价修饰,但⽤尿素溶解具有不电离,呈中性,成本低,蛋⽩质复性后除去不会造成⼤量蛋⽩质沉淀以及溶解得包涵体可选⽤多种⾊谱法纯化等优点,故⽬前已被⼴泛采⽤。


一种重组蛋白复性方法引言重组蛋白作为一种重要的生物制品,在医药、农业、食品等领域具有广泛的应用。
然而,在蛋白表达和纯化过程中,很多蛋白通常失去了其原有的结构和功能,导致其活性降低甚至完全丧失。
因此,将失活的重组蛋白重新获取其原有的结构和功能成为了一个重要的研究课题。
本文介绍了一种基于牛磺酸辅助的重组蛋白复性方法,该方法具有高效、低成本和较好的生物相容性等优点。
牛磺酸辅助的重组蛋白复性方法原理牛磺酸是一种富含硫的有机酸,能够与蛋白质的残基形成强烈的氢键和疏水相互作用。
牛磺酸辅助的重组蛋白复性方法基于牛磺酸与蛋白质间的相互作用,通过提供合适的物理和化学环境,促进蛋白质正确地折叠,从而使失活的蛋白重新获得活性。
实施步骤1. 准备牛磺酸溶液:将适量的牛磺酸粉末溶解在高纯度的去离子水中,得到一定浓度的牛磺酸溶液。
2. 蛋白质预处理:将失活的重组蛋白通过适当的方法纯化并溶解在缓冲液中,以获得适当的浓度。
3. 牛磺酸辅助复性:将适量的牛磺酸溶液加入蛋白质溶液中,并通过适当的温度和时间条件下进行充分的混匀。
同时,可以加入一些辅助剂(如辅酶、金属离子等)来增加复性效率。
4. 过滤纯化:经过复性后,将蛋白质溶液通过一定孔径的过滤器进行滤液,以去除残留的不溶性物质和牛磺酸等。
5. 活性检测:对复性后蛋白进行活性检测,如酶活性测定、结构分析等,以评估复性效果。
优点和效果牛磺酸辅助的重组蛋白复性方法具有以下优点:1. 高效:牛磺酸能够与蛋白质形成强烈的相互作用,有助于蛋白质正确地折叠,提高复性效率。
2. 低成本:牛磺酸是一种常见、成本较低的化合物,易于制备和获取。
3. 生物相容性好:牛磺酸是一种天然产物,在生物体内常见,对大多数生物系统均具有良好的相容性。
经过牛磺酸辅助的复性,失活的重组蛋白能够重新获得其原有的结构和功能。
实验证实,该方法在多种重组蛋白的复性中取得了显著的效果。
结论牛磺酸辅助的重组蛋白复性方法具有高效、低成本和生物相容性好等优点,在重组蛋白的生产和应用中具有重要的意义。

包涵体复性方法:一个有效的、理想的折叠复性方法应具备以下几个特点:活性蛋白质的回收率高;正确复性的产物易于与错误折叠蛋白质分离;折叠复性后应得到浓度较高的蛋白质产品;折叠复性方法易于放大;复性过程耗时较少。
(即回收高,易分离,浓度高,易放大,耗时少。
)1. 透析、稀释和超滤复性法:这三种方法是最传统也是应用最普遍的蛋白质折叠复性方法,复性活性回收率低,而且难于与杂蛋白分离。
透析法耗时长,易形成无活性蛋白质聚集体;超滤法在膜上聚集变性(不可逆变性),易造成膜污染;稀释法(直接加入水或缓冲液,放置过夜,缺点是体积增加较大,变性剂稀释速度太快,不易控制)处理量太大,不利于工业放大。
2. 凝胶过滤层析复性凝胶过滤层析复性又称体积排阻复性(SEC),是一种广泛应用的层析技术。
与常用的稀释复性法相比,凝胶过滤层析复性能在高的起始蛋白浓度下对蛋白进行复性,活性回收率较高,同时又能使目标蛋白得到一定程度的纯化。
凝胶过滤复性时,除了蛋白质在胶粒中的传质和扩散外,蛋白质与介质之间并不发生其它任何作用。
复性过程始终发生在溶液中。
蛋白质在伸展状态中,每个蛋白质分子的伸展状态都会有差别,而不同伸展状态的蛋白质分子在凝胶颗粒内部扩散所受到的限制也不相同,有的会扩散入颗粒内部深一些,有的会浅一些,这使不同伸展状态的蛋白质分子达到一定程度的分离,这样蛋白质分子问相互作用的机会就大大减少,从而起到一定抑制凝集的作用;即使发生了部分凝集,凝集的蛋白质会附着在胶粒上,而不随着溶液向下运动,这样后面的变性剂可以赶上凝集的蛋白质,使其重新溶解并变性;并且在凝胶过滤中脲等变性剂脱除得相对较慢,这对有些蛋白质的复性是有利的。
在普通凝胶过滤中,变性剂和还原剂的脱除(??)虽较稀释复性慢,但变性蛋白质仍会经历变性剂浓度突然变化的过程。
脲梯度复性是样品上柱前用复性缓冲液平衡柱子,接着使变性剂浓度递减(如从6M 盐酸胍或8M尿素下降到复性缓冲液中预先确定的变性剂的浓度)。

蛋白质复性方法及其注意事项蛋白前期准备(1)查阅目标蛋白相关文献,了解其等电点,标签等注意点。
(2)如果目标蛋白易降解,可在纯化时加1-2mMDTT,全程低温,及时处理。
(3)透析Buffer的选择可参考文献。
蛋白复性包涵体:在某些生长条件下,大肠杆菌能积累某种特殊的生物大分子,它们致密地集聚在细胞内,或被膜包裹或形成无膜裸露结构,这种水不溶性的结构称为包涵体(Inclusion Bodies,IB)。
在E.coli中累积的重组蛋白会迅速地以包涵体形式被沉淀出来,这些包涵体蛋白是丧失生物活性的不可溶的错误折叠蛋白的聚集体。
包涵体的处理一般包括这么几步:包涵体的洗涤、溶解、纯化及复性。
如果过表达蛋白在包涵体中,那么通常有两个选择可以考虑:(1)退一步,优化表达条件;(2)接受包涵体并采取策略来将蛋白溶解以及复性。
这里主要考虑第二种方案。
包涵体的洗涤破碎细胞都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入蛋白酶抑制剂等,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。
洗涤Buffer:50mM Tris-HCl(pH8.0), 2mM EDTA, 2mM DTT,150mM NaCl, 1% Triton X-100, 1mg/ml Leupeptin, 1mg/ml Pepstatin,1mM TCEP。
超声时用40-60ml裂解液,因为我们的超声仪很适合用100ml小烧杯,装40-60ml裂解液,这样能让超声头离液面不高不低,不会洒出来.菌多就延长超声时间(全程冰浴)。
包涵体的溶解1、对于尿素和盐酸胍的选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。
尿素溶解包涵体较盐酸胍慢而弱,溶解度为70-90%,尿素在作用时间较长或温度较高时会裂解形成氰酸盐,对重组蛋白质的氨基进行共价修饰,但用尿素溶解具有不电离,呈中性,成本低,蛋白质复性后除去不会造成大量蛋白质沉淀以及溶解的包涵体可选用多种色谱法纯化等优点,故目前已被广泛采用。
包涵体复性方法:一个有效的、理想的折叠复性方法应具备以下几个特点:活性蛋白质的回收率高;正确复性的产物易于与错误折叠蛋白质分离;折叠复性后应得到浓度较高的蛋白质产品;折叠复性方法易于放大;复性过程耗时较少。
(即回收高,易分离,浓度高,易放大,耗时少。
)1. 透析、稀释和超滤复性法:这三种方法是最传统也是应用最普遍的蛋白质折叠复性方法,复性活性回收率低,而且难于与杂蛋白分离。
透析法耗时长,易形成无活性蛋白质聚集体;超滤法在膜上聚集变性(不可逆变性),易造成膜污染;稀释法(直接加入水或缓冲液,放置过夜,缺点是体积增加较大,变性剂稀释速度太快,不易控制)处理量太大,不利于工业放大。
2. 凝胶过滤层析复性凝胶过滤层析复性又称体积排阻复性(SEC),是一种广泛应用的层析技术。
与常用的稀释复性法相比,凝胶过滤层析复性能在高的起始蛋白浓度下对蛋白进行复性,活性回收率较高,同时又能使目标蛋白得到一定程度的纯化。
凝胶过滤复性时,除了蛋白质在胶粒中的传质和扩散外,蛋白质与介质之间并不发生其它任何作用。
复性过程始终发生在溶液中。
蛋白质在伸展状态中,每个蛋白质分子的伸展状态都会有差别,而不同伸展状态的蛋白质分子在凝胶颗粒内部扩散所受到的限制也不相同,有的会扩散入颗粒内部深一些,有的会浅一些,这使不同伸展状态的蛋白质分子达到一定程度的分离,这样蛋白质分子问相互作用的机会就大大减少,从而起到一定抑制凝集的作用;即使发生了部分凝集,凝集的蛋白质会附着在胶粒上,而不随着溶液向下运动,这样后面的变性剂可以赶上凝集的蛋白质,使其重新溶解并变性;并且在凝胶过滤中脲等变性剂脱除得相对较慢,这对有些蛋白质的复性是有利的。
在普通凝胶过滤中,变性剂和还原剂的脱除(??)虽较稀释复性慢,但变性蛋白质仍会经历变性剂浓度突然变化的过程。
脲梯度复性是样品上柱前用复性缓冲液平衡柱子,接着使变性剂浓度递减(如从6M 盐酸胍或8M尿素下降到复性缓冲液中预先确定的变性剂的浓度)。
色谱法使蛋白质复性的流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!色谱法使蛋白质复性的流程。
1. 样品准备。
将待复性的蛋白质样品溶解在适当的缓冲液中。
重组包涵体蛋白质复性邹平基因工程技术的发展掀开了人类生命科学研究的崭新篇章,开辟了现代生物工业发展的新纪元。
重组DNA技术为大规模生产目标蛋白质提供了可能,E.coli以其易于操作、遗传背景清楚、发酵成本低和蛋白表达水平高等优点,是生产重组蛋白的首选表达系统。
但外源基因在E.coli中的高表达常常导致包涵体的形成,如何高效地复性包涵体蛋白是基因工程技术面临的一个难题。
随着人类基因组计划的完成和蛋白组计划的实施,人们将会更多地面临这一问题的挑战。
一、包涵体蛋白1、包涵体的形成包涵体主要是因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,而无法形成正确的次级键等原因形成的;也可能是外源基因合成速度太快,没有足够的时间进行折叠、二硫键不能正确的配对、过多的蛋白间的非特异性结合、蛋白质无法达到足够的溶解度等;重组蛋白质的一级结构也与包涵体形成有关,一般说含硫氨基酸越多越易形成包涵体,而脯氨酸的含量明显与包涵体的形成呈正相关;重组蛋白所处的环境不适,发酵温度高或胞内pH接近蛋白的等电点时易形成包涵体。
2、减少包涵体形成的策略降低重组菌的生长温度,是减少包涵体形成的最常用的方法。
低生长温度降低了无活性聚集体形成的速率和疏水相互作用;细菌生长缓慢溶氧水平低,也可减少包涵体的形成。
在培养重组菌中供给丰富的培养基,创造最佳培养条件,如供氧充足、合适pH等,以减少包涵体的形成。
添加可促进重组蛋白质可溶性表达的生长添加剂,增加细胞的渗透压。
在低的诱导剂条件下培养重组菌,减少重组蛋白表达量,也可减少包涵体的形成。
利用硫氧还蛋白融合表达或与目标蛋白共表达,得到可溶性目的蛋白。
筛选合适的宿主菌,使表达的重组蛋白可溶。
3、包涵体破菌、分离、洗涤常用高压匀化或机械、化学和酶相结合的方法破碎含包涵体的宿主菌细胞 ,再将破碎液通过低速离心或过滤除去可溶蛋白后获得包涵体。
包涵体中除了目的蛋白外还含有脂类、脂多糖、核酸和杂蛋白等成分,而这些成分会影响包涵体蛋白的复性,故去折叠前应洗涤包涵体,以去除杂质。
包涵体表达的蛋白的复性摘要综述了包涵体形成、包涵体分离和溶解、包涵体折叠复性的方法、复性产率低下的主要因素以及通过分子伴侣、低分子量添加物等的应用而提高了蛋白质复性产率。
关键词包涵体蛋白质复性Abstract Strategies for decreasing the formation of inclusion bodies, isolation and resolution of inclusion bodies, refolding of inclusion body proteins and the cause of decreased refolding yields were included. Renaturation yield of recombinant protein have been improved by using some additives, such as molecular chaperone, small molecules.Key words inclusion body , protein , renaturation外源基因在大肠杆菌中的高表达常常导致包涵体的形成,虽然包涵体具有富集目标蛋白质、抗蛋白酶、对宿主毒性小等优点,但包涵体蛋白质的复性率一般都很低,而分子伴侣、低分子量添加物等在复性过程中的应用及新的复性方法的建立都大大提高了重组蛋白质复性产率。
一、包涵体:包涵体的定义、组成与特性:包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒。
一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、内毒素、外膜蛋白ompC、ompF和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等,大小为,具有很高的密度(约ml),无定形,呈非水溶性,只溶于变性剂如尿素、盐酸胍等。
NMR 等新技术的应用表明包涵体具有一定量的二级结构,他们可能在复性的启动阶段中具有一定的作用。
[1]包涵体的形成:主要因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,或环境不适,无法形成正确的次级键等原因形成的。
1.2.1、基因工程菌的表达产率过高,超过了细菌正常的代谢水平,由于细菌的δ因子的蛋白水解能力达到饱和,使之表达产物积累起来。
研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体。
原因可能是合成速度太快,以至于没有足够的时间进行折叠,二硫键不能正确的配对,过多的蛋白间的非特异性结合,蛋白质无法达到足够的溶解度等。
1.2.2、重组蛋白的氨基酸组成:一般说含硫氨基酸越多越易形成包涵体,而脯氨酸的含量明显与包涵体的形成呈正相关。
1.2.3、重组蛋白所处的环境:发酵温度高或胞内pH接近蛋白的等电点时容易形成包涵体。
1.2.4、重组蛋白是大肠杆菌的异源蛋白,由于缺乏真核生物中翻译后修饰所需酶类和辅助因子,如折叠酶和分子伴侣等,致使中间体大量积累,容易形成包涵体沉淀。
1.2.5、蛋白质在合成之后,于中性pH或接近中性pH的环境下,其本身固有的溶解度对于包涵体的形成比较关键,即是说,有的表达产率很高,如Aspartase和Cyanase,表达产率达菌体蛋白的30%,也不形成包涵体,而以可溶形式出现。
[2]1.2.6、在细菌分泌的某个阶段,蛋白质分子间的离子键、疏水键或共价键等化学作用导致了包涵体的形成。
包涵体破菌、分离、洗涤及溶解1.3.1基因工程菌发酵液,经离心浓缩后,可用:机械破碎、超声破碎:单纯超声破碎,在小规模下且菌量较少的情况下效果较好,由于能量传递和局部产热等原因,很难用于大体积细胞悬液的破碎,这样部分未破碎细胞与包涵体混在一起,给后期纯化带来困难。
因此,在较大规模纯化时先用溶菌酶破碎细菌的细胞膜,再结合超声破碎方法,可显着提高包涵体的纯度和回收率。
以及化学方法破碎使细菌裂解,然后以5000-20000g 15min离心,可使大多数包涵体沉淀,与可溶性蛋白分离。
1.3.2洗涤:为了除去包涵体上粘附的杂质,如膜蛋白或核酸,应用洗涤液洗涤包涵体,通常用低浓度的变性剂,过高浓度的尿素或盐酸胍会使包涵体溶解,如2M尿素在50mM Tris 左右,1mM EDTA中洗涤。
此外可以用温和去垢剂TritonX-100洗涤去除膜碎片和膜蛋白。
[3]1.3.3溶解:一般用强的变性剂如尿素(6-8M)、盐酸胍(GdnHCl 6M),通过离子间的相互作用,打断包涵体蛋白质分子内和分子间的各种化学键,使多肽伸展,一般来讲,盐酸胍优于尿素,因为盐酸胍是较尿素强的变性剂,它能使尿素不能溶解的包涵体溶解,而且尿素分解的异氰酸盐能导致多肽链的自由氨基甲酰化,特别是在碱性pH值下长期保温时。
或用去垢剂,如SDS、正十六烷基三甲基铵氯化物、Sarkosyl等,可以破坏蛋白内的疏水键,也可溶解一些包涵体蛋白质。
Kandula Suntha等人用TritonX-100来溶解Zymononas mobilis levansucrase包涵体蛋白。
另外,对于含有半胱氨酸的蛋白质,分离的包涵体中通常含有一些链间形成的二硫键和链内的非活性二硫键。
还需加入还原剂,如巯基乙醇、二硫基苏糖醇(DTT)、二硫赤藓糖醇、半胱氨酸。
还原剂的使用浓度一般是50-100mM 2-BME或DTT,也有文献使用5mM浓度。
在较粗放的条件下,可以使用5ml/l的浓度。
还原剂的使用浓度与蛋白二硫键的数目无关,而有些没有二硫键的蛋白加不加还原剂无影响,如牛生长激素包涵体的增溶。
对于目标蛋白没有二硫键某些包涵体的增溶,有时还原剂的使用也是必要的,可能由于含二硫键的杂蛋白影响了包涵体的溶解。
[4]二、复性:由于包涵体中的重组蛋白缺乏生物学活性,加上剧烈的处理条件,使蛋白的高级结构破坏,因此重组蛋白的复性特别必要。
通过缓慢去除变性剂使目标蛋白从变性的完全伸展状态恢复到正常的折叠结构,同时去除还原剂使二硫键正常形成。
一般在尿素浓度4M左右时复性过程开始,到2M 左右时结束。
对于盐酸胍而言,可以从4M 开始,到1.5M 时复性过程已经结束。
包涵体蛋白复性方法2.1.1稀释复性:直接加入水或缓冲液,放置过夜,缺点是体积增加较大,变性剂稀释速度太快,不易控制。
目前稀释法主要有一次稀释、分段稀释和连续稀释三种方式。
2.1.2透析复性:好处是不增加体积,通过逐渐降低外透液浓度来控制变性剂去除速度,有人称易形成无活性蛋白质聚体,且不适合大规模操作,无法应用到生产规模。
2.1.3超滤复性:在生产中较多的使用,规模较大,易于对透析速度进行控制,缺点是不适合样品量较少的情况,且有些蛋白可能在超滤过程中不可逆的变性。
2.1.4柱上复性:是最近研究较多并成功的在生产中应用的一种复性方法,包涵体蛋白变性后,在色谱柱上复性,大致可分成疏水柱复性及凝胶柱复性两类。
其中的凝胶柱复性均是用Sephacry1S-100或Superdex75 等分子筛填料,柱较长(40cm-100cm不等)。
相比稀释和透析两种方法,色谱柱复性回收率高(高达90%以上)、快速、易放大,样品稀释倍数小(一般五倍左右)[5]2.1.5高蛋白质浓度下的复性:通常有两种方法,一是缓慢地连续或不连续地将变性蛋白加入到复性缓冲液中,使得蛋白质在加入过程中或加入阶段之间有足够的时间进行折叠复性;二是采用温度跳跃式复性,即让蛋白质先在低温下折叠复性以减少蛋白质聚集的形成,当形成聚集体的中间体已经减少时,迅速提高温度以促进蛋白质折叠复性。
此外,吸附法、反胶束法和双水相萃取法等都可用蛋白质的复性。
包涵体蛋白复性效率复性是一个非常复杂的过程,除与蛋白质复性的过程控制相关外,还很大程度上与蛋白质本身的性质有关,有些蛋白非常容易复性,如牛胰RNA酶有12对二硫键,在较宽松的条件下复性效率可以达到95%以上,而有一些蛋白至今没有发现能够对其进行复性的方法如IL-11,很多蛋白的复性效率只有百分之零点几,如在纯化IL-2时以十二烷基硫酸钠溶液中加入铜离子(%SDS,mol/l CuCl2)的方法,25-37°C下反应3小时,再EDTA至1m mol/l终止反应,复性后的二聚体低于1%。
[6]一般说来,蛋白质的复性效率在20%左右。
2.2.1影响复性效率的因素:2.2.1.1蛋白质的复性浓度:正确折叠的蛋白质的得率低通常是由于多肽链之间的聚集作用,蛋白质的浓度是使蛋白质聚集的主要因素,因而,一般浓度控制在ml;如果变性蛋白加入复性液中过快,容易形成絮状沉淀,可能是蛋白重新凝聚的缘故。
所以我们采用再水浴和磁力搅拌下,逐滴加入变性蛋白,使变性蛋白在复性液中始终处于低浓度状态。
2.2.1.2pH和温度:复性缓冲液的pH值必须在以上,这样可以防止自由硫醇的质子化作用影响正确配对的二硫键的形成,过高或过低会降低复性效率,最适宜的复性pH值一般是。
[12]此外,影响复性效率的因素还有,变性剂的起始浓度和去除速度、氧化还原电势、离子强度、共溶剂和其他添加剂的存在与否等。
2.2.2提高包涵体蛋白的复性产率2.2.2.1氧化-还原转换系统对于含有二硫键的蛋白,复性过程应能够促使二硫键形成。
常用的方法有:空气氧化法、使用氧化交换系统、混合硫化物法、谷胱甘肽再氧化法及DTT再氧化法.最常用的氧化交换系统是GSH/GSSG,而cysteine/cystine、cysteamine/cystamine、DTT/GSSG、DTE/GSSG等也都有应用。
氧化交换系统通过促使不正确形成的二硫键的快速交换反应提高了正确配对的二硫键的产率。
通常使用1-3m mol/l还原型巯基试剂,还原型和氧化型巯基试剂的比例通常为10:1—5:1。
[7]2.2.2.2添加低分子化合物低分子化合物自身并不能加速蛋白质的折叠,但可能通过破坏错误折叠中间体的稳定性,或增加折叠中间体和未折叠分子的可溶性来提高复性产率。
如盐酸胍、脲、烷基脲、以及碳酸酰胺类等,在非变性浓度下是很有效的促进剂。
蛋白质的辅因子、配基或底物亦可起到很好的促折叠作用,如蛋白质的辅因子Zn2+或Cu2+可以稳定蛋白质的折叠中间体,从而防止了蛋白质的聚集,加入浓度大于mol/lTris缓冲液可提高包涵体蛋白质的折叠效率。
浓度为-0.6M L-Arg有助于增加复性中间产物的溶解度。
成功的应用于很多蛋白如t-PA的复性中,可以抑制二聚体的形成。
NDSBs是近年来出现的可促进蛋白复性的新家族, NDSBs由一个亲水的硫代甜菜碱及一个短的疏水集团组成,故不属于去垢剂,不会形成微束,易于透析去除,目前,常用的有NDSB-195,NDSB-201,NDSB-256。
[8]2.2.2.3PEG-NaSO4两相法用PEG和NaSO4作为成相剂,然后加入盐酸胍,再把变性的还原的蛋白质溶液加入其中进行复性,但这种方法需复性的变性蛋白质的浓度必须低。