气相与液相法制备纳米材料
- 格式:doc
- 大小:1.04 MB
- 文档页数:17


第五章纳米材料的制备5.2 固相法和液相法徐强2009-03-11上次课内容重点1.气相法制备纳米颗粒气体冷凝法、流动液面上真空蒸镀法、通电加热蒸发法、激光诱导化学气相沉积2.气相法制备纳米薄膜物理气相沉积(蒸镀、溅射、离子镀的原理与比较)化学气相沉积(定义、化学反应)主要内容一、气相法二、固相法三、液相法固相法1、高能球磨法(机械合金化法)(重点)2、剧烈塑性变形法(等通道挤压和高压扭转)(了解)高能球磨高能球磨历史高能球磨技术简介高能球磨理论研究高能球磨结构材料开发 高能球磨功能材料开发高能球磨历史高能球磨(High-energy Ball Milling)技术,也称为机械合金化(Mechanical Alloying),是上世纪70年代初由美国国际镍公司(INCO)开发的,最初是用于研制氧化物弥散强化的镍基超合金。
自上世纪80年代初发现它可用来制备非晶态材料后,对它的研究引起人们极大的兴趣。
近年的研究表明,由于高能球磨过程中引入大量的应变、缺陷及纳米量级的微结构,使得合金化过程的热力学和动力学过程不同于普通的固态反应过程,提供了其它技术(如快速凝固等)不可能得到的组织结构,因而有可能制备出常规条件下难以合成的许多新型合金。
高能球磨技术简介高能球磨是一个高能量干式球磨过程。
简单地说,它是在高能量磨球的撞击研磨作用下,使研磨的粉末之间发生反复的冷焊和断裂,形成细化的复合颗粒,发生固态反应形成新材料的过程。
原材料可以是元素粉末、元素与合金粉末和金属间化合物、氧化物粉末等的混合物。
磨球一般采用钢球。
唯一一种由上到下制备纳米粒子的方法。
高能球磨工艺特点工艺简单,易于工业化生产,产量大。
整个过程在室温固态下进行,无需高温熔化,工艺简单灵活。
合成制备材料体系广,不受平衡相图的限制。
可得到其它技术较难得到的组织结构,如宽成分范围的非晶合金、超饱和固溶体、纳米晶合金及原位生成的超细弥散强化结构。
可合成制备常规方法无法得到的合金,特别是不互溶体系合金、熔点差别大的合金、比重相差大的合金及蒸汽压相差较大的合金等难熔合金的制备。


纳米粉末的制备方法材料研1203 Z1205020 石南起纳米科技是20世纪80年代末90年代初诞生并迅速发展和渗透到各学科领域的一门崭新的高科技。
由于它在21世纪产业革命中具有战略地位,因而受到世界的普遍关注。
有人说,70年代微电子学产生了世界性的信息革命,那么纳米科技将是21世纪信息革命的核心。
纳米技术的飞速发展极大的推动了材料科学的研究和发展,而纳米材料研究的一个重要阶段是纳米粉体的制备。
1.纳米粉体的制备要使纳米材料具有良好的性能,纳米粉末的制备是关键。
纳米粉末的制备方法主要有物理法、化学法和高能球磨法。
1.1物理法物理法中较重要的是气体中蒸发法,在惰性气体中蒸发金属,急冷生成纳米粉体。
如在容器中导入低压的氩或氦等惰性气体,通过发热体使金属熔化、蒸发,蒸发的金属原子和气体分子碰撞,使金属原子凝聚成纳米颗粒。
通过蒸发温度、气体种类和压力控制颗粒大小,一般制得颗粒的粒径为10nm左右。
比较重要的物理法还有溅射法、金属蒸气合成法及流动油上真空蒸发法等。
1.2化学法化学法制备纳米粉可分气相反应法和液相反应法。
1.2.1气相反应法气相反应法是利用化合物蒸气的化学反应的一种方法,其特点是:(1)原料化合物具有挥发性,提纯比较容易,生成物纯度高,不需要粉碎。
(2)气相物质浓度小,生成的粉末凝聚较小。
(3)控制生成条件,容易制得粒径分布窄,粒径小的微粒。
(4)气氛容易控制,除氧化物外,用液相法直接合成困难的金属、碳化物、氮化物均可合成。
气相合成中除了反应原料均为挥发性物外,也可用电弧、等离子体、激光加热固体使其挥发,再与活性气体反应生成化合物纳米粉体。
1.2.2液相反应法液相反应法作为一种制备超细粉体的方法成为各国材料科学家研究的热点,它具有无需高真空等苛刻物理条件、易放大的特点,并且得到的粉体性能比较优越。
常用的液相反应法有共沉淀法、水解法、溶胶凝胶法、微乳液反应法等。
共沉淀法是利用各种在水中溶解的物质,经反应成不溶解的氢氧化物、碳酸盐、硫酸盐、醋酸盐等,再经加热分解生成高纯度的超微粉料。


【文献综述】一维无机纳米材料的制备方法一.气相法制备①汽-液-固(VLS)机理生长方法一(VLS生长法):1.以液态金属团簇催化剂作为反应物。
2. 将要制备的一维纳米材料的材料源加热形成蒸汽。
3. 蒸汽扩散到液态金属团簇催化剂表面,形成过饱和团簇后在催化剂表面饱和析出,从而形成一维纳米结构备注:液态金属催化剂液滴的尺寸决定了制备出的纳米线的直径。
方法二(激光烧蚀法+VLS生长法):1.用含有少量Fe、Au、Ni等金属催化剂的硅粉作为烧蚀靶2.以氩气作为保护气3.在陶瓷管中以一定温度下激光蒸发就可获得纳米线备注:激光烧蚀法制备出的纳米线直径小于VLS生长法催化剂的选定:根据相图选定一种能与纳米线材料形成液态合金的金属催化剂温度的选定:根据相图选定液态合金和固态纳米线材料共存区及制备温度在纳米线生长头部有一个催化剂纳米颗粒应用:VLS生长机理可以应用于制备一维无机纳米材料,例如元素半导体,半导体,氧化物等。
但不能制备一维金属纳米材料。
同时还应继续探索去除金属催化剂的后处理工序。
②氧化物辅助生长方法:1.用SiO2取代金属催化剂制成硅靶,2.采用激光烧蚀法,热蒸发,化学气相沉积法大规模制备硅纳米线备注:1.氧化物在硅纳米线的成核及生长过程中起主导作用2.不需要金属催化剂,避免了金属污染,保证了硅纳米线的纯度。
应用:除了硅以外,还可以制备Ge、C、SiC等Ⅳ族元素及化合物半导体,GaN等Ⅲ-Ⅴ族化合物半导体及ZnO和ZnS等Ⅱ-Ⅵ族材料,并可制备包括线、棒、共轴线、链和丝带状在内的一维纳米结构。
③气-固(VS)生长方法:1.将一种或几种反应物在反应容器的高温区加热形成蒸汽2.利用惰性气体的流动输送到低温区或者通过快速降温使蒸汽沉积下,从而制备出各种纳米材料备注:1.可分为固体粉末物理蒸发法和化学气相沉积法。
前者属于物理过程,后者在形成蒸汽后发生了化学反应。
且此方法不需加入金属催化剂。
2.纳米线外部包围氧化物层3.所需制备温度较高4.制备得到的纳米材料质量较高应用:氧化铝纳米带、氧化锌、氧化锡、氧化铟纳米带,氧化铝、氧化镁及氧化锌纳米棒,氮化镓和硫化镉钠米线。

纳米材料制备方法综述
纳米材料由于其特殊性质,近年来受到人们极大的关注。
随着纳米科技的发展,纳米材料的制备方法已日趋成熟。
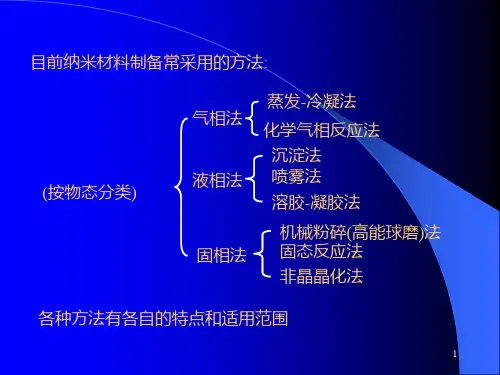
纳米材料的制备方法按物态一般可归纳为气相法、液相法、固相法。
一、气相法
气相法是将高温的蒸汽在冷阱中冷凝或在衬底上沉积和生长低维纳米材料的方法。
气相法主要包括物理气相沉积(PVD)和化学气相沉积(CVD),在某些情况下使用其他热源获得气源,如电阻加热法,高频感应电流加热法,混合等离子加热法,通电加热蒸发法。
二、液相法
液相法是以均匀的溶液相为出发点,通过各种途径是溶液和溶剂分离,溶质形成一定形状和大小的颗粒或所需材料的前驱体,再通过干燥或热分解后得到纳米颗粒,该法主要用于氧化物纳米材料的制备。
常用的液相法包括沉淀法,水热法,微乳液法,喷雾法和溶胶-凝胶法。
三、固相法
固相法合成与制备纳米材料是固体材料在不发生熔化、气化的情况下使原始晶体细化或反应生成纳米晶体的过程。
目前,发展出的固相法主要有高能球磨法、固相反应法、大塑性变形法、非晶晶化法及表面纳米化等方法。

光催化剂的制备目前,实验室制备和合成纳米TiO2光催化剂的方法很多,大致可以分为气相法,液相法和固相法。
1.2.2.1 气相法气相法是利用气体或通过加热使钛盐变为蒸气,然后发生物理或化学变化,最后冷却-凝聚-长大形成纳米TiO2粒子的方法。
采用气相法制备的纳米TiO2粒子纯度高,粒径分布窄,尺寸均匀,化学活性好,但是制备工艺复杂,成本高,产率低。
常见的气相法包括氢氧火焰水解法、气相氧化法,气相水解法、气相分解法等。
1.2.2.2 液相法液相法是生产各种氧化物颗粒的主要方法之一。
它的基本原理是:将可溶性金属钛盐,按所制备材料的组成配制溶液,再用沉淀剂使金属离子均匀沉淀出来。
与气相法相比,液相法制备纳米TiO2薄膜具有工艺简单、合成温度低、能耗少以及设备投资小的优点,是制备纳米TiO2粉体和薄膜较理想的方法,是目前实验室和工业上广泛采用的制备薄膜和超微粉的方法。
主要包括溶胶-凝胶法,水热合成法、液相沉积法,水解法,微乳液法等。
溶胶凝胶法一般是以有机或者无机钛盐为原料,在有机介质中(酸或有机聚合添加剂)进行水解、缩聚反应,最后将得到的溶胶干燥、煅烧得到TiO2纳米颗粒。
整个反应过程如下:Ti(OR)4 + nH2 O →Ti(OR) (OH) + nROH水解反应4-n n 4-n n-1 2 22Ti(OR) (OH) →[Ti(OR) (OH) ] O + H O缩聚反应Ti(OR) + 2H2O →TiO +4HOR总反应与传统的纳米材料制备方法相比,溶胶-凝胶法制备的TiO2纳米颗粒具有纯度高,粒径分布窄,单分散性好,反应容易控制等优点,但是成本高,工艺时间长。
水热合成法是在密闭高压反应釜中加入前驱体溶液,高温高压条件下发生反应制备纳米级TiO2粉末的方法。
该方法的优点在于制备的纳米TiO2粉体晶粒完整,原始粒径小,分布较均匀,但反应条件为高温、高压,因而对设备材质、安全要求较严格。
液相沉积法是利用水溶液中氟的金属配位离子和金属氧化物之间的化学平衡反应,将金属氧化物沉积到反应液中的衬底上,最后煅烧得到纳米TiO2材料[8]。

一 .纳米微粒的制备方法分类:1.根据是否发生化学反应,纳米微粒的制备方法通常分为两大类:物理方法和化学方法。
2. 根据制备状态的不同,制备纳米微粒的方法可以分为气相法、液相法和固相法等;3 .按反应物状态分为干法和湿法。
二气相法制备纳米材料1 定义:气相法指直接利用气体或者通过各种手段将物质变为气体,使之在气体状态下发生物理或化学反应,最后在冷却过程中凝聚长大形成纳米微粒的方法。
2 气相法法主要具有如下特点:①表面清洁;②粒度整齐,粒径分布窄;③粒度容易控制;④颗粒分散性好。
3 优势:气相法通过控制可以制备出液相法难以制得的金属碳化物、氮化物、硼化物等非氧化物超微粉。
4 加热源通常有以下几种:1)电阻加热;2)等离子喷射加热;3)高频感应加热;4)电子束加热;5)激光加热;6)电弧加热;7)微波加热。
三气体冷凝法1 定义:气体冷凝法是在低压的氩、氮等惰性气体中加热金属,使其蒸发后形成超微粒(1—1000 nm)或纳米微粒的方法。
4 气体冷凝法影响纳米微粒粒径大小的因素:•惰性气体压力,•蒸发物质的分压,即蒸发温度或速率,•惰性气体的原子量。
•总之,纳米粉体粒径的控制[1] 可通过调节惰性气体压力,温度,原子量;[2] 蒸发物质的分压即蒸发温度或速率等来控制纳米粒子的大小;A 蒸发速率的增加(等效于蒸发源温度的升高)粒子变大B 原物质蒸气压力的增加,粒子变大C 惰性气体原子量加大,或其压力增大,粒子近似的成比例增大。
5 气体冷凝法优点:表面清洁,粒度齐整,粒度分布窄,粒度容易控制。
四化学气相沉积1.定义:是指在远高于临界反应温度的条件下,通过化学反应,使反应产物蒸气形成很高的过饱和蒸气压,自动凝聚形成大量的晶核,这些晶核不断长大,聚集成颗粒,随着气流进入低温区,最终在收集室内得到纳米粉体。
(气态反应物受热,沉积出产物的反应2. 化学气相沉积的特点①保形性: 沉积反应如在气固界面上发生,则沉积物将按照原有固态基底的形状包复一层薄膜。

学年论文`题目:一维纳米材料的制备方法概述学院:化学学院专业年级:材料化学2011级学生姓名:龚佩斯学号:20110513457指导教师:周晴职称:助教2015年3月26日成绩一维纳米材料制备方法概述--气相法、液相法、模板法制备一维纳米材料材料化学专业2011级龚佩斯指导教师周晴摘要:一维纳米材料碳纳米棒、碳纳米线等因其独特的用途成为国内外材料科学家的研究热点。
然而关于如何制备出高性能的一维纳米材料正是各国科学家所探究的问题。
本文概述了一维纳米材料的制备方法:气相法、液相法、模板法等。
关键词:一维纳米材料;制备方法;气相法;液相法;模板法Abstract: the nanoscale materials such as carbon nanorods and carbon nanowires have become the focus of intensive research owing to their unique applications. but the question that how to make up highqulity one-dimentional nanostructure is discussing by Scientists all around the world. This parper has reviewed the preparation of one dimention nanomaterials ,such as vapor-state method, liqulid -state method ,template method and so on.Key words: one-dimention nanomaterials ; preparatinal method ; vapor-state method liqulid-state method ; template method纳米材料是基本结构单元在1nm ~100nm之间的材料,按其尺度分类包括零维、一维、二维纳米材料。
纳米材料的制备方法纳米材料是指在至少一个尺寸方向上小于100纳米的材料。
纳米材料具有独特的物理、化学和生物学性质,因此在材料科学、能源、电子、医学等领域具有广泛的应用前景。
纳米材料的制备方法繁多,以下列举几种常见的方法。
1. 气相法:气相法是指通过热蒸发、蒸发凝聚、气相沉积等方法,在气氛中制备纳米材料。
例如,利用物理气相沉积(PVD)或化学气相沉积(CVD)技术可以制备金属纳米颗粒或纳米薄膜。
这种方法适用于制备金属、氧化物等纳米材料。
2. 溶剂法:溶剂法是指利用液相溶剂,在溶液中制备纳米材料。
常见的方法包括溶胶-凝胶法、共沉淀法、热分解法等。
例如,通过调控溶剂中溶质浓度、温度等参数,可以制备具有不同尺寸和形状的纳米颗粒。
3. 机械法:机械法是指通过机械力对材料进行机械加工,从而制备纳米材料。
常见的方法包括球磨法、高能球磨法等。
例如,在球磨罐中加入适量的材料和球磨介质,通过强烈的冲击、剪切和摩擦作用,将材料逐渐研磨成纳米颗粒。
4. 生物法:生物法是指利用生物体、细胞或其代谢产物合成纳米材料。
例如,通过微生物酶或细菌对金属离子的还原作用,可以制备金属纳米颗粒;利用植物或动物细胞对金属离子的生物还原作用,也可以制备具有一定形貌和大小的纳米颗粒。
5.杂化法:杂化法是指将不同的制备方法组合使用,通过不同步骤的组合实现纳米材料的制备。
例如,将溶胶-凝胶法和热分解法相结合,可以在溶胶中加入金属盐,然后通过热处理得到具有纳米尺寸的金属氧化物。
总的来说,纳米材料的制备方法丰富多样,选择适合的方法取决于其应用领域、所需尺寸和性质等要求。
随着纳米材料制备技术的不断发展和突破,相信纳米材料在各个领域的应用将会进一步得到拓展和广泛应用。
纳米材料的制备方法纳米材料的制备方法主要包括:物理法和化学法两大类。
(1)物理法:放电爆炸法、机械合金化法、严重塑性变形法、惰性气体蒸发法、等离子蒸发法、电子束法、激光束法等。
(2)化学法:气相燃烧合成法、气相还原法、等离子化学气相沉积法、溶胶一凝胶法、共沉淀法、碳化法、微乳液法、络合物分解法等。
纳米微粒和纳米材料具有广阔的应用前景,它的应用领域包括化工、机械、生物工程、电子、航天、陶瓷等方面。
(1)纳米微粒用作催化剂。
聚合型马来酰亚胺树脂材料在军工、民用行业得到广泛应用,它性能优良,被认为是最有发展前途的树脂基体。
纳米TiO2可作为N—苯基马来酰亚胺聚合反应的催化剂。
(2)纳米微粒可提高陶瓷塑性。
纳米TiO2与其它金属氧化物纳米晶一起可组成具有优良力学性能的各种新型复合陶瓷材料,在开发超塑性陶瓷材料方面具有诱人的前景。
(3)纳米微粒用作润滑油添加剂,可大大减轻摩擦件之间的磨损。
把平均粒径小于10nm的金刚石微粒(NMD)均匀加入Cu10Sn合金基体中,干滑动摩擦试验结果表明:在载荷78N、滑动速率低于1.6m/s时,Cu10Sn2NMD复合材料的摩擦因数稳定在0.19左右,远低于基体Cu10Sn合金(μ=0.31~0.38)。
而且Cu10Sn合金在摩擦过程中产生较大的噪音,摩擦过程不平稳,而Cu10Sn2NMD复合材料摩擦过程非常平稳,噪音很低,并且在摩擦副的表面形成了部分连续的固体润滑膜。
(4)纳米颗粒用于生物传感器。
葡萄糖生物传感器在临床医学、食品工业等方面都有重要的用途。
将金、银、铜等纳米颗粒引入葡萄糖氧化酶膜层中,由此制得的生物传感器体积小,电极响应快、灵敏度高。
(5)纳米复合材料。
采用溶胶—凝胶法可制备出聚酰亚胺/二氧化硅纳米复合材料。
(6)纳米微晶应用于磁性材料中,可制备出高效电子元件和高密度信息贮存器。
纳米材料人们将晶体区域或其它特征长度在纳米量级范围(小于100nm)的材料广义定义为"纳米材料"或"纳米结构材料"(nanostructured materials)。
液相制备纳米材料的原理、方法、形成机理和结构液相法实在液体状态下通过化学反应制取纳米材料方法的总称,又称为湿化学法或溶液法。
现在,有各种各样的制备方法,文献中无公认一致的分类方法,相反还有些凌乱。
为清晰醒目,特点明显,便于理解。
这里将液相材料的纳米制备方法分为:沉淀法、溶胶-凝胶(sol-gel)法、水热法、化学还原法、化学热分解法、微乳胶法、声化学法、电化学法和水中放电法等中。
3.1 沉淀法3.1.1 共沉淀和分步沉淀不论溶液中有一种还是几种离子,都能够同时生成沉淀的反应,就是共沉淀。
一般沉淀法的工艺流程可表示为图3.1所示。
分步沉淀则是反应中有多种可能的沉淀物,依次一个个地进行沉淀,称之为分步沉淀。
Raming等人就用了共沉淀和分步沉淀两种方法制备了掺Y的四方Zr+Fe3O4纳米粉末。
在共沉淀中,他们将ZrOCl2.8H2O和YCl3与FeCl3.6H2O的混合溶液,缓慢的加入到剧烈搅拌含有质量分数为25%、PH值约为14的氨水中,产生出的金属与氢氧化物混合的直接沉淀物。
在分步沉淀法中,他们用了两种不同的步骤。
第一种是先沉淀三氧化二铁,再沉淀氧化锆,简写成SPHZ;第二种则倒过来,先沉淀氧化锆,再沉淀氧化铁,简写成SPZH。
第一种具体操作是,将八水氯酸锆和YCl3的水溶液加到碱性的悬浮着氧化铁粒子的溶液中,因此是先沉淀氧化铁,再沉淀氧化锆。
第二种分步沉淀则是将六水氯化铁水溶液加到悬浮有氧化锆粉末粒子的碱性溶液中,因此是先沉淀氧化锆,再沉淀氧化铁。
这两种分步沉淀中,都是在剧烈搅拌中,将酸性的金属离子加入到碱性的氨水中,在悬浮液中导致金属氢氧化物的爆炸式成核。
经水洗后,在100℃下干燥成胶状,再在500-700℃温度内煅烧2h,以得到完全的晶体物质。
3.1.2 均匀沉淀无论是在CP还是在SP中,由于沉淀剂在金属溶液中的加入,哪怕是沉淀剂加入量很少,并不断的搅拌,在局部溶液中的沉淀剂浓度都可以变得很高,于是这些地方就首先沉淀,使沉淀变得不均匀,必须在溶液中消除不均匀的沉淀,而使整个溶液中均匀的生成沉淀。
原则上讲,只要能保证溶液中均匀成核,核又能够均匀的长大,就能够达到均匀沉淀的目的。
应当说,目前仍然没有行之有效的办法,但已经取得了不少有价值的认识和了解。
Eshuis等人在评述了以前很多作者在研究均匀沉淀ZnS纳米粒子方面取得成就以及存在的相互矛盾的解释后,在他们的实验基础上提出了一个4步模型,认为能够很好的解释实验结果,并认为可以适用于其他类似反应。
他们使用硫代乙酰胺和锌酸盐溶液,发现溶液的PH值、阳离子的形式、连续相的黏度以及搅拌程度,对于粒子的形成、粒子尺寸和形貌都有影响,但是,PH值的影响最大,阳离子形式,即是什么样的阳离子,影响则小得多。
他们的研究还发现,如果PH<2,此时表面电荷足够大,可以阻止粒子无控制的长大,同时如果沉淀介质中没有电流,就可以形成单分散的球形粒子。
3.2 溶胶-凝胶法溶胶-凝胶法是通过加水形成胶状悬浮溶液,缩水转变为湿凝胶,最后干燥变为干凝胶以制备纳米材料的一种湿化学制备方法。
这是一种相当古老的化学工艺办法,早在19世纪中叶,Ebekmanl,Graham以及Liesegang就研究过二氧化硅凝胶。
他们观察到在酸性条件下,由四乙基硅烷水解可以得到类似于玻璃材料那样的SiO2。
他们好发现这种黏性的凝胶可以拉拔出纤维丝,甚至能够制备成单块光学透镜片。
不过,为了避免二氧化硅碎裂成细粉末,干燥时间非常长,要一年或一年以上。
因此,技术上对它没什么兴趣。
经过人类漫长岁月的探索,其中特别重要的事件包括:Roy在20世纪50-60年代认识到溶胶-凝胶法有可能制备出化学上很均匀的凝胶,并制备了Al、Si、Ti、Zr元素等大量新的陶瓷氧化物,而他们是难以用传统制备陶瓷的方法制备出来的。
与此同时,Iler的有关二氧化硅化学先驱工作导致胶体制备二氧化硅粉末的商业应用,而Stober等人则发现用氨水作催化剂,可以使TEOS的水解能够对所产生的粉末在形状和粒度上得到控制,而得到称之为Stober球星二氧化硅粉末。
3.2.1 溶胶-凝胶法的制备工艺用于制备湿凝胶的化合物是各种金属或金属化合物,金属醇盐最为常用,因为他们易于与水发生反应。
而用的最多的醇盐是四甲氧基硅烷和TEOS,当然,其他的醇盐,比如铝酸盐、钛酸盐等也常用,且通常与TEOS混合使用。
Sol-gel 方法典型的工艺流程如图3.13所示,显然与前面的共沉淀和均匀沉淀相比有其不同的特点。
3.2.2 反应原理根据大量实验研究,对于典型的溶胶凝胶反应,其反应机理已大体上有了一个比较明确的看法。
反应机理包括下述内容:(1)通过水解和聚合反应单体聚合成固体粒子,在这个阶段内,液体中的反应物,比如TMOS、TEOS、丙氧基锆、丁氧基钛等通过水解和凝聚反应,生成纳米粒子,悬浮于液体中形成凝胶状新相。
M-O-R+H2O——M-OH+R-OH(水解) (1)M-OH+OH-M----M-O-M+H2O(水凝胶) (2)M-O-R+HO-M-----M-O-M+R-OH(酒精凝聚)(3)(M=Si,Zr,Ti)(2)粒子长大(3)粒子凝聚成链状,然后在整个溶胶溶液中形成网络,真厚成凝胶(4)通过高温干燥,最后得到粉末成品。
这些反应机理中,通常有许多因素影响凝胶的形成,这些因素包括:反应中PH 值、温度和时间。
反应及浓度、催化剂的性质和浓度。
水与金属或非金属离子的物质的量子比等。
3.2.3 相关应用金属化合物经溶液、溶胶、凝胶而固化,再经低温热处理而生成纳米粒子。
其特点反应物种多,产物颗粒均一,过程易控制,适于氧化物和Ⅱ~Ⅵ族化合物的制备。
溶胶一凝胶法作为低温或温和条件下合成无机化合物或无机材料的重要方法,在软化学合成中占有重要地位。
在制备玻璃、陶瓷、薄膜、纤维、复合材料等方面获得重要应用,更广泛用于制备纳米粒子。
具体领域体现在:①材料学:高性能粒子探测器,隔热材料,声阻抗耦合材料,电介质材料,有机-无机杂化材料,金属陶瓷涂层耐蚀材料,纳米级氧化物薄膜材料,橡胶工业。
②催化剂方面:金属氧化物催化剂,包容均相催化剂。
③色谱分析:制备色谱填料,制备开管柱和电色谱固定相,电分析,光分析。
溶胶-凝胶法与其它方法相比具有许多独特的优点:(1)由于溶胶-凝胶法中所用的原料首先被分散到溶剂中而形成低粘度的溶液,因此,就可以在很短的时间内获得分子水平的均匀性,在形成凝胶时,反应物之间很可能是在分子水平上被均匀地混合。
(2)由于经过溶液反应步骤,那么就很容易均匀定量地掺入一些微量元素,实现分子水平上的均匀掺杂。
(3)与固相反应相比,化学反应将容易进行,而且仅需要较低的合成温度,一般认为溶胶一凝胶体系中组分的扩散在纳米范围内,而固相反应时组分扩散是在微米范围内,因此反应容易进行,温度较低。
(4)选择合适的条件可以制备各种新型材料。
溶胶一凝胶法也存在某些问题:通常整个溶胶-凝胶过程所需时间较长(主要指陈化时间),常需要几天或者几周;还有就是凝胶中存在大量微孔,在干燥过程中又将会逸出许多气体及有机物,并产生收缩。
3.3 化学还原法3.3.1化学还原法制备工艺化学还原法制备纳米材料的主要影响因素有:还原剂浓度、金属盐浓度、溶液PH值、滴加时间。
还原剂浓度的影响例1:制备Co-B非晶态合金纳米粒子随着硼氢化物的浓度从0.1mol/L增加到1.2mol/L,所得粒子硼含量从32增加到40%。
例2:制备Fe-B非晶态纳米粒子第一种情况:还原剂滴加到金属盐溶液中随着还原剂浓度降低,非晶态合金粒子中B的含量逐渐升高,结晶性逐渐降低。
第二种情况:金属盐溶液滴入不同浓度的还原剂溶液中B的含量保持在34%左右,粒子结构都呈非晶态。
金属盐浓度的影响金属盐溶液浓度的高低势必影响粒子的成核和长大,因而会影响到成分和结构。
例:NiCl2溶液浓度对形成Fe-Ni-B纳米粒子的成分和结构的影响图3.28(a)表示,在M(Ni)>0.055之后,粒子才是非晶态的。
在M(Ni)≦0.04之后,基本上是晶态。
按照非晶态形成理论,只有当硼随这样一些有利于非晶态形成的元素超过一定量之后,非晶态才能形成。
溶液PH值的影响如图3.30所示,在用化学还原法制备Fe-B合金的过程中PH值对它的影响。
最开始PH值在5以下时,制备生成的合金中B的含量随着PH值的增加而增加。
在PH值达到5-7之间的时候,B的含量基本不变。
当PH值超过7的时候,随着PH 值的增加,合金中B的含量随之减少。
滴加时间的影响表3.5显示了不同的合金随着滴加时间的变化,合金内部元素含量的质量分数的变化情况。
化学还原法的反应机理对于只含B合金的反应,用的还原剂目前只有硼氢化合物,这种化合物的明显特征是遇水易分解,只能存在与碱性溶液中。
总的反应式可以写为:对于只含有P合金的反应,用的是次亚磷酸盐,其总的反应式可以写为:至于非晶态的形成机理,可以理解为,在化学还原中,成核和长大都是很迅速的,由于制备温度很低,原子没有足够动力,也没有足够时间进行重排,使之适合于晶体的原子排列,因而得到的都是非晶态结构。
化学还原法制备晶态纳米材料Ayyappan等人对银(Ag)和钯(Pd)纳米粒子的制备。
他们将酒精,聚乙烯吡咯烷酮(PVP)和金属盐混合(金属盐与PVP的比率一般为1:5或1:10),在360K 的条件下搅拌12小时。
制作铜(Cu)和金(Au)纳米颗粒的时候需加入镁粉(Mg)作为还原剂Emory和Nie用柠檬酸还原技术制备银纳米粒子。
他们将90mg AgNO3 溶解在500mL水中煮沸,然后加入浓度为1%的柠檬酸钠10mL,混合溶液在沸点保持1h。
所得粒子粒径为35~50 nm。
Liz-Marza将AgNO3,AgClO4的水溶液加到DMF(N,N-二甲基甲酰胺)溶液中,使溶液中的Ag+ 逐渐还原成金属Ag,实验中还加入APS(3氨基丙烷基甲基氧硅烷)作为稳定剂。
用这种方法获得的Ag纳米粒子的粒径随反应温度的升高而增加。
Naoki Toshima 等用类似酒精还原法制备了Pd(钯)-Pt合金纳米粉。
所用的原料为PdCl2,六氯铂酸,酒精和PVP。
在1:1的酒精/水溶液中两种金属的总量为3.3×10-5 mol/L,混合溶液在N2中100℃保温1.5h,就可以得到黑褐色的稳定胶状悬浮液。
悬浮液经过干燥过后就可以得到Pd-Pt合金纳米粉。
Rongchao Jin等用NaBH4还原金属盐+光诱导的方法制备了Ag的纳米棱锥。
将NaBH4溶液(50mmol/L, 1mL)注入到掺有0.3mmol/L的AgNO3水溶液(0.1mmol/L, 100mL)中, 随后滴加硫化苯基苯磷二水钾盐(BSPP)溶液(5mmol/L, 2mL)作为稳定剂。