化学反应原理大题
- 格式:doc
- 大小:431.50 KB
- 文档页数:8

化学反应原理大题1.(12分)氯化亚砜(SOCl2)具有很强的氯化能力和脱水能力,在有机合成中具有重要的应用。
工业上用硫酸厂尾气中的SO2与SCl2、Cl2为原料合成SOCl2,反应如下:Ⅰ. SO2 (g)+Cl2(g)SO2Cl2(g) ΔH = −471.7 kJ·mol−1Ⅱ. SCl2(g)+SO2Cl2 (g)2SOCl2(g) ΔH = −5.6 kJ·mol−1回答下列问题:(1)该条件下,由SO2(g)、Cl2(g)和SCl2(g),制备1 mol SOCl2(g)放出的热量为kJ。
(2)一定条件下,在5 L的恒容密闭容器中通入一定量的SO2、SCl2与Cl2,反应4 min后达到平衡。
若初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示(平衡时温度与初始温度相同)。
容器内各组分物质的量如下表。
①0~容器内压强增大的原因为。
②反应Ⅰ、Ⅱ达平衡时,SCl2的平衡转化率为。
③K为平衡常数,p K=−lg K,该温度下,反应Ⅱ的p K = (保留两位有效数字,lg2 = 0.30)。
(3)常温下,将SO2通入到NaOH溶液中,充分反应后得到a mol·L−1的NaHSO3溶液,该溶液的pH=5,则溶液中c() c(H2SO3)(填“>”“=”或“<”),的电离常数约为(用含a 的式子表示)。
【答案】(1)238.65 (2分)(2)①反应为放热反应,温度升高使体系压强增大(2分,表述合理即可)②20%(2分)③0.30(2分)(3)>(2分)(2分)2.C1 化学是目前研究的热点问题。
(1)己知:2C(s)+O2(g)=2CO(g) △H =a kJ·mol-1 C(s)+H2O(g)=CO(g)+H2(g) △H =+130kJ·mol-1 H-H、O=O、H-O 键的键能分别为436kJ/mol、496kJ/mol、462kJ/mol。

【反应原理】1. 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。
由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应。
甲醇合成反应:(Ⅰ) CO(g)+2H2(g)CH3OH(g) ΔH1= kJ·mol-1(Ⅱ) CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2= kJ·mol-1水煤气变换反应:(Ⅲ) CO(g)+H2O(g)CO2(g)+H2(g) ΔH3= kJ·mol-1二甲醚合成反应:(Ⅳ) 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH4= kJ·mol-1回答下列问题:(1) 分析二甲醚合成反应(Ⅳ)对于CO转化率的影响: 。
?(2) 由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为。
?根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响: 。
?(3) 有研究者在催化剂(含Cu Zn Al O和Al2O3)、压强为 MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。
其中CO转化率随温度升高而降低的原因是。
?(4) 二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池kW·h·kg-1)。
若电解质为酸性,二甲醚直接燃料电池的负极反应式为。
?1 mol二甲醚分子经过电化学氧化,转移电子的物质的量为。
?2. 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1) I2O5可使H2S、CO、HCl等被氧化,常用于定量测定CO的含量。
已知:2I2(s)+5O2(g)2I2O5(s) ΔH= kJ·mol-12CO(g)+O2(g)2CO2(g) ΔH= kJ·mol-1写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2) 一定条件下,NO2与SO2反应生成SO3和NO两种气体。

高中化学《化学反应原理》练习题(附答案解析)学校:___________姓名:___________班级:___________一、单选题1.对于已建立化学平衡的可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是 ( )①生成物的质量分数一定增加; ②生成物的产量一定增加; ③反应物的转化率一定增大; ④反应物浓度一定降低;⑤正反应速率一定大于逆反应速率; ⑥使用了合适的催化剂; A .①②B .②⑤C .③④D .④⑥2.下列说法中,正确的是( ) A .K w 随温度、浓度的改变而改变B .凡是能自发进行的化学反应,一定是△H <0、△S >0C .对已达到化学平衡的反应,改变压强,平衡常数(K )一定改变D .Ksp 只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关3.近年来随着中国科技的崛起,中国电动汽车也随之获得迅猛发展,下列说法错误的是( ) A .电动汽车行驶时电池将化学能转化为电能 B .电动汽车行驶时电池的正极发生氧化反应 C .电动汽车充电时电池将电能转化为化学能 D .电动汽车充电时电池的阴极发生还原反应4.在反应C(s)+CO 2(g)=2CO(g)中,能使反应速率加快的是( ) ①增大压强 ②升高温度 ③将C 粉碎 ④通CO 2气体 ⑤加入足量木炭粉 A .①②③B .①②④C .①②③④D .全部5.下列反应不是吸热反应的是( ) A .2高温C+CO 2COB .()22Ba OH 8H O ⋅与4NH Cl 的反应C .铝热反应D .煅烧石灰石制取生石灰6.下列说法正确的是()A.化学反应速率是对可逆反应而言,非可逆反应无法计量化学反应速率B.在可逆反应中,正反应的反应速率是正值,逆反应的反应速率是负值C.在同一化学反应中,用不同物质来表示反应速率,其数值可能相同D.化学反应速率是单位时间内反应物或生成物物质的量的变化7.下列说法正确的是()A.上图所示的是一个放热反应B.加入催化剂v(正)增大、v(逆)减小C.燃烧热是生成1molH2O放出的热量D.只有活化分子才能发生有效碰撞8.电解饱和食盐水的实验中,在U型管的两端分别滴加无色酚酞试液,通电一会儿的现象为()A.产生黄绿色气泡的电极一端溶液变红B.产生无色气泡的电极一端溶液变红C.两端均变红D.两端均不变红9.在测定中和热的实验中,使用下列用品不是为了减小实验误差的是()A.碎泡沫塑料B.环形玻璃棒C.硬纸板D.两个量筒10.某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图所示),下列说法正确的是()A.该电池可以用水溶液作为电解质溶液B.该电池不能重复使用C.Fe2O3电极在充电时发生还原反应D.负极的电极反应式为2Li-2e-+O2-=Li2O11.下列事实能说明醋酸属于弱电解质的是()①中和10mL1mol/LCH3COOH溶液需要10mL1mol/LNaOH溶液②物质的量溶液相同时,完全相同的两块锌粒分别跟盐酸和醋酸反应,前者的速率快③0.01mol/L醋酸溶液的pH大于2④0.1mol/LCH3COONa溶液显碱性A.①②③B.②③④C.②③D.①④12.在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个恒压的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g)A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡,下列说法中正确的是()A.平均反应速度:甲<乙B.平衡时C的物质的量:甲>乙C.平衡时C的转化率:甲>乙D.平衡时混合气体密度:甲<乙二、填空题13.已知:(1)为了证明HF是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
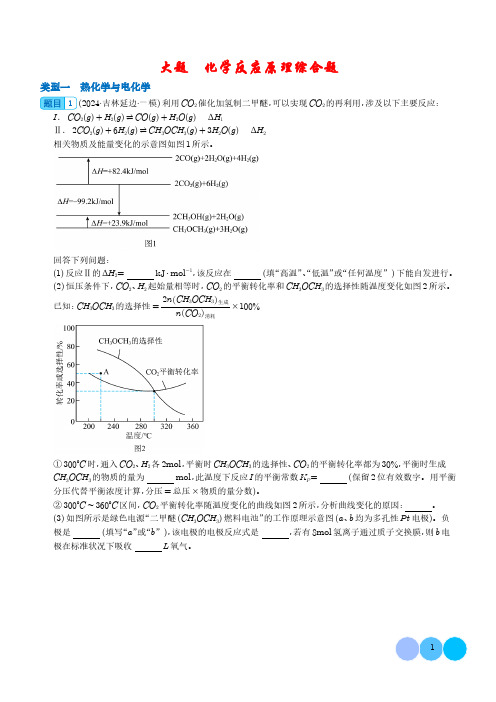
大题 化学反应原理综合题类型一 热化学与电化学1(2024·吉林延边·一模)利用CO 2催化加氢制二甲醚,可以实现CO 2的再利用,涉及以下主要反应:I .CO 2(g )+H 2(g )⇌CO (g )+H 2O (g ) ΔH 1Ⅱ.2CO 2(g )+6H 2(g )⇌CH 3OCH 3(g )+3H 2O (g ) ΔH 2相关物质及能量变化的示意图如图1所示。
回答下列问题:(1)反应Ⅱ的ΔH 2=kJ ⋅mol -1,该反应在(填“高温”、“低温”或“任何温度”)下能自发进行。
(2)恒压条件下,CO 2、H 2起始量相等时,CO 2的平衡转化率和CH 3OCH 3的选择性随温度变化如图2所示。
已知:CH 3OCH 3的选择性=2n CH 3OCH 3 生成n CO 2 消耗×100%①300°C 时,通入CO 2、H 2各2mol ,平衡时CH 3OCH 3的选择性、CO 2的平衡转化率都为30%,平衡时生成CH 3OCH 3的物质的量为mol ,此温度下反应I 的平衡常数K P =(保留2位有效数字。
用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②300°C ∼360°C 区间,CO 2平衡转化率随温度变化的曲线如图2所示,分析曲线变化的原因:。
(3)如图所示是绿色电源“二甲醚(CH 3OCH 3)燃料电池”的工作原理示意图(a 、b 均为多孔性Pt 电极)。
负极是(填写“a ”或“b ”),该电极的电极反应式是,若有8mol 氢离子通过质子交换膜,则b 电极在标准状况下吸收L 氧气。
【答案】(1)-123.1低温(2)0.090.20反应I 为吸热反应,二氧化碳的平衡转化率随温度升高而增大,反应Ⅱ为放热反应,二氧化碳的平衡转化率随温度升高而减小,300℃~360℃区间,反应I 的趋势大于反应Ⅱ(3)aCH 3OCH 3-12e -+3H 2O =2CO 2+12H +44.8【解析】(1)根据图示,2CO 2(g )+6H 2(g )⇌CH 3OCH 3(g )+3H 2O (g ) ΔH 2=(-99.2kJ ⋅mol -1-23.9kJ ⋅mol -1)=-123.1kJ ⋅mol -1;该反应ΔH 2<0、△S <0,在低温下能自发进行。

高考化学化学反应原理(大题培优易错难题)及答案一、化学反应原理1.某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)示意图序号温度试剂A现象①0°C0.5mol∙L−1稀硫酸4min左右出现蓝色②20°C1min左右出现蓝色③20°C0.1mol∙L−1稀硫酸15min左右出现蓝色④20°C蒸馏水30min左右出现蓝色(1)为探究温度对反应速率的影响,实验②中试剂A应为______________。
(2)写出实验③中I-反应的离子方程式:_____________________。
(3)对比实验②③④,可以得出的结论:_______________________。
(继续探究)溶液pH对反应速率的影响查阅资料:i.pH<11.7时,I-能被O2氧化为I2。
ii.pH= 9.28时,I2发生歧化反应:3I2+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用4支试管在装有O2的储气瓶中进行实验,装置如图所示。
序号⑤⑥⑦⑧试管中溶液的pH891011放置10小时后的现象出现蓝色颜色无明显变化分析⑦和⑧中颜色无明显变化的原因_______。
(5)甲同学利用原电池原理设计实验证实pH=10的条件下确实可以发生I-被O2氧化为I2的反应,如图所示,请你填写试剂和实验现象。
试剂1______________。
试剂2______________。
实验现象:___________________________。
(深入探究)较高温度对反应速率的影响小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设1。
假设1:_______________。
假设2:45°C以上I2易升华,70°C水浴时,c(I2)太小难以显现黄色。
(7)针对假设2有两种不同观点。

备战高考化学化学反应原理(大题培优 易错 难题)含详细答案一、化学反应原理1.三草酸合铁酸钾K 3[Fe(C 2O 4)3]·3H 2O 是一种绿色晶体,易溶于水,难溶于乙醇等有机溶剂,光照或受热易分解。
实验室要制备K 3[Fe(C 2O 4)3]·3H 2O 并测定2-24C O 的含量。
请回答下列相关问题。
I .FeC 2O 4·2H 2O 的制备向烧杯中加入5.0g(NH 4)2Fe(SO 4)2·6H 2O 、15mL 蒸馏水、1mL3moL/L 的硫酸,加热溶解后加入25mL 饱和H 2C 2O 4溶液,继续加热并搅拌一段时间后冷却,将所得FeC 2O 4·2H 2O 晶体过滤、洗涤。
(1)制备FeC 2O 4·2H 2O 时,加入3mol /L 硫酸的作用是________________________。
II .K 3[Fe(C 2O 4)3]·3H 2O 的制备向I 中制得的FeC 2O 4·2H 2O 晶体中加入10mL 饱和K 2C 2O 4溶液,水浴加热至40℃,缓慢加入过量3%的H 2O 2溶液并不断搅拌,溶液中产生红褐色沉淀,H 2O 2溶液完全加入后将混合物加热煮沸一段时间,然后滴加饱和H 2C 2O 4溶液使红褐色沉淀溶解。
向溶液中再加入10mL 无水乙醇,过滤、洗涤、干燥。
(2)制备过程中有两个反应会生成K 3[Fe(C 2O 4)3],两个化学方程式依次是:______________________、2Fe(OH)3+3K 2C 2O 4+3H 2C 2O 4=2K 3[Fe(C 2O 4)3]+6H 2O 。
(3)H 2O 2溶液完全加入后将混合物加热煮沸一段时间的目的是______________________。
III .2-24C O 含量的测定称取0.22g Ⅱ中制得的K 3[Fe(C 2O 4)3]·3H 2O 晶体于锥形瓶中,加入50mL 蒸馏水和15mL3mol /L 的硫酸,用0.02000mol /L 的标准KMnO 4溶液滴定,重复3次实验平均消耗的KMnO 4溶液体积为25.00mL 。
备战高考化学化学反应原理(大题培优 易错 难题)含答案解析一、化学反应原理1.三草酸合铁酸钾K 3[Fe(C 2O 4)3]·3H 2O 是一种绿色晶体,易溶于水,难溶于乙醇等有机溶剂,光照或受热易分解。
实验室要制备K 3[Fe(C 2O 4)3]·3H 2O 并测定2-24C O 的含量。
请回答下列相关问题。
I .FeC 2O 4·2H 2O 的制备向烧杯中加入5.0g(NH 4)2Fe(SO 4)2·6H 2O 、15mL 蒸馏水、1mL3moL/L 的硫酸,加热溶解后加入25mL 饱和H 2C 2O 4溶液,继续加热并搅拌一段时间后冷却,将所得FeC 2O 4·2H 2O 晶体过滤、洗涤。
(1)制备FeC 2O 4·2H 2O 时,加入3mol /L 硫酸的作用是________________________。
II .K 3[Fe(C 2O 4)3]·3H 2O 的制备向I 中制得的FeC 2O 4·2H 2O 晶体中加入10mL 饱和K 2C 2O 4溶液,水浴加热至40℃,缓慢加入过量3%的H 2O 2溶液并不断搅拌,溶液中产生红褐色沉淀,H 2O 2溶液完全加入后将混合物加热煮沸一段时间,然后滴加饱和H 2C 2O 4溶液使红褐色沉淀溶解。
向溶液中再加入10mL 无水乙醇,过滤、洗涤、干燥。
(2)制备过程中有两个反应会生成K 3[Fe(C 2O 4)3],两个化学方程式依次是:______________________、2Fe(OH)3+3K 2C 2O 4+3H 2C 2O 4=2K 3[Fe(C 2O 4)3]+6H 2O 。
(3)H 2O 2溶液完全加入后将混合物加热煮沸一段时间的目的是______________________。
III .2-24C O 含量的测定称取0.22g Ⅱ中制得的K 3[Fe(C 2O 4)3]·3H 2O 晶体于锥形瓶中,加入50mL 蒸馏水和15mL3mol /L 的硫酸,用0.02000mol /L 的标准KMnO 4溶液滴定,重复3次实验平均消耗的KMnO 4溶液体积为25.00mL 。
化学反应原理试题及答案一、选择题(每题2分,共10分)1. 下列反应中,属于氧化还原反应的是:A. NaCl + AgNO3 → AgCl↓ + NaNO3B. 2H2O → 2H2↑ + O2↑C. 2Na + Cl2 → 2NaClD. 2H2O + CO2 → H2CO3答案:C2. 在标准状态下,1摩尔气体的体积是:A. 22.4 LB. 22.4 mLC. 224 LD. 224 mL答案:A3. 下列物质中,不属于电解质的是:A. HClB. NaOHC. H2OD. H2SO4答案:C4. 根据勒夏特列原理,当一个处于平衡状态的化学反应系统受到外部条件的改变时,系统会如何反应?A. 向减弱这种改变的方向移动B. 向增强这种改变的方向移动C. 不会发生变化D. 无法确定答案:A5. 反应速率是指:A. 反应物的浓度B. 反应物的质量C. 单位时间内反应物浓度的变化量D. 反应物的摩尔数答案:C二、填空题(每题2分,共10分)1. 一个化学反应的活化能是指反应物分子必须达到的最低能量,才能发生__________。
答案:有效碰撞2. 根据热力学第一定律,能量守恒,化学反应中的能量变化可以表示为:ΔH = __________ + ΔU。
答案:ΔQ3. 催化剂在化学反应中的作用是__________。
答案:降低活化能4. 反应物的浓度越大,反应速率__________。
答案:越快5. 酸碱中和反应的实质是__________。
答案:氢离子与氢氧根离子结合生成水三、简答题(每题10分,共20分)1. 简述什么是化学平衡,并举例说明。
答案:化学平衡是指在一个封闭系统中,正逆反应速率相等,反应物和生成物的浓度不再随时间变化的状态。
例如,N2(g) + 3H2(g) ⇌2NH3(g),在一定条件下,氮气和氢气生成氨气的速率与氨气分解的速率相等,此时系统达到化学平衡。
2. 描述影响化学反应速率的因素有哪些?答案:影响化学反应速率的因素包括:温度、压力、催化剂、反应物的浓度、反应物的接触面积、反应物的物理状态等。
化学反应原理大题训练1.丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
回答下列问题:(1)正丁烷(C4H10)脱氢制1﹣丁烯(C4H8)的热化学方程式如下:①C4H10(g)=C4H8(g)+H2(g)△H1已知:②C4H10(g)+O2(g)=C4H8(g)+H2O(g)△H2=﹣119kJ•mol﹣1③H2(g)+O2(g)=H2O(g)△H3 =﹣242kJ•mol﹣1反应①的△H1为kJ•mol﹣1.图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高应采取的措施是(填标号)。
A.升高温度B.降低温度C.增大压强D.降低压强(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。
图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。
图中曲线呈现先升高后降低的变化趋势,其降低的原因是。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。
丁烯产率在590℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是。
2.丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等.回答下列问题:(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:①C3H6(g)+NH3(g)+O2(g)═C3H3N(g)+3H2O(g)△H=﹣515kJ•mol﹣1②C3H6(g)+O2(g)═C3H4O(g)+H2O(g)△H=﹣353kJ•mol﹣1两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯腈平衡产率的反应条件是;提高丙烯腈反应选择性的关键因素是.(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃.低于460℃时,丙烯腈的产率(填“是”或“不是”)对应温度下的平衡转化率,判断理由是;高于460℃时,丙烯腈产率降低的可能原因是(双选,填标号).A.催化剂活性降低B.平衡常数变大C.副反应增多D.反应活化能增大(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为,理由是.进料气氨、空气、丙烯的理论体积比约为.3.联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:(1)联氨分子的电子式为,其中氮的化合价为.(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为.(3)①2O2(g)+N2(g)═N2O4(l)△H1②N2(g)+2H2(g)═N2H4(l)△H2③O2(g)+2H2(g)═2H2O(g)△H3④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1上述反应热效应之间的关系式为△H4=,联氨和N2O4可作为火箭推进剂的主要原因为.(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为(已知:N2H4+H+⇌N2H5+的K=8.7×107;K w=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为.(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是.联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是.4.甲醇既是重要的化工原料,又可作为燃料。
2020-2021高考化学化学反应原理(大题培优)及答案解析一、化学反应原理1.某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10 mL 2 mol·L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应。
序号甲试管里发生反应的物质U形管里红墨水液面①氧化钙与水左低右高②氢氧化钡晶体与氯化铵晶体(充分搅拌)?③铝片与烧碱溶液左低右高④铜与浓硝酸左低右高根据上述实验回答相关问题:(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写出该反应的离子方程式:___________。
(2)方案一中,温度升至最大值后又下降的原因是___________。
(3)方案二中,小木片脱落的原因是________,由此得出的结论是__________________。
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边________(填“高于”“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是______________。
(6)方案三实验②的U形管中的现象为________,说明反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量【答案】放热 2Al+6H+===2Al3++3H2↑反应完全后,热量向空气中传递,烧杯里物质的温度降低蜡烛熔化氢氧化钠与硫酸的反应放热低于放热红墨水液面左右相平红墨水液面左高右低小于【解析】【分析】【详解】(1)金属与酸的反应是放热反应,因此铝片与稀硫酸的反应是放热反应,该反应的离子方程式为2Al+6H+===2Al3++3H2↑,故答案为放热;2Al+6H+===2Al3++3H2↑;(2)方案一中,温度升至最大值后又下降的原因可能是反应完全后,热量向空气中传递,烧杯里物质的温度降低,故答案为反应完全后,热量向空气中传递,烧杯里物质的温度降低;(3)方案二中,反应放出的热量,使得蜡烛熔化,小木片脱落,故答案为蜡烛熔化;氢氧化钠与硫酸的反应放热;(4)方案三中,如果甲试管里发生的反应是放热反应,装置中气体的压强增大,U形管里红墨水液面:左边低于右边,故答案为低于;(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热反应,如果放置较长时间,热量散失,装置中气体的压强与外界压强相等, U形管中红墨水液面左右相平,故答案为放热;红墨水液面左右相平;(6)方案三实验②属于吸热反应,U形管中红墨水液面左高右低,故答案为红墨水液面左高右低;小于。
化学反应原理大题练习1.(16分)苯乙烯(C 6H 5CH =CH 2)是生产各种塑料的重要单体,其制备原理是:C 6H 5C 2H 5(g)C 6H 5CH =CH 2(g)+H 2 (g) △H =+125kJ·mol -1(1)该反应的平衡常数表达式为K = __ _____________ 。
随着温度的升高,K 值________(填“增大”、“减小”或“不变”,下同)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。
C 6H 5C 2H 5的平衡转化率与水蒸气的用量、体系总压强关系如下图。
①由上图可得出: 结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______;结论二:__________________________________________________。
②加入稀释剂能影响C 6H 5C 2H 5平衡转化率的原因是:_______________________。
(3)某些工艺中,在反应的中途加入O 2和特定的催化剂,有利于提高C 6H 5C 2H 5的平衡转化率。
试解释其原因:_______________________________________________。
2.(16分)科学研究发现纳米级的Cu 2O 可作为太阳光分解水的催化剂。
Ⅰ.四种制取Cu 2O 的方法(a )用炭粉在高温条件下还原CuO 制备Cu 2O ;(b )用葡萄糖还原 悬浊液制备Cu 2O ;(c )电解法制备Cu 2O 。
原理如右图所示,反应为:2Cu+H 2O=Cu 2O+H 2↑,则铜作为极;(d )最新实验研究加热条件下用液态肼(N 2H 4)还原新制Cu(OH)2可制备纳米级Cu 2O ,同时放出N 2和水蒸气。
该制法的化学方程式为 。
Ⅱ.用制得的Cu 2O 进行催化分解水的实验平衡转化率/% 101kPa (900K ) 4060 80 202kPa (900K )n (H 2O) n (C 6H 5C 2H 5)(1)一定温度下,在2 L 密闭容器中加入纳米级Cu 2O 并通入10. 0 mol 水蒸气,发生反应: 2H 2O(g)2H 2(g)+O 2(g) △H =+484 kJ·mol -1 T 1温度下不同时段产生O 2的量见下表: 时间/min 20 40 60 80 n (O 2)/mol 1.0 1.6 2.0 2.0前20 min 的反应速率 v (H 2O)= ;该该温度下,反应的平衡常数的表达式K = ;若T 2温度下K =0.4,T 1 T 2(填>、<、=)(2)用以上四种方法制得的Cu 2O 在某相同条件下分别对四份 相同质量的水催化分解,产生的氢气经干燥装置并用针筒收集;V (H 2)随时间t 变化如右图所示。
下列叙述正确的是 (双选题)。
A .d 方法制得的Cu 2O 能使水剧烈分解并放出热量B .d 方法制得的Cu 2O 颗粒最小,表面活性大,所以催化效果明显。
C . c 、d 产生的氢气总体积不同可能和水的蒸发有关D . d 方法制得的Cu 2O 作催化剂时,水的平衡转化率最高3.(16分)高铁酸钾(K 2FeO 4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO 42-与水反应的方程式:4FeO 42-+10H 2O4Fe(OH)3+8OH -+_____。
K 2FeO 4在处理水的过程中所起的作用是 和 。
(2)将适量K 2FeO 4配制成c (FeO 42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、 40℃和60℃的恒温水浴中,测定c (FeO 42-)的变化,结果见图Ⅰ。
第(1)题中的反应为FeO 42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO 42-在水溶液中的存在形态如图Ⅱ所示。
下列说法正确的是 (填字母)。
A .不论溶液酸碱性如何变化,铁元素都有4种存在形态B .向pH =2的这种溶液中加KOH 溶液至pH =10,HFeO 4-的分布分数先增大后减小C .向pH =8的这种溶液中加KOH 溶液,发生反应的离子方程式为:0 20 40 60 80 100 t /min V (H 2) dc b a Cu 2O光照图Ⅰ H 3FeO 4+ HFeO 4- H 2FeO 4 FeO 42- 图Ⅱ c (F e O 42-)/m m o l ·L -1t /min 分布分数pHH2FeO4+OH-=HFeO4-+H2O(4)H 2FeO4H++HFeO4-的电离平衡常数表达式为K=___________________4.(16分)请回答下列化学平衡的有关问题:(1)现代工业将煤汽化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的用途。
①已知:2C(s)+O2(g)=2CO(g);ΔH1 , 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g) CO(g)+H2(g);ΔH=。
(用含ΔH1、ΔH2的代数式表示)②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH3。
现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
a. 该反应的ΔH30(选填“<”、“>”或“=”,下同),K1K2。
b. 将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有。
(2)某燃料电池以熔融态K2CO3为电解质,一极通入CO,另一极通入空气和CO2的混合气体。
已知该燃料电池正极反应为2CO2+O2+4e-=2CO32—;则其负极的电极反应式为。
(3)煤汽化后的煤渣可提炼重金属。
右图为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH ,金属阳离子浓度变化情况。
据图分析:该温度下,溶度积常数的关系为:Ksp [ Fe(OH)3]____Ksp [Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe 3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是。
5.(16分)固定和利用CO 2能有效地利用资源,并减少空气中的温室气体。
工业上有一种用CO 2来生产甲醇燃料的方法:CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g) △H =-49.0 kJ·mol -1某科学实验将6molCO 2和8molH 2充入2L 的密闭容器中,测得H 2的物质的量随时间变化如下图所示(实线)。
(1)a 点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________,最小的是__________。
A .0~1minB .1~3minC .3~8minD .8~11min(3)求平衡时氢气的转化率和该条件下反应的平衡常数K 。
(写出计算过程)(4)仅改变某一实验条件再进行两次实验,测得H 2的物质的量随时间变化如图中虚线所示,曲线I 对应的实验条件改变是___________,曲线II 对应的实验条件改变是___________。
6.(16分)能源在国民经济中具有特别重要的战略地位。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:反应a :CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g) ΔH 1反应b :CO(g)+2H 2(g)CH 3OH(g) ΔH 2①上述反应符合“原子经济”原则的是 (填“a”或“b”)。
②下表所列数据是反应b 在不同温度下的化学平衡常数(K )I .由表中数据判断ΔH 2 0(填“>”、“<”或“=”);Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 。
温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012n (H 2)/m o l 10 12 02 468a (1,6) ●b (3,3)● (8,2) ● c d ● (11,2)I IIA.升高温度B.将CH3OH(g)从体系中分离C.使用合适的催化剂D.充入He,使体系总压强增大(2)环境问题已成为社会关注的焦点。
某农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。
当处理后的废水中c(Ca2+)=2×10-7mol/L时,试计算溶液中c(PO43-)(写出计算过程,已知K sp[Ca3(PO4)2]=2×10-33)②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应式为Mg2+(aq) + NH 4+(aq) + PO43-(aq)MgNH4PO4(s),该方法中需要控制污水的pH 为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低。
其原因可能为。
7.(16分)1.联氨(N2H4)及其衍生物是一类重要的火箭燃料。
N2H4与N2O4反应能放出大量的热。
已知:2NO2(g)=====N2O4(g)△H=-57.20kJ·mol-1。
一定温度下,在密闭容器中反应2NO2(g)N2O4(g)达到平衡。
(1)其他条件不变时,下列措施能提高NO2转化率的是(填字母)A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ 的热量。
则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-12.现有五种浓度均为0.1mol/L的电解质溶液:①Na2CO3、②NaHCO3、③NaAlO2、④CH3COONa、⑤NaOH。
以上五种溶液pH由大到小的顺序依次为(填序号)。
(3)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:5Ca2++3PO43-+OH-进食后,细菌和酶作用于食Ca5(PO4)3OH(S)物,产生有机酸,这时牙齿就会受到腐蚀,其原因是。
已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小、质地更坚固。
用离子方程表示当牙膏中配有氟化物添加剂后能防止龋齿的原因。
8.(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。