发酵种子制备与发酵机制
- 格式:pps
- 大小:569.06 KB
- 文档页数:86


第五章发酵工业的种子制备内容提要•种子制备原理和技术•影响种子质量的因素•种子质量的控制措施•工业微生物培养的类型一、种子扩大培养1、种子扩大培养的任务工业生产规模的增大需要种子就增多种子的扩大培养种子扩大培养的任务,不但要得到纯而壮的培养物,还要获得活力旺盛的、性能稳定、接种数量足够的、纯的培养物。
2、菌种扩大培养的目的为发酵罐的投料提供足够数量的代谢旺盛的种子。
因为发酵时间的长短和接种量的大小有关,接种量大,发酵时间则短。
将较多数量的成熟菌体接入发酵罐中,就有利于缩短发酵时间,提高发酵罐的利用率,并且也有利于减少染菌的机会。
对于不同产品的发酵过程来说,必须根据菌种生长繁殖速度快慢及生产的规模决定种子扩大培养的级数。
对于不同产品的发酵过程来说,必须根据菌种生长繁殖速度快慢来决定种子扩大培养级数。
抗生素生产中,放线菌的细胞生长繁殖速度较慢,常常用三级种子扩大培养,即将种子罐中之菌丝移植到较大的种子罐中扩大培养后,再移入发酵罐中,这种流程称为三级种子四级发酵一般50t发酵罐多采用三级发酵,有的甚至采用四级发酵,如链霉素生产。
有些酶制剂发酵生产也采用三级发酵。
而谷氨酸及其他氨基酸发酵所用的菌种是细菌,生长繁殖速方式很快,所以采用二级发酵。
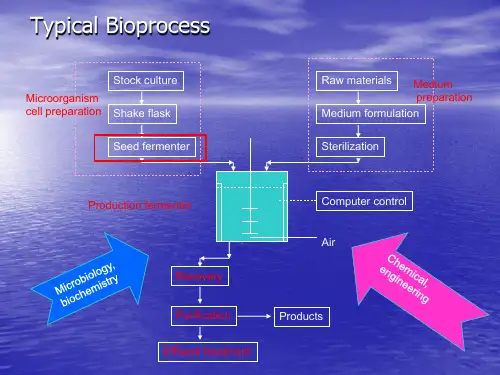
一级种子二级发酵的流程如下:斜面菌种→一级种子摇床培养→二级种子罐培养→发酵罐二、种子制备原理与技术种子培养:指冷冻干燥管、沙土管中处于休眠状态的工业菌种,接入试管斜面活化后,再经过摇瓶及种子罐逐级扩大培养,而获得一定数量和质量的纯种的过程。
其中的纯培养物就称为种子。
不同的发酵产品和菌种,种子制备的方法与条件不同。
要根据目的菌种的生理特性,选择合适的培养条件来获得优良的种子。
1、优良种子应具备的条件①、菌种细胞的生长活力强,转移至发酵罐后能迅速生长,延迟期短;②、菌种生理状态稳定(如菌丝生长速率、种子培养液的特性等);③、菌体浓度及总量能满足大容量发酵罐接种量的要求;④、无杂菌污染,保证纯种发酵;⑤、菌种适应性强,能保持稳定的生产能力。



发酵种子培养实验报告一、实验目的通过培养和发酵种子,探究发酵过程中微生物生长的特点,以及不同条件对发酵效果的影响。
二、实验原理发酵是一种通过微生物代谢作用产生有用产物的过程。
在发酵过程中,微生物以发酵物质作为碳源进行能量代谢,产生气体、乳酸、醇类等有机物。
种子培养是通过选用优良的菌种,将其在特定的培养基上培养,使其繁殖和生长。
三、实验仪器和试剂- 试验仪器:恒温培养箱,pH计,发酵罐等。
- 试剂:培养基,发酵物质。
四、实验步骤1. 制备培养基:根据实验需求,制备适当的培养基。
选择适合菌种生长的基础培养基,并添加适量的碳、氮、无机盐等。
2. 选取菌种:根据实验需求,选择合适的菌种。
在无菌条件下,将菌种接入试管中,进行预培养。
3. 制备发酵罐:将发酵罐清洗消毒,并装入培养基。
调节pH值,使其适合菌种生长。
4. 注入种子:将预培养的菌种接种到发酵罐中。
注意无菌操作,避免杂菌污染。
6. 发酵条件控制:放入恒温培养箱中,控制温度和湿度恒定。
同时,根据实验需求,对培养环境中的氧气浓度、搅拌速度等进行调节和控制。
7. 采样观察:定期取出发酵液进行采样观察,记录菌种的生长情况,以及发酵产物的变化。
8. 结果分析:根据实验数据,对发酵过程中微生物生长特点进行分析,探究不同条件对发酵效果的影响。
五、实验结果与讨论通过对发酵种子的培养实验,我们观察到以下现象:1. 生长曲线:在发酵开始后的一段时间内,菌种的生长逐渐处于对数生长阶段,此时细胞数量呈指数增长。
随着时间的推移,细胞数量达到一定阈值后,生长速率逐渐减慢,维持在稳态生长阶段。
2. 生理代谢变化:在发酵过程中,菌种的代谢产物会发生相应的变化。
例如,酵母菌的发酵过程中会产生乙醇和二氧化碳,乳酸菌的发酵过程中会产生乳酸。
通过对代谢产物的检测,可以了解发酵过程的进行情况。
3. 发酵条件的影响:发酵过程中,温度、湿度、氧气浓度、搅拌速度等条件对发酵结果有重要影响。
适宜的温度、湿度可以提供较好的生长环境,有利于微生物的生长繁殖。


本章内容:⏹种子制备原理与技术⏹影响种子质量的因素⏹种子质量的控制措施⏹种子制备的放大原理与技术概念:种子的制备,即菌种的扩大培养就是把保藏的菌种,即砂土管,冷冻干燥管中处于休眠状态的生产菌种接入试管斜面活化,再经过扁瓶或摇瓶和种子罐,逐级扩大培养后达到一定的数量和质量的纯种培养过程。
这些纯种的培养物称为种子。
种子扩培的目的❑接种量的需要❑菌种的驯化❑缩短发酵时间、保证生产水平优良种子应具备的条件/种子的要求:生长活力强,延迟期短;(接种后在发酵罐中能迅速生长)生理状态稳定;浓度及总量能满足大容量发酵罐接种量的要求; 无杂菌污染,保证纯种发酵;适应性强,生产能力稳定种子制备原理与技术:一.发酵级数的确定种子扩大的级数:制备种子需逐级扩大培养的次数级数愈少,愈利于简化工艺及控制,并可减少种子罐污染杂菌的机会,减少消毒及值班工作量,减少因种子罐生长异常而造成的发酵波动。
一般由菌丝体培养开始计算发酵级数,但有时,工厂从第一级种子罐开始计算发酵级数谷氨酸:三级发酵(谷氨酸棒杆菌)一级种子(摇瓶)→二级种子(小罐)→发酵青霉素:三级发酵一级种子(小罐)→二级种子(中罐)→发酵发酵级数确定的依据❑级数受发酵规模、菌体生长特性、接种量的影响❑级数大,难控制、易染菌、易变异,管理困难,一般2-4级。
❑在发酵产品的放大中,反应级数的确定是非常重要的一个方面发酵级数确定方法菌种的性质(如菌种传代后的稳定性)瓶中的孢子数,孢子发芽及菌丝繁殖速度发酵罐中种子培养液的最低接种量种子罐与发酵罐的容积比生产规模随工艺条件的改变作适当的调整二.种子质量的判断方法通常检测的培养液中参数pH是否在种子要求的范围之内糖、氨基氮、磷酸盐的含量菌丝形态、菌丝浓度和培养液外观有无杂菌污染其他参数,如接种前酶活、种子罐的溶氧和尾气等种子制备步骤:斜面培养基中活化;扁瓶固体培养基或摇瓶培养基中扩大培养,完成实验室种子制备一级种子罐,制备生产用种子;视情况确定扩大级数,完成生产车间种子制备;种子转种至发酵罐三.种子制备过程实验室种子制备阶段:琼脂斜面至固体培养基扩大培养(如茄子瓶斜面培养等或液体摇瓶培养生产车间种子制备阶段:种子罐扩大培养种子制备过程概览实验室阶段:不用种子罐,所用的设备为培养箱、摇床等实验室常见设备,在工厂这些培养过程一般都在菌种室完成,因此现象地将这些培养过程称为实验室阶段的种子培养。


发酵工程实验五一级种子的制备《发酵工程实验》实验五、一级种子的制备一、实验目的1、了解发酵工业菌种的制备过程及质量控制。
2、熟悉发酵实验的一级菌种制备。
二、实验原理菌种制备的主要手段是扩培,其出发点是尽可能培养出高活性的、能满足大规模发酵需要的纯种。
由于现代生产菌种的生产性能已非常高,因此,菌种在培养过程中自发突变往往以负向突变为主,加上平时操作中可能有污染,导致发酵菌种容易退化。
因此,菌种的管理主要有两点:分离纯化和扩大培养。
前者目的为分离出单细胞菌落,保证菌种的性能稳定。
后者目的是为发酵生产提供充足的高活性菌种,分斜面菌种、一级菌种和二级菌种。
在进行各级菌种的扩培时,菌种的质量要达到发酵要求。
比较简单的做法是用显微镜观察细胞的形态是否正常、测定种子培养基的pH 值是否正常及细胞生长繁殖活力等。
三、实验器材与试剂1、菌种实验二中筛选到的-淀粉酶产生菌(酵母)。
2、培养基(W/V)(1)斜面培养基(已制备)(2)摇瓶种子培养基:蔗糖20g/L,蛋白胨5.0g/L,磷酸氢二钠4.0g/L,硫酸镁0.5g/L,磷酸二氢钾1.0g/L,pH为5.0-5.5。
250ml 三角瓶中装培养基50ml,8层纱布封口,0.1MPa 灭菌20min(现用现配)。
四、实验步骤1、斜面接种挑取保藏菌种接种到斜面培养基上,28℃培养24h。
仔细观察斜面菌苔生长情况(菌苔的颜色、边缘等特征是否正常),有无感染杂菌。
2、镜检在无菌条件下,挑取斜面菌苔少许,在载玻片上制成涂片,在显微镜下检查菌苔形态特征,大小、均匀情况。
3、摇瓶培养挑取经镜检确定后的活化斜面菌苔3-5环,接入上述液体培养基中,28℃恒温摇床培养(180rpm),培养12h。
观察摇瓶菌液外观稠度、静置沉降情况。
镜检菌液中菌体细胞的形态是否正常(大小均匀程度等)及测定培养液中pH。
五、注意事项1、出现污染征象的斜面培养活化菌苔坚决不能使用。
2、菌种的污染,势必导致发酵的失败,轻者产量降低,严重的不积累产物。
