XX人民医院伦理委员会免除知情同意书审查工作表
- 格式:doc
- 大小:42.50 KB
- 文档页数:2


医学伦理委员会(年度/定期)跟踪审查工作表
项目名称:
主要研究者:
一、修正方案审查
1.方案修正是否影响研究的风险/收益比
□是□否
2.方案修正是否改变研究对受试者的受益
□是□否
3. 方案修正是否涉及弱势群体
□是□否
4.方案修正是否改变受试者参加研究的持续时间或花费
□是□否
二、年度或定期跟踪审查
1.研究实施情况
□在研□暂停□全部完成
2.研究中是否出现不良事件
□是□否
3.研究中是否出现非预期不良事件
□是□否
4.其他研究报告中是否出现影响本研究风险/受益比的新事件
□是□否
5.研究中出现其他影响受试者安全的问题
□是:
□受试者因安全问题退出研究,例数:
□研究者不依从/违反方案的事件影响受试者安全,例数:□否
6.上述事件对本研究风险/收益比的影响:
□没有影响
□有影响,具体说明:
审查方式及意见:
□医学伦理委员会会议审查
□同意继续进行研究
□作必要的修正后继续研究
□终止或暂停批准的研究
□加快审查
□批准
□不批准(提交医学伦理委员会会议审查)
□免除审查
具体修改建议及说明:
主要审查者签名:日期:。
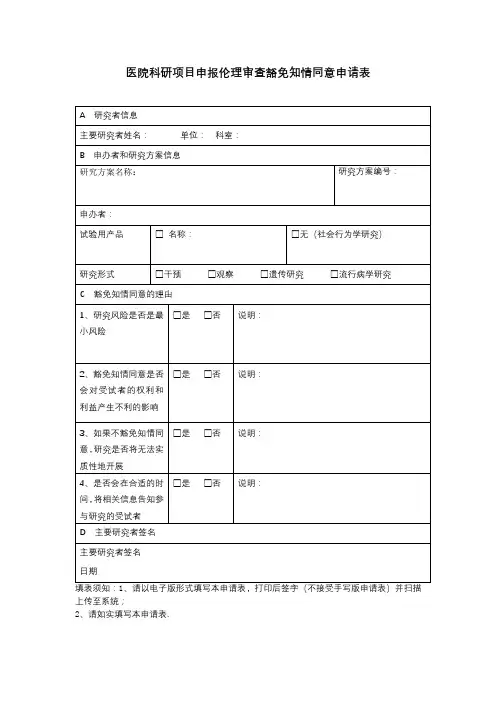

免除知情同意伦理审核申请表
项目名称:
项目来源
申请科室项目负责人
职称联系电话
紧急联系人紧急联系电话
拟研究样本/信息的来源:
研究风险:
拟研究时间:年月日至年月日
申请免除理由:
本人承诺,切实保护受试者的隐私,不将受试者个人信息向第三方透露。
泄露患者隐私或未经授权公开其病历资料,造成患者损害的,应当承担侵权责任。
申请人签名:________________
年月日
备注:以下情形经伦理委员会审查批准后,可以免除签署知情同意书:1、利用可识别身份信息的人体材料或者数据进行研究,已无法找到该受试者,且研究项目不涉及个人隐私和商业利益的;2、生物样本捐献者已经签署了知情同意书,同意所捐献样本及相关信息可用于所有医学研究的。

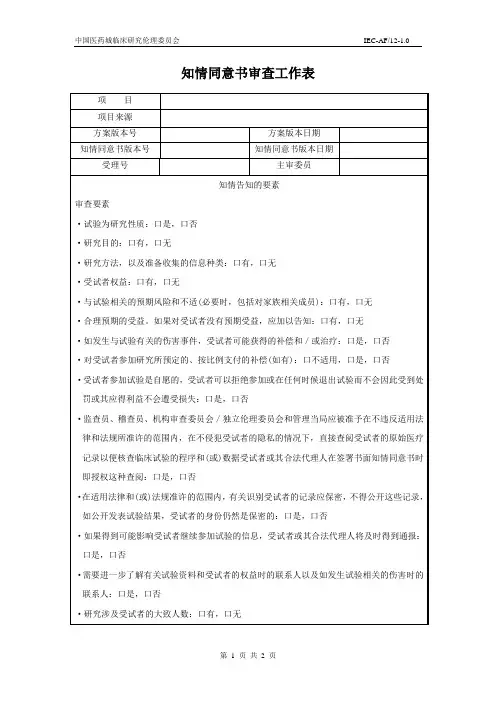

上海市XX人民医院科研项目伦理审查申请表
填表须知:1、请将本申请表各栏(除流水号)填写完整,如没有相关内容,请填写“无”;
2、请以电子版形式填写本申请表,打印后签字(一般不接受手写版申请表);
3、请如实填写本申请表;
4、本申请表的“申请日期”即为方案递交日期,须在申请当日递交方案,如有特
殊情况,一般方案递交日期不超过申请日期两个工作日;
5、请根据本申请表所附的“研究方案目录”填写所递交方案的目录,目录所列内
容须与递交材料一致,目录将作为批件所附“伦理审查文件”的参考依据。
附:递交目录
□ 1、临床试验方案(申请书、任务书)
□ 2、知情同意书
□ 3、主要研究者履历
□ 4、其他(如受试者招募广告等)。

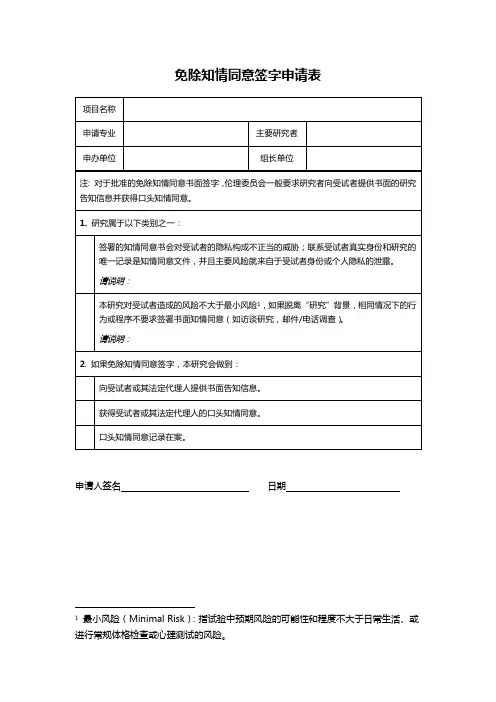
免除审查申请表
1研究:是指系统性的调查,其目的是为了发现或促进发展可普遍化知识。
研究包括研究开发(例如先导性研究)、测试、评价,以及一些验证和服务项目。
本定义有三个要素:1)“系统性调查”——不是偶然或随机的观察。
2)“发现或促进发展的目的”——有目的的事件;无计划、无目的单纯数据采集不符合本定义,但是,无计划、无目的方式采集的数据将来可能被用于研究。
3)“可普遍化知识”——可以作为普遍活的基础。
系统地分析很多案例,旨在发现支持同一理论的共同因素或原则,就是研究。
2人体受试者:研究者在活的人体开展研究,通过对其进行干预或互动来收集数据或个人信息,这些活的人体就是人体受试者。
死亡个体不被看作人体受试者,但是如果死者的信息提示或揭示了其尚存的亲属私人信息,后者就可能是人体受试者。
从个体身上获得的与其本人无关的信息的研究,不涉及“人体受试者”。
主要研究者签名日期
审查记录
□同意免除审查
请说明免除审查的类别:
□研究符合伦理要求,研究风险已经最小化,公平选择受试者,知情同意过程符合要求,受试者隐私与数据保密措施合适。
□不能免除审查
□属于免除审查范畴,但伦理委员会需要保留审查权利
□暂时不能确定是否免除审查(研究内容尚未明确,提请注意:一旦研究确定涉及人体受试者,必须及时咨询伦理委员会。
)
审查委员签名日期。
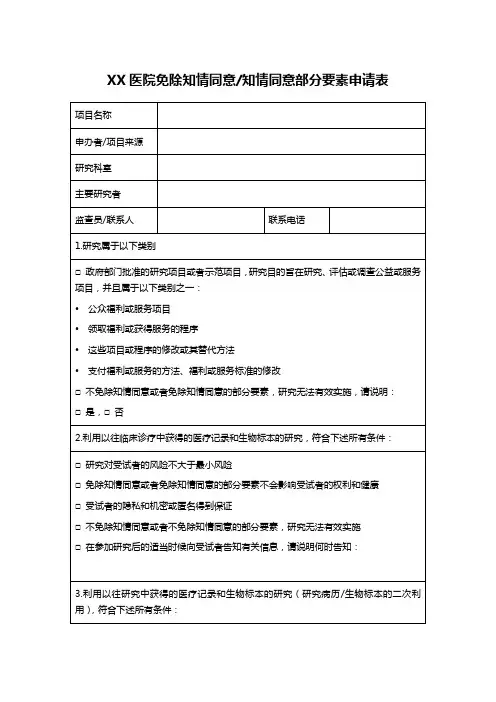
医学伦理委员会免除审查申请表
在正常的教育、培训环境下开展的研究,如:
对常规和特殊教学方法的研究:□是,□否
关于教学方法、课程或课堂管理的效果研究,或对不同的教学方法、课程管理进行对比研究:□是,□否
涉及教育、培训测试(认知、判断、态度、成效)、访谈调查、或公共行为观察的研究:□是,□否
对于既往存档的病历资料、数据、文件、记录、病理标本或诊断标本的收集或研究,或者是以研究者无法联系受试者的方式(直接联系或通过标识符)记录信息的:□是,□否食品口味和质量评价以及消费者接受性研究:
研究用健康食品不含添加剂:□是,□否
研究用食品所含食品添加剂在安全范围,且不超过国家有关部门标准,或化学农药或环境污染物含量不超出国家有关部门的安全范围:□是,□否。
编号:SHSY-IEC-BG/04.03/04.0
免除知情同意书审查工作表
一、利用以往临床诊疗中获得的病历/生物标本的研究,申请免除知情同意
适用性判断
➢本项研究为:利用以往临床诊疗中获得的病历/生物标本的观察性研究:口是,口否
审查要素
1.研究目的是重要的:口是,口否
2.研究对受试者的风险不大于最小风险:口是,口否
3.免除知情同意不会对受试者的权利和健康产生不利的影响:口是,口否
4.受试者的隐私和个人身份信息得到保护:口是,口否
5.若规定需获取知情同意,研究将无法进行(病人有权知道其病历/标本可能用于研究,其拒绝或不同意
参加研究,不是研究无法实施、免除知情同意的证据):口是,口否
6.本研究不利用病人/受试者以前已明确地拒绝利用的医疗记录和标本:口是,口否
二、研究病历/生物标本的二次利用,申请免除知情同意
适用性判断
➢本项研究为:研究病历与生物标本的二次利用,即利用以往研究项目、经知情同意收集的病历或标本进行研究,申请免除知情同意:口是,口否
审查要素
1.以往研究已获得受试者的书面同意,允许其它的研究项目使用其病历或标本:口是,口否
2.本次研究符合原知情同意的许可条件:口是,口否
3.受试者的隐私和身份信息的保密得到保证:口是,口否。