2.浓硫酸的三大特性 (1)吸水性 吸水性是指浓硫酸能够吸收空气或其他物质中的水分。这里的“水”可以 是结晶水合物中的结晶水,也可以是混合气体中的水蒸气,所以浓硫酸可作 为干燥剂。 (2)脱水性 脱水性是指夺取某些有机物中的氢、氧元素形成水分子。所以浓硫酸对 有机物有强烈的腐蚀作用,可使有机物脱水炭化。
CO2↑+2SO2↑+2H2O,反应中浓硫酸体现的性质为
④能与其他还原性物质反应,如H2S、HI等。
【微思考2】浓硫酸脱去了CuSO4·5H2O中的结晶水,体现了浓硫酸的什么 性质? 提示 吸水性。
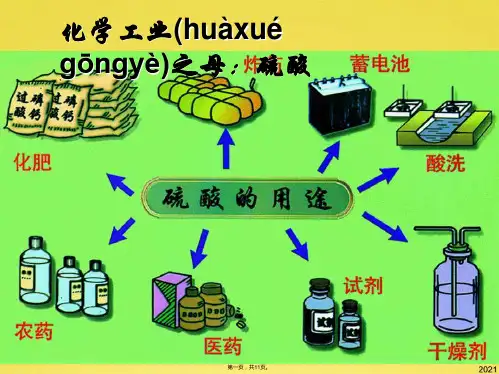
3.硫酸的用途 (1)制磷肥、氮肥等肥料,也可用于除锈,还可制实验价值较大的硫酸盐等。 (2)利用其吸水性,在实验室浓硫酸常用作干燥剂。 (3)利用浓硫酸的高沸点、难挥发性,常用于制取各种挥发性酸,如HCl气体。 (4)利用其脱水性,常用作脱水剂。
的评价:
。
答案 (1)比较浓硫酸和水吸收三氧化硫的效果
4FeS2+11O2
2Fe2O3+8SO2
(2)干燥二氧化硫和氧气(或使SO2和O2充分混合或调节气体的流速)
(3)甲装置中,通氧气气体的导管口产生气泡的速率大约是通二氧化硫导管
口的2倍 BC
(4)缺少尾气吸收装置等(合理答案均可)
解析 (1)该实验的目的是比较浓硫酸和水吸收三氧化硫的效果,工业制硫
例的实验现象是
;
实验时发现,丁装置在反应过程中先出现气泡,不久就出现了白雾,而丙装置一直
都没有任何现象。
据此得出的下列结论中正确的是
。
A.浓硫酸不能吸收产生的气体
B.水与三氧化硫的反应是放热反应
C.浓硫酸吸收的效果比水好
D.水的吸收效果比浓硫酸好