电解与极化作用-学生
- 格式:doc
- 大小:166.50 KB
- 文档页数:3


第十章 电解与极化作用【复习题】【1】什么叫分解电压?它在数值上与理论分解电压(即原电池的可逆电动势)有何不同?实际操作时用的分解电压要克服哪几种阻力?【答】 分解电压就是能使某电解质溶液连续不断地发生发生明显电解时所必须的最小外加电压。
实际上,分解电压要大于原电池的可逆电动势E 可逆。
E (实际分解)=E (理论分解)+η(阳)+η(阴)+IR 。
所以在实际操作时不仅要克服理论分解电压,还要克服极化和电阻引起的电势降等阻力,其中主要是由于电极的极化作用所致。
【2】产生极化作用的原因主要有哪几种?原电池和电解池的极化现象有何不同? 【答】极化作用的类型有很多,主要有浓差极化和化学极化等。
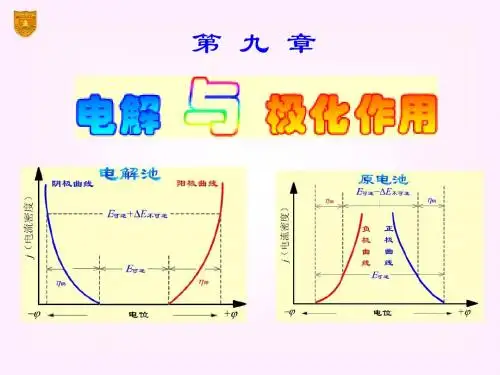
对于原电池,随着电流密度的增大,由于极化作用,负极的电极电势比可逆电势越来越大,正极的电极电势比可逆电势越来越小,两条曲线有相互靠近的趋势,原电池的电动势逐渐减小。
对于电解池,随着电流密度的增大,由于极化作用,阴极的电极电势比可逆电势越来越负,阳极的电极电势比可逆电势越来越正,两条曲线有相互远离的趋势,电解池的外加电压逐渐增大。
【3】什么叫超电势?它是怎么产生的?如何降低超电势的数值?【答】 在有电流通过电极时,电极电势偏离于平衡值的现象称为电极的极化,为了明确地表示出电极极化的状况,常把某一电流密度下的电势ψ不可逆与ψ平之间的差值称为超电势,它的产生有浓差极化、化学极化和电阻极化(电解过程中在电极表面上生成一层氧化物的薄膜或其他物质)。
在外加电压不太大的情况下,将溶液剧烈搅动可以将低浓差极化,设法降低溶液内阻可以将低电阻极化,还可以加入去极化剂可以将低化学极化。
【4】析出电势与电极的平衡电势有何不同?由于超电势的存在,使电解池阴、阳极的析出电势如何变化?使原电池正、负极的电极电势如何变化?超电势的存在有何不利和有利之处?【答】由于超电势的存在,在实际电解时要使正离子在阴极析出,外加于阴极的电势要比平衡电势更负一些;要使负离子在阳极析出,外加于阳极的电势必须比可逆电极的电势更正一些,即:ϕϕηϕϕη=+=-阳阳,析出阳,可逆阴阴,析出阴,可逆对于电解池,由于超电势的存在,阴极的析出电势会更负,阳极的析出电势会更正,外加电压要更大,所消耗的能量就越多。

电解与极化作用习题及答案电解与极化作用习题及答案电解和极化是化学中重要的概念,它们在电化学、电解池和电池等领域中起着关键作用。
本文将介绍一些与电解和极化相关的习题,并提供相应的答案,帮助读者巩固和加深对这些概念的理解。
习题一:什么是电解?请简要解释电解的过程。
答案:电解是指在电解质溶液或熔融状态下,通过外加电压使溶液中的离子发生氧化还原反应的过程。
电解过程中,正极(阳极)发生氧化反应,负极(阴极)发生还原反应。
电解是一种将电能转化为化学能的过程。
习题二:什么是极化?请简要解释极化现象的产生原因。
答案:极化是指在电解质溶液或电解池中,极板表面产生的电荷分布不均匀的现象。
极化现象的产生原因主要有两个:电解质溶液中的离子在电场作用下会向电极移动,导致电极表面聚集正负离子;同时,电极表面的化学反应会导致电极上生成一层物质,阻碍离子在电极表面的移动,从而引起极化。
习题三:电解铜(II)硫酸溶液时,正极和负极上分别发生什么反应?写出反应方程式。
答案:正极上发生的反应是Cu2+离子还原为Cu金属,反应方程式为:Cu2+ + 2e- -> Cu负极上发生的反应是水分子还原为氢气和氢氧根离子,反应方程式为:2H2O + 2e- -> H2 + 2OH-习题四:在电解银氨溶液时,正极和负极上分别发生什么反应?写出反应方程式。
答案:正极上发生的反应是Ag+离子还原为Ag金属,反应方程式为:Ag+ + e- -> Ag负极上发生的反应是水分子还原为氢气和氢氧根离子,反应方程式为:2H2O + 2e- -> H2 + 2OH-习题五:电解池中,正极和负极上的电子流动方向分别是什么?为什么?答案:在电解池中,正极上的电子流动方向是从电解质溶液向电极流动,负极上的电子流动方向是从电极向电解质溶液流动。
这是因为正极是氧化反应发生的地方,需要电子供给;负极是还原反应发生的地方,需要电子接受。
习题六:电解质溶液中的离子浓度对电解过程有何影响?请简要解释。


第九章 电解与极化作用前边讨论的电池与电极都是可逆的,那么应用能斯特公式来处理电化学体系时,它的前提就是该体系必须是处于热力学平衡态,但是对于一些现实的电化学过程来说一般都是不可逆过程,因此应用Nernst 公式研究电化学问题就具有很大的局限性。
事实上当原电池或电解池,只要有电流通过,就有极化作用发生,该过程就是不可逆过程。
研究不可逆电极反应及其规律性对电化学工业是十分重要的,所以我们要讨论不可逆电极过程。
在这一部分除了讨论电解池中的极化作用外,还要简单介绍一些电解在工业上的应用上及金属的防腐和化学电源等。
§9-1 电极的极化1、不可逆条件下的电极电势一个不可逆电池所具备的条件有两个:①电池反应在充电与放电时互为逆反应;②通过电池的电流I →0,即没有电流通过电池。
显然组成可逆电池的两个电极都是可逆电极,那么可逆电极的电极反应都是在可逆的条件下发生的。
这时电极所具有的电势就称为可逆电极电势。
可逆电极电势对许多电化学和热力学问题的解决是相当重要的。
但是在实践当中许多电化学过程,如进行电解和使用化学电源做电功时,并不是在可逆情况下进行的,也就是说要有电流通过电池或电解池,此时的电极反应就是不可逆的了,不可逆电极的电极电势用“I ϕ”表示,当然这个电极电势与可逆电极的电极电势r ϕ是不相同的,那么我们就把电极在有限电流通过时所表现的电极电位I ϕ与可逆电极电势产生偏差的现象叫做电极的极化。
偏差的大小(绝对值),称为“过电势”。
用“η”表示,||r I ηϕϕ=-,对于原电池,在可逆放电时,两电极的端电压是最大的,这个端电压就是电动势E ,它等于两个可逆电极的电位差。
()()()()r r r r E ϕϕϕϕ=-=-正阳阴负在不可逆条件下进行放电,两电极的端电压用E I 表示,它一定要小于原电池的电动势E ,E I <E ,E I =E-△E其电动势的降低主要是由于两个因素引起的,当有电流通过时, ①电池具有一定的内阻R 的消耗电位降IR ;②不可逆条件电极要产生极化,也会造成电动势下降,所以不可逆电池两电极的电位差通常就叫端电压。


物理化学论文电解与极化作用化工093班姓名:李寒萌学号:12 号电解与极化作用一、分解电压使电能转变成化学能的装置称为电解池。
当直流电通过电解质溶液,正离子向阴极迁移,负离子向阳极迁移,并分别在电极上起还原和氧化反应,从而获得还原产物和氧化产物。
若外加一电压在一个电池上,逐渐增加电压直至使电池中的化学反应发生逆转,这就是电解。
实验表明,对任一电解槽进行电解时,随着外加电压的改变,通过该电解槽的电流亦随之变化。
例如,使用两个铂电极电解HCl 溶液时,使用图9.1 的线路装置,改变可变电阻,记录电压表和电流表的读数,则可测量电解槽两端电位差与电流强度的关系曲线。
开始时,当外加电压很小时,几乎没有电流通过电解槽;电压增加,电流略有增加;当电流增加到某一点后,电流随电压增大而急剧上升,同时电极上有连续的气泡逸出。
在两电极上的反应可表示如下:阴极2H+(a H+)+2e.→H2(g, p)阳极2Cl-.(a Cl-)→Cl2(g, p)+2e. 图9.1 分解电压的测定装置当电极上有气泡逸出时,H2和Cl2的压力等于大气压力。
电解过程分析:当开始加外电压时,还没有H2和Cl2生成,它们的压力几乎为零,稍稍增大外压,电极表面上产生了少量的H2和Cl2,压力虽小,但却构成了一个原电池(自发地进行如下反应)(-) H2(p)→2H+ (a H+)+2e-(+) Cl2(g)+2e-→2Cl-(a Cl-)此时,电极上进行反应的方向正好与电解所进行的反应的方向相反。
它产生了一个与外加电压方向相反的反电动势E b。
由于电极上的产物扩散到溶液中了,需要通过极微小的电流使电极产物得到补充。
继续增大外加电压,电极上就有H2和Cl2继续产生并向溶液中扩散,因而电流也有少许增加,相当于图9.2 中I-E 曲线上的1-2段。
此时由于p H2和p Cl2不断增加,对应于外加电压的反电动势也不断增加,直至气体压力增至等于外界大气压力时,电极上就开始有气泡逸出,此时反电动势E b达到最大值E b, max将不再继续增加。



第十章 电解与极化作用本章要求:1.了解分解电压的意义,要使电解池不断工作必须克服哪几种阻力?2.了解什么是极化现象,什么是超电势?极化作业有哪几种?如何降低极化作用?3.了解电解的一般过程及应用,特别是有关电解分离提纯方面的应用。
4.了解金属腐蚀的类型以防止金属腐蚀的常用方法。
电解池:使电能转变成化学能的装置当一个电池与外接电源反向对接时,只要外加电压大于该电池的电动势E ,电池中的反应逆向发生,原电池就要变成电解池,要使电解池继续正常工作,外加电压要比电池电动势E 大很多,这些额外的电能一部分用来克服电阻,一部分用来克服电极的极化作用极化作用:当电流通过电极时,电极电势偏离其平衡的现象,且该过程是步可逆过程。
§10.1 分解电压在电池上外加一个直流电源,并逐渐增加电压,使电池中的物质在电极上发生化学反应,称为电解。
如电解HCl 水溶液阴极: ).(()p g aH e H H 222→+-++阳极:).(p g Cl e Cl 222→--- 总反应: )()()(p P aq Cl H HCl 222+−−→−电解 分解装置P118图10.1,并绘制电流─电压曲线。
由P118图10. 电流─电压曲线可看出:① 当开始加外电压时,还没有)()(g g Cl H 22和生成,P=0 电路中几乎没有电流通过。
② 当稍增大外电压,电极表面有少量)()(g g Cl H 22和产生,其压力虽小,却构成了一个原电池,产生了与外加电压方向相反的反电动b E 由于压力很小,低于大气压力,产生气体不能离开电极自由逸出,而是扩散到溶液中消失,此时此时就需要通入极微小的电流使电极产物得到补充,相当于图1─2段。
③ 继续增大外电压,电极时上)()(g g Cl H 22和继续产生,当22cL H P P 和等于外界大气压力时,电极上开始有气泡逸出,此时反电动势b E 达到了最大值MAX b E 而不在继续增加,若此时继续增大外电压,则电流急曾,如图曲线2─3段直线部分。
4801
电池 Pb(s)│H2SO4(m)│PbO2(s),作为原电池时,负极是,正极是;作为电解池时,阳极是,阴极是。
4802
当电池的电压小于它的开路电动势时,则表示电池在: ( )
(A) 放电
(B) 充电
(C) 没有工作
(D) 交替地充放电
4815
电解HNO3, H2SO4, NaOH, NH3·H2O, 其理论分解电压均为1.23 V。
其原因是
_________________________________________________________。
4816
从理论上分析电解时的分解电压, E分解=__________________________, 而且随电流强度I的增加而_____________。
4851
电化学中电极反应的速度以 ______ 表示,极化是 _________________________
的现象,极化主要有 _________, _________。
超电势是。
4855
当发生极化现象时,两电极的电极电势将发生如下变化: ( )
(A) φ平,阳>φ阳;φ平,阴>φ阴
(B) φ平,阳<φ阳;φ平,阴>φ阴
(C) φ平,阳<φ阳;平,阴<φ阴
(D) φ平,阳>φ阳;φ平,阴<φ阴
4857 298 K、0.1 mol·dm-3的 HCl 溶液中,氢电极的热力学电势为 -0.06 V,电解此溶液
为: ( )
时,氢在铜电极上的析出电势φ
H2
(A) 大于 -0.06 V
(B) 等于 -0.06 V
(C) 小于 -0.06 V
(D) 不能判定
4858 电池放电时,随电流密度增加阳极电位变 ________,阴极电位变 ________,正
极变 ________ ,负极变_____。
4859 电解过程中,极化作用使消耗的电能 ________;在金属的电化学腐蚀过程中,极
化作用使腐蚀速度 ________ 。
4860 (1) 设阳极和阴极的超电势均为 0.7 V,还原电位均为 1.20 V,则阳极电位等
于__________ ,阴极电位等于__________ 。
(2) 电池充电时,充电电压比平衡电动势高、低还是相等 _________ 。
4866 氢气在金属电极上析出时, 根据条件不同, 超电势随电流密度变化关系分别可用=R e j或
=a + b lg j表示, 前者适用于情况, 而后者适用于____________情况。
4870 Tafel公式=a+blg j 的适用范围是: ( )
(A) 仅限于氢超电势
(B) 仅限于j 0, 电极电势稍有偏差的情况
(C) 仅限于阴极超电势, 可以是析出氢, 也可以是其他
(D) 可以是阴极超电势, 也可以是阳极超电势
4889 下列示意图描述了原电池和电解池中电极的极化规律, 其中表示原电池阳极的是:
( )
(A) 曲线1 (B) 曲线2
(C) 曲线3 (D) 曲线4
4908 某含有 Ag+,Ni2+ ,Cd2+ (活度均为1)离子的pH = 2 的溶液,电解时, H2与各金属在阴极析出的先后顺序为 ________、________、_________、__________。
(已知φө (Ag+/Ag)= 0.799 V,φө (Ni2+/Ni)= -0.23 V,φө (Cd2+/Cd)= -0.402 V 。
H2在 Ag 上超电势=0.20 V,在 Ni 上, =0.24 V,在 Cd 上, =0.30 V)
4909 以 Cu 为电极,电解 1 mol·dm-3 CuSO4溶液 (pH = 3), 则在阴极上的电极反应
_________________________,阳极上的电极反应 _________________________ 。
已知: H2在 Cu 电极上, = 0.5 V, φө (Cu2+/Cu)= 0.337 V ,
O2在 Cu 电极上, = 0 V, φө (O2/H+,H2O)= 1.229 V 。
4910 以石墨为阳极,电解 0.01 mol·kg-1 NaCl 溶液,在阳极上首先析出: ( )
(A) Cl2 (B) O2
(C) Cl2与 O2混合气体 (D) 无气体析出
已知:φө (Cl2/Cl-)= 1.36 V , (Cl2)= 0 V ,
φө (O2/OH-)= 0.401V , (O2) = 0.8 V 。
4921 电解金属盐的水溶液时, 在阴极上: ( )
(A) 还原电势愈正的粒子愈容易析出
(B) 还原电势与其超电势之代数和愈正的粒子愈容易析出
(C) 还原电势愈负的粒子愈容易析出
(D) 还原电势与其超电势之和愈负的粒子愈容易析出
4925 电解氢氧化钾溶液,制备氢气和氧气的阳极反应是 _________________________ ;
阴极反应是 _________________________ 。
4932 用铜电极电解 0.1mol·kg-1的 CuCl2水溶液,阳极上的反应为 ( )
(A) 2Cl- ─→ Cl2+ 2e-
(B) Cu ─→ Cu2++ 2e-
(C) Cu ─→ Cu++ e-
(D) 2OH-─→ H2O + 1
2
O2+ 2e-
4940 25℃时, H2在锌上的超电势为 0.7 V,φө (Zn2+/Zn) = -0.763 V,电解一含有
Zn2+(a=0.01) 的溶液,为了不使 H2析出,溶液的 pH值至少应控制在 ( )
(A) pH > 2.06
(B) pH > 2.72
(C) pH > 7.10
(D) pH > 8.02
4946 电解时, 在阳极上首先发生氧化作用而放电的是: ( ) (A) 标准还原电势最大者
(B) 标准还原电势最小者
(C) 考虑极化后,实际上的不可逆还原电势最大者
(D) 考虑极化后,实际上的不可逆还原电势最小者
4947 通电于含有相同浓度的Fe2+, Ca2+, Zn2+, Cu2+的电解质溶液, 已知
φө (Fe2+/ Fe) = -0.440 V ,φө (Ca2+/ Ca) = -2.866 V
φө (Zn2+/ Zn) = -0.7628 V ,φө (Cu2+/ Cu) = 0.337 V
当不考虑超电势时, 在电极上金属析出的次序是: ( )
(A) Cu → Fe → Zn → Ca
(B) Ca → Zn → Fe → Cu
(C) Ca → Fe → Zn → Cu
(D) Ca → Cu → Zn → Fe
4948 金属活性排在H2之前的金属离子, 如Na+ 能优先于H+在汞阴极上析出, 这是由于: ( )
(A) φө (Na+/ Na) <φө (H+/ H2)
(B) (Na) < (H2)
(C) φ(Na+/ Na) <φ(H+/ H2)
(D) H2在汞上析出有很大的超电势, 以至于φ(Na+/ Na) >φ(H+/ H2)
5102 一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁
箱的寿命,选用哪种金属片为好? ( )
(A) 铜片 (B) 铁片
(C) 镀锡铁片 (D) 锌片
5106 下列对铁表面防腐方法中属于"电化保护"的是: ( )
(A) 表面喷漆 (B) 电镀
(C) Fe表面上镶嵌Zn块 (D) 加缓蚀剂
5154 将铅蓄电池在 10.0 A 电流下充电 1.5 h,则 PbSO4分解的量为:
(M r(PbSO4)= 303 ) ( )
(A) 0.1696 kg (B) 0.0848 kg
(C) 0.3392 kg (D) 0.3564 kg
5165 电池在恒温、恒压及可逆情况下放电, 则其与环境的热交换为 ( )
(A) r H (B) T r S
(C) 一定为零 (D) 与r H与T r S均无关
5113
铜板上有一些铁的铆钉, 长期暴露在潮湿的空气中, 在_____________________
部位特别容易生锈。
(注:本资料素材和资料部分来自网络,仅供参考。
请预览后才下载,期待您的好评与关注!)。