2不饱和脂肪烃——炔烃
- 格式:docx
- 大小:95.35 KB
- 文档页数:3








炔烃【学习目标】1、了解炔烃的物理性质及其变化规律与分子中碳原子数目的关系;2、能以典型代表物为例||,理解炔烃的组成、结构和主要化学性质;3、掌握乙炔的实验室制法;4、了解脂肪烃的来源和用途||。
【要点梳理】要点一、炔烃分子里含有碳碳三键的一类脂肪烃称为炔烃||,其分子式的通式可表示为C n H 2n -2(n ≥2||,且为正整数)||,其中碳原子数小于或等于4的炔烃是气态炔烃||,最简单的炔烃是乙炔||。
1.乙炔的分子组成和结构分子式 结构式 结构简式 空间结构C 2H 2 H —C ≡C —H HC ≡CH 直线形(四个原子处在同一条直线上)2.乙炔的物理性质乙炔是一种无色、无味的气体||,密度比空气略小||,微溶于水||,易溶于有机溶剂||。
乙炔常因混有杂质而带有特殊难闻的臭味||。
3.乙炔的化学性质(1)乙炔的氧化反应①使酸性高锰酸钾溶液褪色②乙炔的可燃性2C 2H 2+5O 2−−−→燃烧4CO 2+2H 2O 注意:①CH 4、C 2H 4、C 2H 2三种气体燃烧时||,火焰越来越明亮||,但黑烟越来越浓||,原因是碳的质量分数越来越大||。
②氧炔焰温度可达3000℃以上||,可用氧炔焰来焊接或切割金属||。
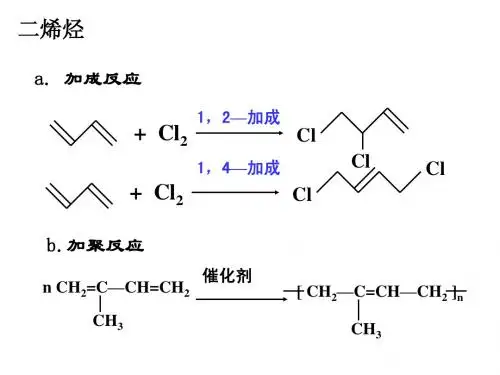
(2)乙炔的加成反应乙炔可与H 2、HX 、X 2(卤素单质)、H 2O 等发生加成反应||。
如:HC ≡CH+2H 2∆−−−−→催化剂CH 3CH 3HC ≡CH+H 2O ∆−−−−→催化剂CH 3CHO(3)乙炔的加聚反应(在聚乙炔中掺入某些物质||,就有导电性||,聚乙炔又叫导电塑料)4.乙炔的实验室制法(1)反应原理:CaC 2+2H 2O →Ca(OH)2+CH ≡CH ↑||。
(2)发生装置:使用“固体+液体→气体”的装置||。
(3)收集方法:排水集气法||。
(4)净化方法:用浓的CuSO 4溶液除去H 2S 、PH 3等杂质气体||。
通式 官能团 物理性质状态 熔沸点 密度 溶解性①随碳原子数的增加||,炔烃的含碳量逐渐减小||。
炔烃编稿:宋杰 审稿:张灿丽【学习目标】1、了解炔烃的物理性质及其变化规律与分子中碳原子数目的关系;2、能以典型代表物为例,理解炔烃的组成、结构和主要化学性质;3、掌握乙炔的实验室制法;4、了解脂肪烃的来源和用途。
【要点梳理】 要点一、炔烃分子里含有碳碳三键的一类脂肪烃称为炔烃,其分子式的通式可表示为C n H 2n -2(n ≥2,且为正整数),其中碳原子数小于或等于4的炔烃是气态炔烃,最简单的炔烃是乙炔。
12.乙炔的物理性质乙炔是一种无色、无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂。
乙炔常因混有杂质而带有特殊难闻的臭味。
【高清课堂:炔烃和气态烃燃烧#化学性质】 3.乙炔的化学性质 (1)乙炔的氧化反应①使酸性高锰酸钾溶液褪色 ②乙炔的可燃性2C 2H 2+5O 2−−−→燃烧4CO 2+2H 2O 注意:①CH 4、C 2H 4、C 2H 2三种气体燃烧时,火焰越来越明亮,但黑烟越来越浓,原因是碳的质量分数越来越大。
②氧炔焰温度可达3000℃以上,可用氧炔焰来焊接或切割金属。
(2)乙炔的加成反应乙炔可与H 2、HX 、X 2(卤素单质)、H 2O 等发生加成反应。
如:HC ≡CH+2H 2∆−−−−→催化剂CH 3CH 3 HC ≡CH+H 2O ∆−−−−→催化剂CH 3CHO(3)乙炔的加聚反应(在聚乙炔中掺入某些物质,就有导电性,聚乙炔又叫导电塑料)【高清课堂:炔烃和气态烃燃烧#乙炔的实验室制法】 4.乙炔的实验室制法(1)反应原理:CaC 2+2H 2O —→Ca(OH)2+CH ≡CH ↑。
(2)发生装置:使用“固体+液体—→气体”的装置。
(3)收集方法:排水集气法。
(4)净化方法:用浓的CuSO 4溶液除去H 2S 、PH 3等杂质气体。
注意:①随碳原子数的增加,炔烃的含碳量逐渐减小。
②炔烃的物理性质随碳原子数的递增呈规律性变化的原因:同属分子晶体,组成和结构相似,分子间作用力随相对分子质量的增大而增大。
《脂肪烃的性质及应用》炔烃的聚合反应《脂肪烃的性质及应用——炔烃的聚合反应》在有机化学的广袤世界里,脂肪烃占据着重要的一席之地。
而其中,炔烃的聚合反应更是展现出了独特的化学魅力和广泛的应用价值。
先来了解一下什么是炔烃。
炔烃是一类含有碳碳三键(—C≡C—)的不饱和脂肪烃,常见的炔烃如乙炔(C₂H₂)。
炔烃具有一些独特的化学性质,而聚合反应就是其中颇为引人注目的一种。
炔烃的聚合反应可以分为不同的类型。
其中一种常见的是加成聚合反应。
以乙炔为例,在特定的催化剂作用下,多个乙炔分子可以相互加成,连接形成高分子化合物。
在这个聚合过程中,反应条件起着关键的作用。
催化剂的选择对于反应的速率和产物的性质有着重要的影响。
不同的催化剂可能会导致生成不同结构和性能的聚合物。
从反应机理来看,炔烃的聚合通常涉及到碳碳三键的打开和新键的形成。
在这个过程中,电子的转移和共享发生了巧妙的变化,使得分子能够有序地连接在一起。
那么,炔烃聚合反应得到的聚合物有什么特点和应用呢?首先,这些聚合物往往具有较高的强度和硬度。
这是因为聚合物链中的碳碳三键结构赋予了它们较好的刚性和稳定性。
例如,聚乙炔就是一种具有潜在应用价值的导电聚合物。
由于其特殊的电子结构,在一定条件下能够表现出良好的导电性,这使得它在电子器件领域有着广阔的应用前景。
在材料科学领域,炔烃聚合得到的聚合物可以用于制造高强度的纤维材料。
这些纤维具有出色的抗拉性能,可用于制造防弹衣、航空航天部件等需要高强度材料的领域。
此外,炔烃的聚合反应在生物医药领域也有所应用。
通过巧妙的设计和合成,可以制备出具有特定生物活性和功能的聚合物,用于药物输送、组织工程等方面。
在工业生产中,炔烃的聚合反应也为合成新型塑料和橡胶提供了途径。
这些新型材料具有优异的性能,能够满足不同领域对于材料性能的特殊要求。
然而,炔烃的聚合反应也并非一帆风顺。
在实际应用中,还面临着一些挑战和问题。
比如,反应的选择性和控制难度较大。
炔烃的通式
炔烃的通式是CnH2n-2 (n>=2)。
炔烃,为分子中含有碳碳三键的碳氢化合物的总称,是一种不饱和的脂肪烃,直链单炔烃的分子通式为CnH2n-2(其中n为非1正整数),简单的炔烃化合物有乙炔(C2H2),丙炔(C3H4)等。
其中,乙炔是最重要的一种炔烃,在工业中可用以照明、焊接及切断金属(氧炔焰),也是制造乙醛、醋酸、苯、合成橡胶、合成纤维等的基本原料。
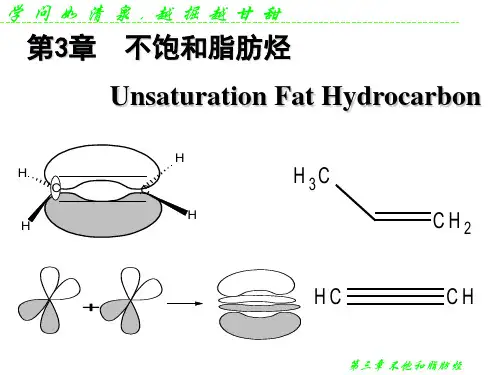
炔烃的碳原子2s轨道同一个2p轨道杂化,形成两个相同的sp杂化轨道。
堆成地分布在碳原子两侧,二者之间夹角为180度。
乙炔碳原子一个sp杂化轨道同氢原子的1s轨道形成碳氢σ键,另一个sp杂化轨道与相连的碳原子的sp杂化轨道形成碳碳σ键,组成直线结构的乙炔分子。
未杂化的两个p 轨道与另一个碳的两个p轨道相互平行,“肩并肩”地重叠,形成两个相互垂直的π键。
不饱和脂肪烃——炔烃
1、制备
(1)邻二卤代物,偕二卤代物两次E2消去
试剂:NaNH2(+氢氧化钾)
(2)四卤代烃锌镁作用下反应
2、三键上的亲电加成
(1)与卤化氢加成——在CuCl/HCl作用下双键三键共存下先和三键反应
(2)过氧化物效应
(3)与卤素发生反式加成(常用于炔基的保护,生成四卤代烃再用Zn反应回复成为炔键) (4)与水加成生成酮式结构——马氏规则——在二价汞离子催化下,三键比双键更易水合(5)在和1MOL氢反映的时候首先生成共轭二烯
3、三键上的亲核加成
(1)与氢氰酸的加成
(2)与含有活泼氢的有机物加成——优先生成稳定碳负离子
应用——引入乙烯基
4、炔烃的还原反应
(1)催化氢化:对于双键、三键共存的分子中,若它们是孤立的,则双键易还原,若它们是共轭的则三键先还原。
特殊催化剂Lindlar-Cat只加氢至双键
(2)硼氢化还原:顺式加成,反马氏
(3)碱金属还原——Na/NH3(不同于NaNH3)——反式烯烃
5、炔烃的氧化反应
高锰酸钾+碱——若为端炔则是羧酸和二氧化碳
臭氧+水——若为端炔则成羧酸和甲酸
6、端炔的性质
(1)叁键氢的弱酸性及炔基负离子——炔基钠
(2)炔基负离子的反应及在合成上的应用
(3)和银氨络离子生成炔银沉淀
7、炔烃的聚合
三聚成苯环
Ps:苯在五氧化二钒,和氧气条件下生成马来酸酐。