有机化学第三章不饱和烃
- 格式:ppt
- 大小:691.00 KB
- 文档页数:57



有机复习提纲第3章不饱和烃第3章不饱和烃3.1烯烃⼀、⼄烯的结构⼆、烯烃的同分异构现象1.位置异构(构造异构)——官能团位置不同⽽产⽣的异构2.顺反异构(⽴体异构)产⽣顺反异构的条件:①刚性结构(脂环、C=C) ,具有阻碍旋转的因素②刚性结构中同⼀个碳上所连的原⼦(基团)不同3.2 烯烃和炔烃的同分异构3.3 烯烃和炔烃的命名3.3.1 烯基与炔基(1)衍⽣命名法(2)系统命名法3.3.2 烯烃的命名(1) 顺,反–标记法(2) Z,E–标记法次序规则: 相连原⼦的⼤⼩,⼤者为“优先”基团。
依照相对原⼦质量:I > Br > Cl > S > O > N > C同位素依照相对原⼦质量:D > H未共⽤电⼦:最⼩较“优先”基团在双键的同侧, 标记为Z式;较“优先”基团在双键的异侧, 标记为E式。
如果直接相连的第⼀个原⼦相同,继续逐个⽐较。
对于含重键的基团,将其视为两个或三个单键3.3.4 炔烃的命名编号时尽可能使重键的位次低。
当双键和三键处于相同的位次时,优先给予双键较低的位次。
3.4 烯烃和炔烃的物理性质简单炔烃的沸点、熔点以及密度⽐碳原⼦数相同的烷烃和烯烃⾼⼀些炔烃分⼦极性⽐烯烃稍强炔烃不易溶于⽔,⽽易溶于⽯油醚、⼄醚、苯和四氯化碳中3.5 烯烃和炔烃的化学性质由于π键易于断裂,加成反应是烯烃和炔烃的主要反应⼀、加成反应总述(1)碳正离⼦1.反应活性烷基供电⼦,增加双键上的电⼦云密度,利于亲电加成反应;羧基吸电⼦,降低双键上的电⼦云密度,不利于亲电加成反应。
双键碳上的电⼦密度越⾼则容易⽣成稳定碳正离⼦,亲电加成活性越⼤。
烷基给电⼦作⽤,增加中⼼碳原⼦上正电荷分散程度,提⾼碳正离⼦的稳定性。
2.性质作⽤a. 碳正离⼦的重排b.⼆、反应类型(1)加氢(催化氢化反应,反应放热)催化剂:Pt, Pd, Ni催化剂的表⾯对重键、氢分⼦的吸附,使π键和H-H键松驰,降低价键断裂的离解能,从⽽降低反应活化能。

第三章 不饱和烃I 烯烃● 定义: 含有碳-碳双键(C=C)的烃叫烯烃。
碳-碳双键(C=C)是烯烃的官能团。
●开链单烯烃的通式:C n H 2n 。
例如:H 2CCH 2H 2CC CH 3CH 3H 2CCH CH 3I 烯烃一、乙烯的结构乙烯分子的构型双键:DH mθC=C=610KJ/mol;ó单键:DH mθC-C=350KJ/mol1、碳原子的sp 2杂化2s2p激发态2s2p激发基 态sp 2p杂化1200sp 2杂化轨道sp 2杂化与未杂化的轨道乙烯分子的结构乙烯分子中的σ键乙烯分子中的π键2、乙烯分子中π键的形成及π电子云的分布π键小结π键为轴平行的p轨道侧面交盖成键;π键不能单独存在,分散于sp2轨道所在平面的上下两层,不能绕键轴自由旋转;π键电子云流动性大,受核束缚小,易极化。
∴π键易断裂、起化学反应;π键键能小,不如σ键牢固碳碳双键键能为611KJ/mol,碳碳单键键能为347JK/mol,∴π键键能为611-347=264K/mol7二、命名和异构系统命名法(1) 选择主链:含双键的最长碳链含双键的取代基多的最长碳链为主链(2) 给主链碳原子编号:从最靠近双键的一端起CH 3CCCH 2CH 2CH 2CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 31 2 3 4 5 6 7 86-甲基-3-戊基-2-辛烯(3) 标明双键的位次: 将双键两个碳原子中位次较小的一个编号,放在烯烃名称的前面。
1-烯烃中的“1”可省去。
4-甲基-2-乙基己烯5- 十一碳烯碳原子数在10以上的烯烃,命名时在烯之前还需加个“碳”字,例如十一碳烯环烯烃加字头“环”于有相同碳原子数的开链烃之前命名烯基的命名CH2=CH-乙烯基CH3-CH= CH- 丙烯基CH2=CH-CH2- 烯丙基注意这二者的区别异构现象(注意相关概念)C以上的烯有碳链异构、官能团位置异构、顺反异构4烯烃的构造异构13① 烯烃的顺反异构现象(立体异构现象)•由于双键不能自由旋转,当双键的两个碳原子各连接不同的原子或基团时,可能产生不同的异构体.条件:—构成双键的任何一个碳原子上所连接的两个原子或基团须不同.•能够用常规方法将顺反异构体分离出来。




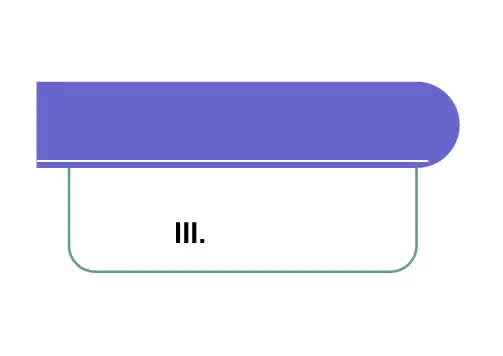
第三章 不饱和烃不饱和烃是指分子结构中含有碳碳双键或三键的烃。
不饱和烃中含有碳碳双键的叫烯烃,含有碳碳三键的称为炔烃。
含有两个或多个碳碳双键的不饱和烃称为二烯烃和多烯烃。
一个不饱和烃分子结构中同时含有碳碳双键和三键则称为烯炔。
不饱和烃的双键和三键不太牢固,容易发生亲电加成反应、取代反应及氧化反应。
烯烃是指含有碳碳双键的不饱和烃,包括链状烯烃和环状烯烃,其官能团为碳碳双键。
链状烯烃的通式为C n H 2n (n ≥2)。
相对于饱和烷烃,烯烃分子结构中每增加1个双键则减少2个氢原子。
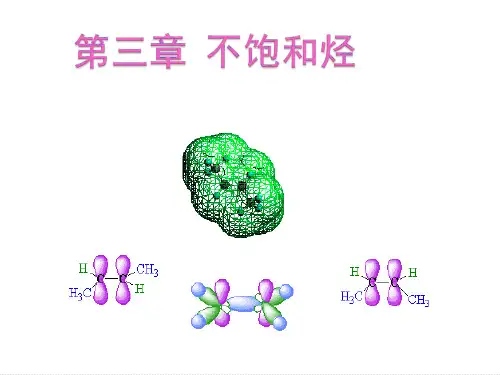
一、烯烃的结构和异构现象 (一)烯烃的结构烯烃的结构中主要特征部分为碳碳双键,以最简单的烯烃-乙烯为例来了解双键的结构,乙烯的分子式为C 2H 4,乙烯的两个C 原子和四个氢原子均在同一个平面上,每个碳原子只和3个原子相连,为平面型分子。
碳碳双键由1个σ键和1个π键构成,而不是两个单键构成。
乙烯的平面构型如图3-1(a )所示,分子模型见图3-1(b )和3-1(c )。
CCH HH H121.7°117°0.108nm(a)乙烯的平面构型 (b)球棍模型 (c)比例模型图3-1 乙烯分子的结构拓展阅读碳原子的sp 2杂化和π键杂化轨道理论认为,乙烯分子中的碳原子在成键过程中,处于激发态的1个2s 轨道和2个2p 轨道进行杂化,形成3个能量相同的sp 2杂化轨道,称为sp 2杂化,其杂化过程可表示为:2s 2p激发sp 2杂化sp 2杂化轨道2p2s 2p基态激发态杂化态形成的3个sp 2杂化轨道中每个含有1/3的s 轨道成分和2/3的p 轨道成分,形状是一头大一头小;3个sp 2杂化轨道的对称轴分布在同一平面上,夹角为120°,呈平面三角形,每个碳原子还有一个2p z 轨道未参与杂化,其对称轴垂直于3个sp 2杂化轨道的对称轴所形成的平面,见图3-2。
由此可见,乙烯分子中碳碳双键是由1个σ键和1个π键组成的,π键是由2个p 轨道侧面重叠形成的,电子云分布于键轴上下,键能较小,同时由于π键电子云离核较远,受原子核束缚力较弱,容易被外电场极化,所以π键不稳定,比σ键容易断裂。
有机化学不饱和烃有机化学是研究有机物的性质、结构、合成和反应的学科。
其中,不饱和烃是一类重要的有机化合物。
本文将从不饱和烃的定义、特性、分类和应用等方面进行阐述。
一、不饱和烃的定义不饱和烃是指分子中含有碳-碳双键或三键的有机化合物。
相对于饱和烃(只有碳-碳单键)而言,不饱和烃具有较高的化学活性和较丰富的化学反应。
二、不饱和烃的特性1. 双键或三键的存在使得不饱和烃分子中存在着不同的构象异构体,使其具有较高的立体化学活性。
2. 不饱和烃的化学反应活性相对较高,容易进行加成反应、氧化反应、还原反应等。
3. 不饱和烃的分子中存在着非键电子,因此具有较高的亲电性,容易发生亲电加成反应。
三、不饱和烃的分类根据双键或三键的数目和位置不同,不饱和烃可以分为以下几类:1. 烯烃:分子中含有碳-碳双键的不饱和烃。
根据双键的数目,烯烃又可分为单烯和多烯两类。
单烯是指分子中只有一个碳-碳双键的烯烃,而多烯则包括了分子中含有多个碳-碳双键的烯烃。
2. 炔烃:分子中含有碳-碳三键的不饱和烃。
和烯烃类似,炔烃也可以分为单炔和多炔两类。
四、不饱和烃的应用不饱和烃在化学工业和生物学领域中有着广泛的应用。
1. 化学工业中,不饱和烃是重要的原料和中间体,广泛用于合成有机合成材料、高分子材料和医药等。
2. 不饱和烃在生物学领域中,是生物分子的重要组成部分。
例如,脂肪酸是由不饱和烃组成的,它们在细胞膜的结构和功能中起着重要的作用。
3. 此外,不饱和烃还可以作为燃料,例如石油中含有大量的不饱和烃,可以作为燃料和能源的来源。
总结:不饱和烃是一类具有双键或三键的有机化合物,在有机化学和生物学领域中有着重要的地位和应用。
它们的特性和分类使其具有较高的化学活性和丰富的反应性,成为化学工业和生物学研究中不可或缺的一部分。
通过深入了解不饱和烃的性质和应用,我们可以更好地理解和应用有机化学知识。
第三章 不饱和烃思考题习题3.1 写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式。
其中含有六个碳原子的烯烃,哪些有顺反异构?写出其顺反异构体的构型式(结构式)。
(P69)解:C 6H 12有13个构造异构体,其中4个有顺反异构体:CH 2=CHCH 2CH 2CH 2CH 3CH 3CH=CHCH 2CH 2CH 3CH 3CH 2CH=CHCH 2CH 3(Z,E)(Z,E)CH 2=CCH 2CH 2CH 33CH 2=CHCHCH 2CH 33CH 2=CHCH 2CHCH 33CH 3C=CHCH 2CH 33CH 3CH=CCH 2CH 33CH 3CH=CH 2CHCH 33(Z,E)(Z,E)CH 2=CHCCH 3CH 3CH 3CH 2=CCHCH 3CH 3CH 3CH 3C=CCH 3CH 3CH 3CH 22CH 3CH 2CH 3C 6H 10有7个构造异构体:CH CCH 2CH 2CH 2CH 3CH 3C CCH 2CH 2CH 3CH 3CH 2C CCH 2CH 3CH CCHCH 2CH 33CH CCH 2CHCH 33CH CC(CH 3)3CH 3C CCHCH 33习题3.2 用衍生物命名法或系统命名法命名下列各化合物:(P74)(1) (CH 3)2CHCH=CHCH(CH 3)2 对称二异丙基乙烯 or 2,5-二甲基-3-己烯(2)(CH 3)2CHCH 2CH=CHCHCH 2CH 3CH 3123456782,6-二甲基-4-辛烯(3) CH 3CH 2C CCH 2CH 3123456二乙基乙炔 or 3-己炔(4) CH 3CH 2C(CH 3)2C CH 12345 3,3-二甲基-1-戊炔(5) CH 2=CHCH 2CCH 123451-戊烯-4-炔(6) HCC C=CCH=CH 2CH 2CH 2CH 3CH 2CH 2CH 31234563,4-二丙基-1,3-己二烯-5-炔(7)CH 3CH 3 2,3-二甲基环己烯(8) CH 3CH 35,6-二甲基-1,3-环己二烯习题3.3 用Z,E-命名法命名下列各化合物:(P74)(1) ↑C=CCH 2CH 3H ClBr↑ (Z)-1-氯-1-溴-1-丁烯(2) ↓C=C F CH 3ClCH 3CH 2↑ (E)-2-氟-3-氯-2-戊烯 (3) ↑C=CCH 2CH 3CH 2CH 2CH 3HCH 3↓ (E)-3-乙基-2-己烯(4) ↓C=CCH(CH 3)2CH 2CH 2CH 3CH 3H↑ (E)-3-异丙基-2-己烯习题3.4 完成下列反应式:(P83)(1) C 3H 7C CC 3H7C=C H C 3H HC 3H 7(2) 3C 3H 7C CC 3H 7C=C H C 3H C 3H 7H(3) + Br 2C=C HC 2H 5C 2H 5H25(4)CC HOOCCOOH C=CHOOCBr Br COOH+ Br2习题3.5 下列各组化合物分别与溴进行加成反应,指出每组中哪一个反应较快。