主要有机物之间转化关系
- 格式:ppt
- 大小:599.00 KB
- 文档页数:37
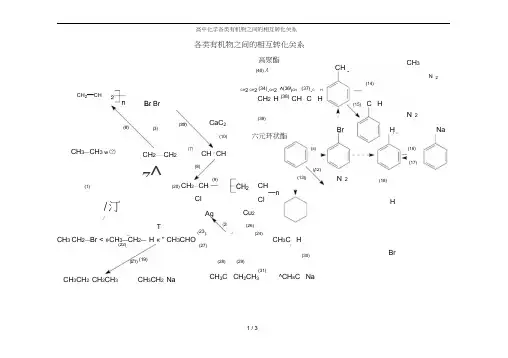
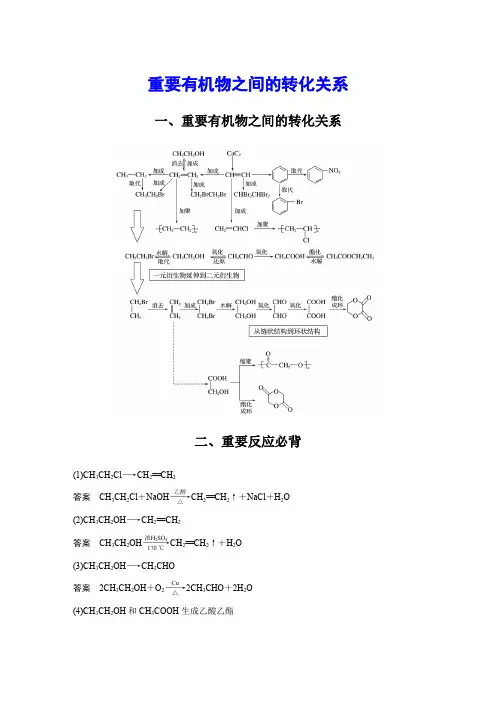
重要有机物之间的转化关系一、重要有机物之间的转化关系二、重要反应必背(1)CH 3CH 2Cl ―→CH 2==CH 2答案 CH 3CH 2Cl +NaOH ――→乙醇△CH 2==CH 2↑+NaCl +H 2O (2)CH 3CH 2OH ―→CH 2==CH 2答案 CH 3CH 2OH ―――→浓H 2SO 4170 ℃CH 2==CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO答案 2CH 3CH 2OH +O 2――→Cu △2CH 3CHO +2H 2O (4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案 CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC —CHO ―→HOOC —COOH答案 OHC —CHO +O 2――→催化剂△HOOC —COOH (6)乙二醇和乙二酸生成聚酯答案 n HOCH 2—CH 2OH +n HOOC —COOH 一定条件+2n H 2O(7)乙醛和银氨溶液的反应答案 CH 3CHO +2Ag(NH 3)2OH ―→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案 CH 3CHO +2Cu(OH)2―→△CH 3COOH +Cu 2O ↓+2H 2O (9)答案 +2NaOH ――→醇△+2NaCl +2H 2O (10)答案 +Br 2――→FeBr 3+HBr (11)和饱和溴水的反应答案 +3Br 2―→↓+3HBr(12)和溴蒸气(光照)的反应答案 +Br 2―→光+HBr(13) 和HCHO 的反应答案 n +n HCHO ―→H ++n H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案 CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应答案 +2NaOH ――→△CH 3COONa ++H 2O三、有机物的检验辨析1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。

有机物降解机制有机物降解机制引言:有机物降解是指有机物在自然环境中经过一系列化学、生物或物理过程逐渐分解、转化为无机物的过程。
这一过程对于维持环境平衡和生物循环至关重要。
本文将从生物降解、化学降解和物理降解三个方面,探讨有机物降解的机制。
一、生物降解生物降解是指有机物在生物体内或生物作用下逐渐分解为较简单的无机物的过程。
生物降解是自然界最常见的降解方式,其机制主要包括酶催化、微生物作用和生态系统调控。
1. 酶催化酶是一类特殊的蛋白质,能够加速化学反应速率。
在有机物降解过程中,酶通过催化剂的作用,降低反应活化能,使有机物分子发生断裂、转化。
例如,多酚氧化酶能够催化酚类物质的氧化反应,将其转化为酚醛类物质。
2. 微生物作用许多微生物能够利用有机物作为能源和营养来源,通过降解有机物来获取生长所需的能量。
微生物分泌的酶能够将复杂的有机物分解为较简单的有机物,然后进一步降解为无机物。
例如,厌氧菌能够将有机酸降解为乙酸、氢气和二氧化碳。
3. 生态系统调控生态系统中的生物多样性和相互作用对有机物降解有重要影响。
生物多样性丰富的生态系统能够容纳更多的降解菌种,提高有机物降解的效率。
此外,生态系统中的生物之间还存在着协同作用和竞争关系,这些相互作用也会对有机物降解过程产生影响。
二、化学降解化学降解是指通过化学反应将有机物分解为较简单的无机物的过程。
化学降解的机制主要包括氧化、水解、光解等。
1. 氧化氧化是指有机物与氧发生反应,形成氧化产物的过程。
氧化反应可以通过氧气、过氧化氢等氧化剂催化进行。
例如,有机物中的醇可以被氧气氧化为醛、酮;烷烃可以被氧气氧化为醇。
2. 水解水解是指有机物与水发生反应,形成水解产物的过程。
水解反应通常需要在酸碱催化下进行。
例如,脂肪酸与水在碱催化下发生水解反应,生成相应的醛、酮和醇。
3. 光解光解是指有机物在光照条件下发生分解的过程。
光解反应通常需要吸收特定波长的光能才能进行。
例如,光能可以使有机物中的化学键断裂,产生自由基,进而引发链式反应,最终将有机物分解为无机物。



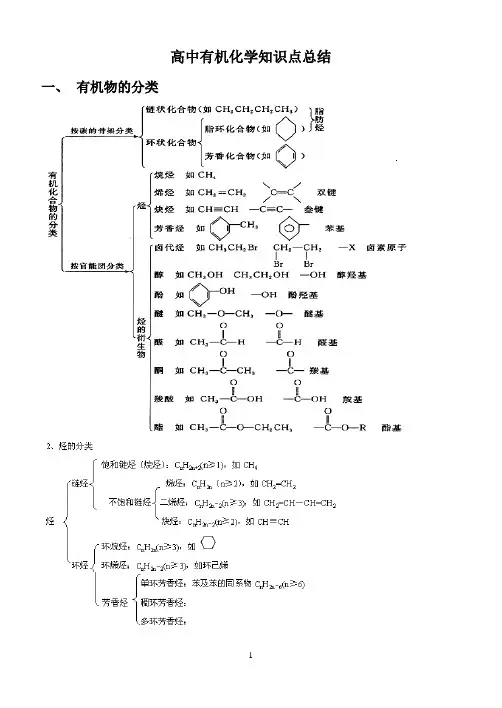
高中有机化学知识点总结一、有机物的分类二、有机物的转化关系1、常见链状有机物的转化(注意反应条件)2、常见环状有机物的转化二、 有机物的命名1.烷烃:选主链,称某烷;编号位,定支链;取代基,短线连;不同基,简在前,相同基,合并算。
长多近小写烃名,先简后繁位次清。
先小然后大,一基跟一位,数目汉数字,位置阿拉伯,字数短线隔,数字逗号撇。
其他类别的有机物:选含官能团的最长碳链为主链,从靠近官能团的一端编号,要指明官能团的位置。
练习2-甲基-1-丁烯与氢气加成以后的产物的名称为:三、有机物的组成和结构1.有机物的结构特点:化合价、成键方式、同分异构2.表示方法:(1)化学式:分子式 电子式 结构式 结构简式 最简式(实验式)键线式等 (2)模型:球棍模型 比例模型3.不饱和度:又称缺氢指数Ω=双键数+叁键数×2+环数 = (2n+2-m) /2ONaCOONa— —BrOH Br — Br(17) (18)4.同分异构:概念、分类、书写⑪碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C5H12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑫位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑬异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、氨基乙酸和硝基乙烷、葡萄糖与果糖、蔗糖与麦芽糖等。
⑭其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
5.同系物的概念(1)定义:________相似,在分子组成上相差______________________的物质互相称为同系物。
注意:①同系物之间具有相似的分子结构,因此化学性质相似,物理性质则随碳原子数的增加而发生规律性的变化。

一、有机物间相互转化关系二、能与溴水发生化学反响而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃〔烯烃、炔烃、二烯烃等〕⑵ 不饱和烃的衍生物〔烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等〕 ⑶ 石油产品〔裂化气、裂解气、裂化汽油等〕⑷ 含醛基的化合物〔醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等〕 ⑸ 天然橡胶〔聚异戊二烯〕 2、无机物:⑴ -2价的S 〔硫化氢及硫化物〕⑵ + 4价的S 〔二氧化硫、亚硫酸及亚硫酸盐〕 ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3+ 2FeBr 3 6FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 3 2FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2 ⑷ Zn 、Mg 等单质 如⑸ -1价的I 〔氢碘酸及碘化物〕变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O变色Mg + Br 2 === MgBr 2 〔其中亦有Mg 与H +、Mg 与HBrO 的反响〕△HBrO + Na2CO3 = NaBrO + NaHCO3三、能萃取溴而使溴水褪色的物质上层变无色的〔ρ>1〕:卤代烃〔CCl4、氯仿、溴苯等〕、CS2等;下层变无色的〔ρ<1〕:直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃〔如己烷等〕等四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴不饱和烃〔烯烃、炔烃、二烯烃等〕⑵不饱和烃的衍生物〔烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等〕⑶石油产品〔裂化气、裂解气、裂化汽油等〕⑷醇类物质〔乙醇等〕⑸含醛基的化合物〔醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等〕⑹天然橡胶〔聚异戊二烯〕⑺苯的同系物2、无机物:⑴氢卤酸及卤化物〔氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物〕⑵ + 2价的Fe〔亚铁盐及氢氧化亚铁〕⑶-2价的S〔硫化氢及硫化物〕⑷ + 4价的S〔二氧化硫、亚硫酸及亚硫酸盐〕⑸ 双氧水〔H 2O 2〕五、常见的各类有机物的官能团,构造特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 构造特点:键角为109°28′,空间正四面体分子。
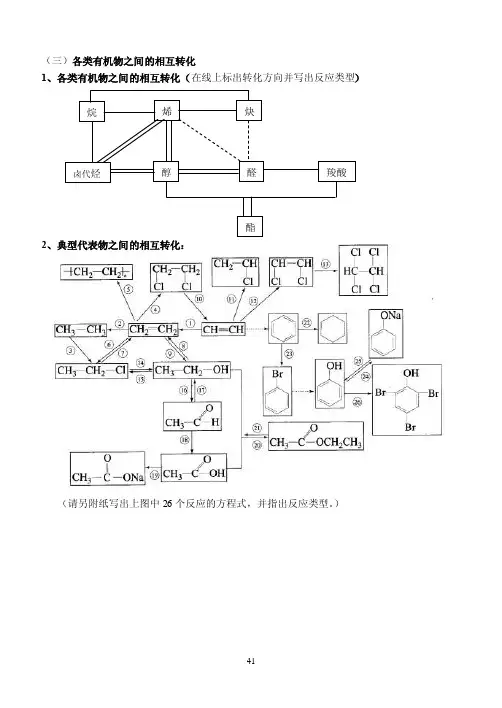
(三)各类有机物之间的相互转化1、各类有机物之间的相互转化(在线上标出转化方向并写出反应类型)2、典型代表物之间的相互转化:(请另附纸写出上图中26个反应的方程式,并指出反应类型。
)二、有机合成(一)有机合成的定义、过程及表达方式:1、定义:有机合成指利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
2、有机合成的过程:3、解题时的表达方式通常有两种:⑴按照设计的合成路线书写每步反应的化学方程式;⑵合成路线图(反应流程图)(二)合成方法:合成时通过基础反应(课本中的反应)及题中信息反应进行官能团的引入、消除、衍变、碳链的增减、官能团的保护等实现。
1、官能团的引入:⑴引入C =C 的方法:①②③④烷烃的热裂解和催化裂化⑵引入卤原子(一X )的方法:①②③⑶引入羟基(一OH )的方法:①②③④⑤醛氧化为羧酸。
A B C 反应物反应条件 反应物 反应条件 …… D……⑷碳碳三键的形成①二元卤代烃在强碱的醇溶液中消去2分子的HX②一元卤代烯烃在强碱的醇溶液中消去HX③实验室制备乙炔原理⑸苯环上官能团的引入:苯环上已有取代基的定位效应(题目往往会通过某种方式给出相关的信息,如:期中试卷1第19题)2、官能团的消除:⑴通过反应消除不饱和键;⑵通过、、、等消除羟基(一OH);⑶通过、等消除醛基(一CHO);⑷通过反应或反应可消除卤原子。
3、官能团间的衍变:⑴利用官能团的衍生关系进行衍变,如:醇→醛→酸⑵通过某种化学途径使一个官能团变为两个,如:CH3CH2OH→HOCH2CH2OH⑶通过某种手段,改变官能团的位置。
4、碳骨架的增减:⑴增长:有机合成题中碳链的增长,一般会以信息形式给出,如:HCN加成、卤代烃⑵变短:烃的裂化、裂解;某些烃(如苯的同系物、烯烃)的氧化,羧酸盐的脱羧反应等。
5、成环:⑴形成碳环:双烯成环(题给信息)⑵形成杂环:通过酯化反应形成环酯、通过成肽反应形成环肽6、官能团的保护:在有机合成中,某些不希望起反应的官能团,在反应试剂或反应条件的影响下产生副反应,这样就不能达到预计的合成目标,因此必须采取措施保护某些官能团,待完成反应后再除去保护基,使其复原。
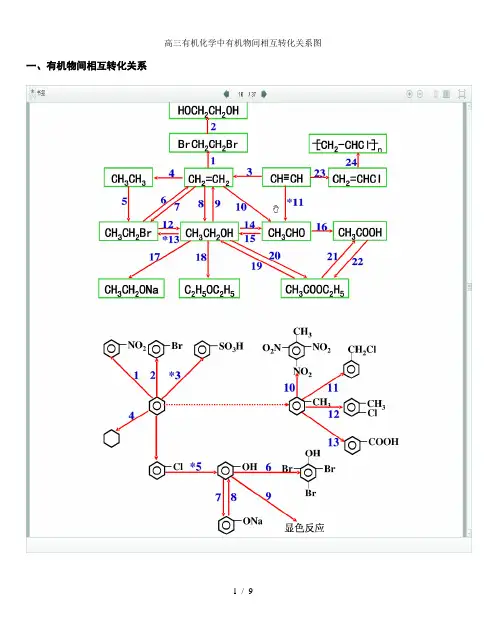
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的64 + 32 = 22(4)3 + 2362 + 32 = 43 + 2322 + 32 = 23 + 2I 2⑷ 、等单质 如⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ 等强碱、23和3等盐 2 + H 2O = +2 + 23 = 2 + 2↑+ H 2O + 23 = + 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(4、氯仿、溴苯等)、2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 + 2 2 (其中亦有与、与的反应) △2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的(亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:22;代表物:4B) 结构特点:键角为109°28′,空间正四面体分子。
CH 2 = CHCl —CH 2—CH — [ ]n | Cl CH 2—O —C = O | | CH 2—O —C = O CH CH CH 2—Br CH 2—Br | CHO CHO | COOH COOH | CH 2OH CH 2OH | CH 2 = CH 2 CH 3CH 2OH CH 3CHO CH 3COOH—CH 2—CH 2— [ ]n CH 3-CH 3 CH 3CH 2Cl CH 3COOCH 2CH 3 有机推断题的解题思路和技巧有机推断题的解题关键是寻找突破口;解题重点是官能团的定性、定量推断以及碳骨架的确定。
一、有机推断题的六大突破口突破口一:物质的转化关系 突破口二:物质的特征性质突破口三:反应的特征条件 突破口四:物质燃烧相关量突破口五:物质式量的展开 突破口六:题目所给的信息技巧:1、找信息量最大的点;2、找特殊分子式、特殊反应、特 殊颜色等;3、如果不能直接推断某物质,可以先假设几种可能,再认真论证。
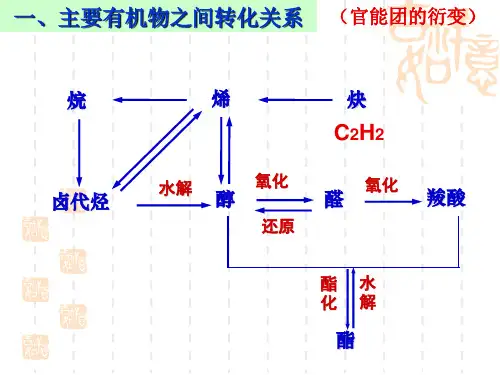
二、有机物的重要转化关系:(一)常见有机反应的特点:一般的:有机反应碳的骨架不变;有机反应碳原子数不变;反应官能团的位置不变;反应部位是官能团所在碳原子或者邻位碳原子。
(二)官能团的衍变通过某种途径使一个官能团变为两个,如:CH 3CH 2OH → HOCH 2CH 2OH ;通过某种途径可使官能团的位置改变,如CH 3CH 2CH 2OH → CH 3CHOHCH 3。
三、官能团的推断(一)、定性推断:1、据反应物性质确定官能团(1)与溴水反应:含碳碳双键、碳碳三键、醛基(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖)、酚羟基(2)与酸性高锰酸钾反应:含碳碳双键、碳碳三键、醛基、酚羟基、苯的同系物(3)与金属钠反应:醇羟基 、酚羟基、羧基(4)与NaOH 反应或在其催化下可以进行的反应:酚羟基、羧基、酯(油脂)的水解、卤代烃(5)与碳酸氢钠反应: 羧基(6)与Na 2CO 3反应:酚羟基 、羧基(7)与银氨溶液([Ag(NH 3)2]OH )反应:醛基(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖)(8)Cu(OH)2悬浊液:醛基(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖)、羧基、多元醇(9)使FeCl 3溶液显特殊颜色的:酚羟基(10)含氢量最高的有机物是:CH 4(11)一定质量的有机物燃烧,耗氧气量最大的是:CH4(12)完全燃烧时生成等物质的量的CO2和H2O的是:烯烃、环烷烃、饱和一元醛、酮、饱和一元羧酸、酯、葡萄糖(即符合通式C n H2n O x的物质)2、由反应条件确定官能团(1)浓硫酸加热:醇的消去、酯化反应、硝化、磺化(2)稀硫酸:酯的水解、二糖、多糖的水解(3)H2、催化剂(Ni ):加成(4)O2/Cu、加热:醇羟基氧化(5)Cl2(Br2)/Fe:苯环(6)Cl2(Br2)/光照:烷烃或苯环上烷烃基(7)NaOH条件一般反应有酸(或钠盐)生成。