热力学和动力学测验题
- 格式:doc
- 大小:78.50 KB
- 文档页数:2

大学物理(II )第12、13章测验试题专业 姓名 学号 (波尔兹曼参数:k=1.38×10-23J ·K -1; 摩尔气体常数:R=8.31J ·mol -1)一、单选题(共30分,每小题3分)1. 处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们( C )(A)温度、压强均不相同. (B)温度相同,但氦气压强大于氮气压强.(C)温度、压强都相同. (D)温度相同,但氦气压强小于氮气压强. 分析过程:由于分子平均平动动能相同,则温度T 相同; 又因分子数密度n 相同,由p=nkT ,所以p 相同2.三个容器A 、B 、C 中装有同种理想气体,其分子数密度n 相同,而方均根速率之比为()()()1/21/21/2222::1:2:4A B C v v v =,则其压强之比::A B C p p p 为( C ).(A)1:2:4 (B)1:4:8 (C)1:4:16 (D) 4:2:1 分析过程:已知 同种气体分子质量m 相同;n 也相同; 则由p=nkT 和方均根速率m kTv rms 3=可求解;3.在一个体积不变的容器中,储有一定量的某种理想气体,温度为T 0时,气体分子的平均速率为0v ,分子平均碰撞次数为0Z ,平均自由程为0λ,当气体温度升高为4 T 0时,气体分子的平均速率v ,分子平均碰撞次数Z ,平均自由程λ分别为( B ) (A) 0004,4,4v v Z Z λλ=== (B) 0002,2,v v Z Z λλ=== (C) 0002,2,4v v Z Z λλ=== (D) 0004,2,v v Z Z λλ===分析过程:由m kT v π8=知,02v v =; 由n v d Z 22π=知,02Z Z =; 由p d kT 22πλ=和PV=nkT ,又因为体积V 不变, 上式可变形为:n d V V nkT d kT2222ππλ==,则0λλ=4.已知n 为单位体积内的分子数,()f v 为麦克斯韦速率分布函数,则()nf v dv 表示( B )(A) 速率v 附近,dv 区间内的分子数(B) 单位体积内速率在v ~v+dv 区间内的分子数(C) 速率v 附近dv 区间内分子数占总分子数比率(D) 单位时间内碰到单位器壁上速率在v ~v+dv 区间内的分子数5.如图所示,bca 为理想气体绝热过程,b1a 和b2a 是任意过程,则上述两过程中气体做功与吸收热量的情况是( B )(A) b1a 过程放热,作负功;b2a 过程放热,做负功;(B) b1a 过程吸热,作负功;b2a 过程放热,做负功;(C) b1a 过程吸热,作正功;b2a 过程吸热,做负功; (D) b1a 过程放热,作正功;b2a 过程吸热,做正功; 分析过程:由⎰=pdv W 知,系统是做负功。

无机及分析化学第一次习题课习题一.选择题()1、Fe(OH)3 正溶胶在电场作用下,向负极移动的是A 胶核B 胶粒C 胶团D 反离子()2、分析铁矿石中Fe的含量4次,测得结果为1.61%,1.53%,1.54 %,1.83%.在置信度为90 %时,用Q检验法判断,查表Q0.90=0.76。
则A、1.53%为可疑值B、1.83%为可疑值C、无可疑值D、1.53%和1.83%均为可疑值( ) 3 . 试剂中含有微量被测组分会产生系统误差,消除的方法是:A.用化学方法除去微量被测组分B.作对照试验C.作空白试验D.加入掩蔽剂( ) 4. 反应3H2(g) +N2(g) = 2NH3(g) 的△rHθ< 0 ,欲增大正反应速率, 下列措施中无用的是A. 增加H2 的分压B.升温C. 减小NH3的分压D.加正催化剂( ) 5. 下列各组物理量中,全部是状态函数的是A. P Q VB. H U WC. U H GD. S △H △G( ) 6. 如果相对误差表示为: (40.31-40.28)/40.28 ,则按有效数字的运算规则,其结果应为A. 9.926×10-4B. 9.925 ×10-4C. 9.93×10-4D. 0.001 ( ) 7.A= B+C 是吸热的可逆反应,正反应的活化能是Ea(正), 逆反应的活化能是Ea(逆), 那么,Ea(正) 与Ea(逆) 的关系是A.等于B. 小于C. 大于D. 无法确定( ) 8.某温度下,反应2SO2(g) +O2(g) = 2SO3(g) 的平衡常数为K, 则同一温度下,反应SO3(g) = SO2 (g) +1/2O2(g) 的平衡常数为A.1/(Kθ)1/2B.Kθ/2C.1/KθD.2Kθ( ) 9.与拉乌尔定律有关的主要是A. 凝固点降低B.蒸汽压降低C. 沸点升高D.渗透压降低( ) 10.用因保存不当失去部分结晶水的草酸(H2C2O4.2H2O) 作基准物质来标定NaOH溶液的浓度,标定结果A. 偏高B. 偏低C. 准确D. 不确定( ) 11.CaO(s) +H2O(l) = Ca(OH)2(s),在298K及标准状态下反应自发进行,高温时其逆反应为自发,这表明该反应的类型是A. △rHmθ< O ,△rSmθ< OB. △rHmθ< 0 ,△rSmθ>0C. △rHmθ>O ,△rSmθ>0D. △rHmθ>0 ,△rSm θ< O( ) 12. 反应B→A ,B→C 的恒压热效应分别为△H1,△H2则反应C→A的恒压热效应为:A.△H1+△H2 B △H1-△H2 C.△H2-△H1 D.2△H1-2△H2( ) 13. 已知化学反应2H2(g) +2NO(g) = 2H2O(g) +N2(g) 速率方程式为V=KPH2P2NO. 则该反应的级数为A.1B.2C.3D.4( ) 14. 在恒压下,任何温度时都可自发进行的反应是A. △Hθ> 0 △Sθ< 0B.△Hθ< 0 △Sθ> 0C. △Hθ> 0 △Sθ> 0D.△Hθ< 0 △Sθ<0()15. A+B =C+D 是吸热的可逆反应,其中正反应的活化能为Ea(正), 逆反应的活化能为Ea(逆),则下列表述正确的是A.Ea(正) > Ea(逆)B.Ea(正) = Ea(逆)C.Ea(正) <Ea(逆)D.无法确定( ) 16. 下列物质中, 可用作基准物质的是A. NaOH(分析纯)B.HCl(分析纯)C. K2Cr2O7(化学纯)D.Na2B4O710H2O(分析纯)() 17. 在Pθ和373K 时H2O(g)→H2O(l) 体系中应是A.△H=0B. △S=0C.△G=0D.△U=0( ) 18.CuCl2(S) +Cu(S) =2 CuCl(S) △rHmθ=170kJ/molCu(s) +Cl2(g) = CuCl2(s) △rHmθ=206kJ/mol则CuCl(s) 的△fHmθ应为:A.36KJ/molB.18kJ/molC.-18KJ/molD.-36KJ/mol( ) 19.水的汽化热44.0KJ/mol则1.00mol水蒸气在100℃时凝聚为液态水的熵变A.118Jmol-1k-1B. 0C. -118Jmol-1k-1D.-59Jmol-1.k-1.( ) 20.一般说温度升高,反应速率明显增加,主要原因在于A. 反应物浓度增大B. 反应物压力增加C.活化能降低D. 活化分子百分率增加()21.PCl5分解反应为PCl5 PCl3 + Cl2在200℃达到平衡时,PCl5 有48℅分解;在300℃平衡时有97℅分解.则此反应是A. 放热反应B.吸热反应C. 既不放热也不吸热D. 可计算平衡常数为2( ) 22.对于一个确定的化学反应来说.下列说法正确的是A △rGmθ越负, 反应速率越快 B.△rHmθ越负,反应速率越快C.活化能越大, 反应速率越快D. .活化能越小, 反应速率越快( ) 23.反应2NO(g) +2H2 (g) →N2(g) +2H2O(g) 速率常数K的单位为L2.mol-2s-1则反应级数n是A. 0B. 1C. 2D.3( ) 24.下列叙述正确的是A. 非基元反应是有若干个基元反应组成的B. 凡速率方程中各物质浓度的指数等于反应式中其计量系数时,反应必为基元反应C. 反应级数等于反应物在方程式中计量系数之和D. 反应速率与反应物浓度成正比( ) 25.标准压力下,石墨燃烧反应△rHmθ=-393.7 KJ /mol 金刚石燃烧反应的焓变-395.6KJ/mol.则石墨转化为金刚石时反应的焓变为A. -789.3 KJ/molB. 0C. 1.9KJ/molD.- 1.9 KJ/mol二、简答题1. 可采用什么方法提高水的沸点?2. 为什么海水较河水难结冰?3. 海水鱼能生活在淡水中吗?为什么?4. 为什么施肥过多会将作物“烧死”?5. 凡是稀溶液的沸点都比纯溶剂高吗?为什么?为什么明矾能净水?7. 举例说明什么是状态函数,它的基本特征是什么?8. 热力学第一定律的适用条件是什么?9. 何谓化学反应热?定容热和定压热的关系如何?10. 什么是盖斯定律?盖斯定律在热化学中有何重要意义?11. 什么是吉布斯—亥姆霍兹方程,该方程对于判断反应的自发性有何意义。

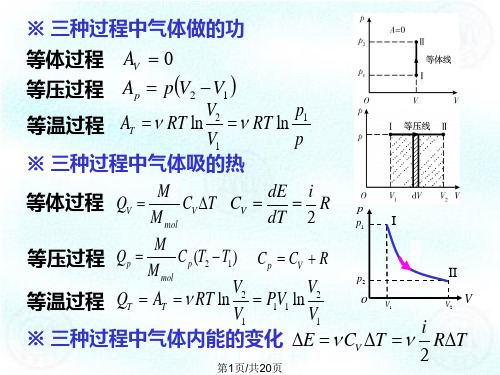
第二章化学热力学基础及化学平衡1. 有一活塞,其面积为60cm2,抵抗3atm的外压,移动了20cm,求所作的功。
(1)用焦耳;(2)用卡来表示。
2. 1dm3气体在绝热箱中抵抗1atm的外压膨胀到10dm3。
计算:(1)此气体所作的功;(2)内能的变化量;(3)环境的内能变化量。
3. 压力为5.1atm,体积为566dm3的流体,在恒压过程中,体积减少到1/2,(1)求对流体所作的功(2)求流体的内能减少365.75kJ时,流体失去的热量?4. 在一汽缸中,放入100g的气体。
此气体由于压缩,接受了2940kJ的功,向外界放出了2.09kJ的热量。
试计算每千克这样的气体内能的增加量。
5. 在1atm、100℃时,水的摩尔汽化热为40.67kJ⋅mol-1,求:1mol水蒸汽和水的内能差?(在此温度和压力下,水蒸汽的摩尔体积取作29.7dm3)6. 某体系吸收了3.71kJ的热量,向外部作了1.2kJ的功,求体系内部能量的变化。
7. 某体系作绝热变化,向外部作了41.16kJ的功,求此体系内能的变化量。
8. 有一气体,抵抗2atm的外压从10dm3膨胀到20dm3,吸收了1254J的热量,求此气体的内能变化?9. 一理想气体在恒定的一大气压下,从10dm3膨胀到16dm3,同时吸热125.4J的热量,计算此过程的∆U和∆H。
10. 在300K时3mol的理想气体等温膨胀,它的内压为8atm,抵抗2atm的恒压力作功,体积增加到4倍,试求W、Q、∆U和∆H。
11. 现有2dm3氮气在0℃及5atm下抵抗1atm的恒外压作等温膨胀,其最后的压力为1atm,假设氮气为理想气体,求此过程的W、∆U、∆H及Q。
12. 在1atm下,2molH2和1molO2反应,在100℃和1atm下生成2mol水蒸汽,总共放出了115.8kJ⋅mol-1热量。
求生成每摩尔H2O(g)时的∆H和∆U。
13. 在25℃和恒压下(1atm),1/2molOF2同水蒸气反应,反应式如下:OF2(g) + H2O(g) → O2(g) + 2HF(g)放出161.35kJ⋅mol-1的热量,试计算每摩尔OF2同水蒸气反应的∆H和∆U。

高考物理最新力学知识点之热力学定律经典测试题附答案(1) 一、选择题 1.下列说法中不正确的是( ) A.紫外线照射到金属锌板表面时能够产生光电效应,则当增大紫外线的照射强度时,从
锌板表面逸出的光电子的最大初动能不会发生改变 B.对于一定质量的某种理想气体,当其压强和体积不变时,内能一定不变
C.已知阿伏加德罗常数为NA,某气体的摩尔质量为M,密度为ρ(均为国际单位),则
1
个该气体分子的体积是A
M
N
D.在某些恒星内,3个α粒子结合成一个126C,126C原子的质量是12.0000u,42He原子核
的质量是4.0026u,已知1u=931.5MeV/c2,则此核反应中释放的核能约为7.3MeV 2.下列过程中可能发生的是( ) A.将两瓶不同液体混合,然后它们又自发地各自分开
B.利用其他手段,使低温物体温度更低,高温物体的温度更高
C.打开一高压密闭容器,其内气体自发溢出后又自发溢进去,恢复原状
D.某种物质从高温热源吸收20kJ的热量,全部转化为机械能,而没有产生其他任何影响
3.快递公司用密封性好、充满气体的塑料袋包裹易碎品,如图所示。假设袋内气体与外界没有热交换,当充气袋四周被挤压时,袋内气体
A.对外界做负功,内能增大
B.对外界做负功,内能减小
C.对外界做正功,内能增大
D.对外界做正功,内能减小
4.下列说法正确的是 A.物体吸收热量,其内能一定增加
B.不可能从单一热库吸收热量,使之完全变成功,而不产生其他影响
C.第二类永动机不能制成是因为违背了能量守恒定律
D.热量能够自发地从低温物体传递到高温物体
5.下列有关热学的叙述中,正确的是( ) A.同一温度下,无论是氢气还是氮气,它们分子速率都呈现出“中间多,两头少”的分布规
律,且分子平均速率相同 B.在绝热条件下压缩理想气体,则其内能不一定增加
C.布朗运动是指悬浮在液体中的花粉分子的无规则热运动
D.液体表面层分子间距离大于液体内部分子间距离,故液体表面存在张力

高考物理最新力学知识点之热力学定律经典测试题附解析(1)一、选择题1.下列说法正确的是()A.一个绝热容器中盛有气体,假设把气体中速率很大的如大于v的分子全部取走,则气体的温度会下降,此后气体中不再存在速率大于v的分子B.温度高的物体的分子平均动能一定大,内能也一定大C.气体压强的大小跟气体分子的平均动能、分子的密集程度、气体的重力都有关D.熵值越大,代表系统分子运动越无序2.如图表示一定质量的理想气体状态变化过程中的四个状态,图中ad平于横轴,dc平行于纵轴,ab的延长线过原点,以下说法不正确的是A.从状态d到c,气体体积增大,气体对外做功B.从状态c到b,气体体积减小,外界对气体做功C.从状态a到d,内能增加,气体从外界吸热D.从状态b到a,内能增加,气体对外界放热3.如图所示为一定质量的理想气体压强随热力学温度变化的图象,气体经历了ab、bc、cd、da四个过程。
其中bc的延长线经过原点,ab与竖直轴平行,cd与水平轴平行,ad与bc平行。
则气体在A.ab过程中对外界做功B.bc过程中从外界吸收热量C.cd过程中内能保持不变D.da过程中体积保持不变4.下列有关热学的叙述中,正确的是()A.同一温度下,无论是氢气还是氮气,它们分子速率都呈现出“中间多,两头少”的分布规律,且分子平均速率相同B.在绝热条件下压缩理想气体,则其内能不一定增加C.布朗运动是指悬浮在液体中的花粉分子的无规则热运动D.液体表面层分子间距离大于液体内部分子间距离,故液体表面存在张力5.如图所示的p-V图像, 1、2、3三个点代表某容器中一定量理想气体的三个不同状态,对应的温度分别是T1、T2、T3,用N1、N2、N3分别表示这三个状态下气体分子在单位时间内撞击容器壁上单位面积的次数,下列说法中正确的是()A.气体从1状态变化到2状态要放热,N1 > N2,T1>T2B.气体从2状态变化到3状态对外做功,吸热,N2= N3,T3>T2C.气体从3状态变化到1状态内能不变,放热,N1<N3,T1=T3D.以上说法都不对6.若通过控制外界条件,使图甲装置中气体的状态发生变化.变化过程中气体的压强p随热力学温度T的变化如图乙所示,图中AB线段平行于T轴,BC线段延长线通过坐标原点,CA线段平行于p轴.由图线可知A.A→B过程中外界对气体做功B.B→C过程中气体对外界做功C.C→A过程中气体内能增大D.A→B过程中气体从外界吸收的热量大于气体对外界做的功7.某同学将一气球打好气后,不小心碰到一个尖利物体而迅速破裂,则在气球破裂过程中( )A.气体对外界做功,温度降低B.外界对气体做功,内能增大C.气体内能不变,体积增大D.气体压强减小,温度升高8.关于热力学定律,下列说法正确的是()A.在一定条件下物体的温度可以降到0 KB.物体从单一热源吸收的热量可全部用于做功C.吸收了热量的物体,其内能一定增加D.压缩气体气体的温度一定升高9.重庆出租车常以天然气作为燃料,加气站储气罐中天然气的温度随气温升高的过程中,若储气罐内气体体积及质量均不变,则罐内气体(可视为理想气体)( )A.压强增大,内能减小B.吸收热量,内能增大C.压强减小,分子平均动能增大D .对外做功,分子平均动能减小10.根据热力学第二定律,下列说法中错误..的是( ) A .电流的电能不可能全部变成内能B .在火力发电中,燃气的内能不可能全部变为电能C .在热机中,燃气的内能不可能全部变为机械能D .在热传导中,热量不可能自发地从低温物体传递给高温物体11.如图所示,柱形容器内封有一定质量的空气,光滑活塞C (质量为m )与容器用良好的隔热材料制成。
高中物理-热力学定律测试题1、关于物体内能变化,下列说法中正确的是( )A 、物体吸收热量,内能一定增大B 、物体对外做功,内能一定减小C 、物体吸收热量,同时对外做功,内能可能不变D 、物体放出热量,同时对外做功,内能可能不变【解析】根据热力学第一定律,A 选项不知做功情况,故不正确;B 选项不知吸热情况,也不正确;D 选项做功和热传递均耗费内能,不正确.所以正确选项为C .【答案】C2、下列说法正确的是( )A 、热传导具有方向性B 、机械能和内能的转化具有方向性C 、气体的扩散现象具有方向性D 、能量耗散是从能的转化角度反映出自然界中的宏观过程具有方向性【解析】由热力学第二定律可知:自然界中进行的涉及热现象的宏观过程都具有方向性.【答案】ABCD3、1997年诺贝尔物理学奖授予朱棣文等3人,以表彰他们在激光冷却和捕捉原子的方法上所作出的贡献.目前已应用激光将原子的温度冷却到K 1210-的数量级,已经非常接近K 0,下列关于“K 0”的说法中正确的是( )A 、K 0即c ︒0,随着科学的发展是可以达到的B 、K 0即c ︒0,只能无限接近,但不可能达到C 、K 0即绝对零度,随着科学的发展是可以达到的D 、K 0即绝对零度,只能无限接近,但不可能达到【解析】K 0是热力学零度,也叫绝对零度,绝对零度是不可达到的,所以正确选项为D .【答案】D4、在温度均匀的水池中,一个小气泡由水底缓慢地上升到水面,上升过程中气泡的体积不断增大,则气泡在浮起过程中( )A 、放出热量B 、吸收热量C 、不吸热也不放热D 、无法判断【解析】气泡在上升过程中体积增大,对外做功,所以内能减小,温度降低,但由于缓慢上升,有足够的时间与外界热交换——吸收热量.【答案】B5、(高考全国卷)如图8-2-3中活塞将汽缸分成甲、乙两气室,汽缸、活塞(连同拉杆)是绝热的,且不漏气.以甲E 、乙E 分别表示甲、乙两气室中气体的内能,则在将拉杆缓慢向外拉的过程中( )A 、甲E 不变,乙E 减小B 、甲E 增大,乙E 不变C 、甲E 增大,乙E 减小D 、甲E 不变,乙E 不变 【解析】因两气室、汽缸、活塞(连同拉杆)是绝热的,即不存在两气室、外界之间的热交换.当将拉杆缓慢向外拉的过程中,乙气室中的气体对外做功,乙E 减小;活塞对甲气室中的气体做功,甲E 增大,故C 选项正确.【答案】C图8-2-36、一钢筒内装有压缩气体,当打开阀门后,气体迅速从阀门冲出,很快筒内气体的压强与大气压强0p 相同,然后立即关闭阀门,如果钢瓶外部环境温度保持不变,则经较长时间后筒内气体的压强( )A 、等于0pB 、大于0pC 、小于0pD 、无法判定【解析】打开阀门后,气体迅速从阀门冲出,对外做功,内能减小,温度降低,立即关闭阀门(此时气体的压强已与外界大气压强相同),经较长时间热传递,气体温度重新升高,压强增大.故B 选项正确.【答案】B7、用酒精灯加热试管中的水,使水沸腾,水蒸气会把原先塞住的软木塞冲开,从能的转化角度看,加热使水沸腾是 能转化为水的内能;水蒸气把软木塞冲开,是把 转化为 能.【答案】化学能;内能;机械能8、物体在水平地面运动,当它的速度由s m /9减小到s m /7的过程中,减少的动能全部转化为物体的内能.如果物体继续运动,又有一部分动能转化为与上述等量的内能,这时物体的速度是 s m /.【解析】由能的转化和守恒可知:222221721721921mv m m m U -⨯=⨯-⨯=∆,解得)/(17s m v = 【答案】s m /179、一定质量的气体从外界吸收了J 5102.4⨯的热量,同时气体对外做J 5100.6⨯的功,问:(1)气体的内能变化了多少?(2)分子势能是增加还是减少?(3)分子动能如何变化?【解析】(1)气体从外界吸收热量J Q 5102.4⨯=,对外做功J W 5106⨯-=,根据热力学第一定律Q W U +=∆可得:J U 5108.1⨯-=∆,所以气体的内能减少了J 5108.1⨯.(2)因为气体对外做功,体积膨胀,分子间距离增大了,分子力做负功,所以分子势能增加.(3)气体内能减少了,而气体的分子势能增加了,所以分子动能一定减少,且分子动能的减少量大于分子势能的增加量.10、一质量kg M 2=的木块,放在高m h 8.0=的光滑桌面上,被一个水平方向飞来的子弹打落在地面上(子弹留在木块中),落地点与桌边的水平距离m s 6.1=,子弹的质量g m 10=,试求:(1)子弹击中木块时的速度(2)子弹射入木块时产生的热量若90% 被子弹吸收,子弹的温度升高多少?(设子弹的比热为c kg J ︒⋅⨯/1078.32,取2/10s m g =,空气阻力不计)【解析】(1)由平抛运动规律可求得子弹打入木块后的速度s m g hsv t /42==,以子弹、木块为系统,水平方向不受外力,动量守恒 t v m M mv )(0+=,即子弹的初速s m mv m M v t /804)(0=+=. (2)碰撞中系统损失的机械能转化为内能)(2)(212120220m M Mmv v m M mv E t +=+-=∆,该能量的90% 被子弹吸收升温,则t cm m M Mmv ∆=+)(29.020,子弹升高的温度c m M c Mv t ︒⨯=+=∆2201067.7)(29.0. 【答案】(1)s m /804(2)c ︒⨯21067.7。
高考物理力学知识点之热力学定律基础测试题附答案(3)一、选择题1.如图所示,一定质量的理想气体从状态a开始,经历ab、bc、cd、de四个过程到达状态e,其中ba的延长线经过原点,bc连线与横轴平行,de连线与纵轴平行。
下列说法正确的是()A.ab过程中气体分子热运动平均动能增加B.bc过程中气体分子单位时间内击容器壁次数不变C.cd过程中气体从外界吸热小于气体内能增量D.de过程中气体对外放出热量,内能不变2.下列说法正确的是()A.决定封闭理想气体压强大小的是,分子密集程度和分子的平均动能B.决定理想气体压强的是,分子平均动能和分子种类C.质量相同的0C︒的水和0C︒的冰具有相同的内能D.一定质量的理想气体绝热自由膨胀过程,内能一定减少3.如图所示的p-V图像, 1、2、3三个点代表某容器中一定量理想气体的三个不同状态,对应的温度分别是T1、T2、T3,用N1、N2、N3分别表示这三个状态下气体分子在单位时间内撞击容器壁上单位面积的次数,下列说法中正确的是()A.气体从1状态变化到2状态要放热,N1 > N2,T1>T2B.气体从2状态变化到3状态对外做功,吸热,N2= N3,T3>T2C.气体从3状态变化到1状态内能不变,放热,N1<N3,T1=T3D.以上说法都不对4.若通过控制外界条件,使图甲装置中气体的状态发生变化.变化过程中气体的压强p随热力学温度T的变化如图乙所示,图中AB线段平行于T轴,BC线段延长线通过坐标原点,CA线段平行于p轴.由图线可知A.A→B过程中外界对气体做功B.B→C过程中气体对外界做功C.C→A过程中气体内能增大D.A→B过程中气体从外界吸收的热量大于气体对外界做的功5.下列说法正确的是()A.布朗运动就是液体分子的热运动B.在实验室中可以得到-273.15℃的低温C.一定质量的气体被压缩时,气体压强不一定增大D.热量一定是从内能大的物体传递到内能小的物体6.如图所示,用两种不同的金属丝组成一个回路,接触点1插在一杯热水中,接触点2插在一杯冷水中,此时灵敏电流计的指针会发生偏转,这就是温差发电现象,根据这一现象,下列说法中正确的是( )A.这一过程违反了热力学第二定律B.这一过程违反了热力学第一定律C.热水和冷水的温度将发生变化D.这一过程违反了能量守恒定律7.下列说法正确的是()A.气体的温度升高,分子动能都增大B.功可以全部转化为热,但吸收的热量一定不能全部转化为功C.液晶显示器利用了液晶的光学性质具有各向异性的特点D.凡是符合能量守恒定律的宏观过程一定自发地发生而不引起其他变化8.关于物体内能的变化情况,下列说法中正确的是( )A.吸热的物体,其内能一定增加B.绝热压缩的物体,其内能一定增加C.放热的物体,其内能一定减少D.体积膨胀的物体,其内能一定减少9.如图所示,在大口的玻璃瓶内装一些水,水的上方有水蒸气。
高考物理专题力学知识点之热力学定律经典测试题附答案一、选择题1.如图所示,水平放置的封闭绝热气缸,被一锁定的绝热活塞分为体积相等的a、b两部分。
已知a部分气体为1mol氧气,b部分气体为2 mol氧气,两部分气体温度相等,均可视为理想气体。
解除锁定,活塞滑动一段距离后,两部分气体各自再次达到平衡态时,它们的体积分别为V a、V b,温度分别为T a、T b。
下列说法正确的是A.V a>V b, T a>T b B.V a>V b, T a<T bC.V a<V b, T a<T b D.V a<V b, T a>T b2.给一定质量、温度为的水加热,在水的温度由上升到的过程中,水的体积随着温度升高反而减小,我们称之为“反常膨胀”某研究小组通过查阅资料知道:水分子之间存在一种结合力,这种结合力可以形成多分子结构,在这种结构中,水分子之间也存在相互作用的势能在水反常膨胀的过程中,体积减小是由于水分子之间的结构发生了变化,但所有水分子间的总势能是增大的关于这个问题的下列说法中正确的是A.水分子的平均动能减小,吸收的热量一部分用于分子间的结合力做正功B.水分子的平均动能减小,吸收的热量一部分用于克服分子间的结合力做功C.水分子的平均动能增大,吸收的热量一部分用于分子间的结合力做正功D.水分子的平均动能增大,吸收的热量一部分用于克服分子间的结合力做功3.二氧化碳是导致“温室效应”的主要原因之一,人类在采取节能减排措施的同时,也是在研究控制温室气体的新方法,目前专家们正在研究二氧化碳的深海处理技术.在某次实验中,将一定质量的二氧化碳气体封闭在一个可以自由压缩的导热容器中,将容器缓慢移到海水某深处,气体体积减小为原来的一半,温度逐渐降低.此过程中()A.封闭的二氧化碳气体对外界做正功B.封闭的二氧化碳气体压强一定增大C.封闭的二氧化碳气体分子的平均动能增大D.封闭的二氧化碳气体一定从外界吸收热量4.一定质量的理想气体在某一过程中,气体对外界做功1.6×104J,从外界吸收热量3.8×104J,则该理想气体的()A.温度降低,密度减小B.温度降低,密度增大C.温度升高,密度减小D.温度升高,密度增大5.如图所示为一定质量的理想气体压强随热力学温度变化的图象,气体经历了ab、bc、cd、da四个过程。
第二章 均相反应动力学习题1. 【动力学方程形式】有一气相反应,经实验测定在400℃下的速率方程式为:23.66A A dP P dt= 若转化为2(/.)A kC A r mol hl =形式,求相应的速率常数值及其单位。
2. [恒温恒容变压定级数]在恒容等温下,用等摩尔H 2和NO 进行实验,测得如下数据: 总压(MPa )0.0272 0.0326 0.038 0.0435 0.0543 半衰期(s ) 256 186 135 104 67 求此反应级数3.[二级反应恒容定时间]4.醋酸和乙醇的反应为二级反应,在间歇反应反应器中,5min 转化率可达50%,问转化率为75%时需增加多少时间?4、【二级恒容非等摩尔加料】溴代异丁烷与乙醇钠在乙醇溶液中发生如下反应: i-C 4H 9Br+C 2H 5Na →Na Br+i-C 4H 9 OC 2H 5(A)(B) (C) (D)溴代异丁烷的初始浓度为C A0=0.050mol/l 乙醇钠的初始浓度为C B0=0.0762mol/l,在368.15K 测得不同时间的乙醇钠的浓度为:t(min) 0 5 10 20 30 50 C B (mol/l) 0.0762 0.0703 0.0655 0.0580 0.0532 0.0451已知反应为二级,试求:(1)反应速率常数;(2)反应一小时后溶液中溴代异丁烷的浓度;(3)溴代异丁烷消耗一半所用的时间。
5. [恒温恒容变压定级数]二甲醚的气相分解反应CH 3OCH 3 → CH 4 +H 2 +CO 在恒温恒容下进行,在504℃获得如下数据:t (s ) 0 390 777 1195 3155 ∞Pt ×103(Pa ) 41.6 54.4 65.1 74.9 103.9 124.1试确定反应速率常数和反应级数6.[恒温恒压变容定常数]气体反应2A→B,经测定该反应为一级,压力保持不变,组分A为80%,惰性物为20%,三分钟后体积减小了20%,求反应速率常数。
化学原理模块课堂测验
1、可逆反应:C(s)+H2O(g)⇄ CO(g)+H2(g) Δr H mΘ>0。
下列说法你认为对否?为什么?
(1)达平衡时各反应物和生成物的分压一定相等;
(2)改变生成物的分压,使Q<KΘ,平衡将向右移动;
(3)升高温度使ν正增大、ν逆减小,故平衡将向右移动;
(4)由于反应前后分子数目相等,所以增加压力对平衡无影响;
(5)加入催化剂使ν正增加,故平衡将向右移动。
(6)有利于产物实现最大转化率的措施是高温低压。
2、反应N2(g)+3H2(g)==2NH3(g),Δr H mθ=-92kJ·mol-1已达平衡。
下列操作对N2生成NH3的转化率有何影响?说明理由。
(1)压缩混合气体
(2)升高温度
(3)恒压下引入惰性气体
(4)恒容下引入惰性气体
3、反应CaCO3⇄CaO(s)+CO2(g)在1123K 时,Kθ=0.489。
试确定密闭容器中,下列情况下反应进行的方向,写出判断的依据。
(1)只有CaO 和CaCO3;
(2)只有CaO 和CO2,且p(CO2)=10kPa;
(3)有CaCO3、CaO、CO2,且p(CO2)=10kPa;
4、判断下列说法是否正确?为什么?
(1)因为Δr G mΘ=-RTlnKΘ,所以温度升高,平衡常数减小。
(2)平衡常数和转化率都能表示反应进行的程度,但平衡常数与浓度无关,而转化率与浓度有关。
(3)反应N2(g)+3H2(g)⇄2NH3(g),KΘ=0.63。
达平衡时若再通入一定量N2(g),则KΘ、Q、Δr G mΘ的关系为:Q<KΘ,Δr G mΘ<0。
5、已知在标准态、0℃时,冰H2O(s)的摩尔熔解热为6.02kJ•mol-1。
冰在正常熔点熔化:
H2O(s)===H2O(l),试计算在熔点时,反应的Δr H mθ、KΘ、Δr G mθ、Δr S mθ、Δr G m值。
6、已知298K时,Br2(g)的标准摩尔生成焓Δf H mθ和标准生成吉布斯自由能Δf G mθ分别为30.71 kJ·mol-1和3.142 kJ·mol-1,试求:
(1)Br2(l)的正常沸点;
(2)298K时反应Br2(l)=== Br2(g)的标准平衡常数;
(3)298K时Br2(g)的饱和蒸汽压;
7.判断下列说法是否正确?简单说明理由。
(1).系统从始态到终态可以有不同的途径,其热(Q)与功(W)各不相等,但是Q-V相等;
(2).反应的焓变就是反应热;
(3)石墨态碳标准摩尔燃烧焓就是同温度下CO2(g)的标准摩尔生成焓;
(4)H2O(g)的标准摩尔生成焓就是同温度下H2(g)的标准摩尔燃烧焓;
(5)任何自发过程的熵变∆S必大于零;
(6)等温不可逆过程的∆S 不等于过程的Q/T ;
(7)恒温下密闭容器中自动进行的反应,方向是使反应的吉布斯自由函数降低;
(8)在某温度下反应的标准摩尔吉布斯函数变∆rGm0(T )> 0 ,则该反应绝不可能在该温度下发生;
(10)任何化学反应,化学计量方程式写法不同,在同样温度下的K0(T )不相等,但互成一定关系;
(11)∆rGm (T )> 0的反应,可以不改变其温度和压力条件,通过催化剂使反应发生; (12)A+B=C 类型的反应,实测为二级反应,则其是双分子反应;
(13).温度增加使反应速度加快,主要是影响了速率常数k ,而催化剂使反应速率加快,则主要是降低了活化能。
8.对于反应2NO + 2H 2N 2 + 2H 2O ,ΔH <0,其反应历程被认为是由如下基
元反应组成的过程:
2222(1)2NO+H N +H O ()(1)r m H θ
−−→∆慢
2222(2)H O +H 2H O()
(2)r m H θ−−→∆快 则下列说法正确的是:( )
A .
(1)0
r m H θ
∆> B .
(2)0
r m H θ
∆>
B . D .
9.在室温下,测定反应S 2O 82- + 3I -2SO 42- + I 3-在各反应物以不同浓度组成时
的反应速率,数据如下:
试回答下列问题:
(1) 写出上述反应的速率方程,计算在该温度条件下的反应速率常数,并判断该反应是
否可能为基元反应。
(2) θ
请判断该反应是吸热反应还是放热反应,并说明理由。