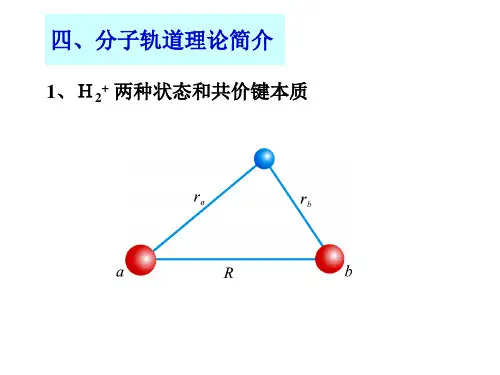
2-7 分子轨道理论
- 格式:ppt
- 大小:2.09 MB
- 文档页数:58


分子轨道理论简介一种理论,是原子轨道理论对分子的自然推广。
其基本观点是:物理上存在单个电子的自身行为,只受分子中的原子核和其他电子平均场的作用,以及泡利不相容原理的制约;数学上则企图将难解的多电子运动方程简化为单电子方程处理。
因此,分子轨道理论是一种以单电子近似为基础的化学键理论。
描写单电子行为的称轨道(或轨函),所对应的单电子能量称。
对于任何分子,如果求得了它的系列分子轨道和能级,就可以像讨论那样讨论分子结构,并联系到分子性质的。
有时,即便根据用粗糙的计算方案所得到的部分近似分子轨道和能级,也能分析出很有用处的定性结果。
理论⒈原子在形成分子时,所有电子都有贡献,分子中的电子不再从属于某个原子,而是在整个分子空间范围内运动。
在分子中电子的空间可用相应的分子轨道ψ(称为分子轨道)来描述。
分子轨道和原子轨道的主要区别在于:⑴在原子中,电子的运动只受1个原子核的作用,原子轨道是单核系统;而在分子中,电子则在所有原子核势场作用下运动,分子轨道是多核系统。
⑵原子轨道的名称用s、p、d…符号表示,而分子轨道的名称则相应地用σ、π、δ…符号表示。
⒉分子轨道可以由分子中原子轨道波函数的线性组合(linearcombinationofatomicorbitals,LCAO)而得到。
有几个原子轨道就可以可组合成几个分子轨道,其中有一部分分子轨道分别由对称性匹配的两个原子轨道叠加而成,两核间电子的概率密度增大,其能量较原来的原子轨道能量低,有利于成键,称为成键分子轨道(bondingmolecularorbital),如σ、π轨道(轴对称轨道);同时这些对称性匹配的两个原子轨道也会相减形成另一种分子轨道,结果是两核间电子的概率密度很小,其能量较原来的原子轨道能量高,不利于成键,称为反键分子轨道(antibondingmolecularorbital),如σ*、π*轨道(轨道,反键轨道的符号上常加"*"以与区别)。
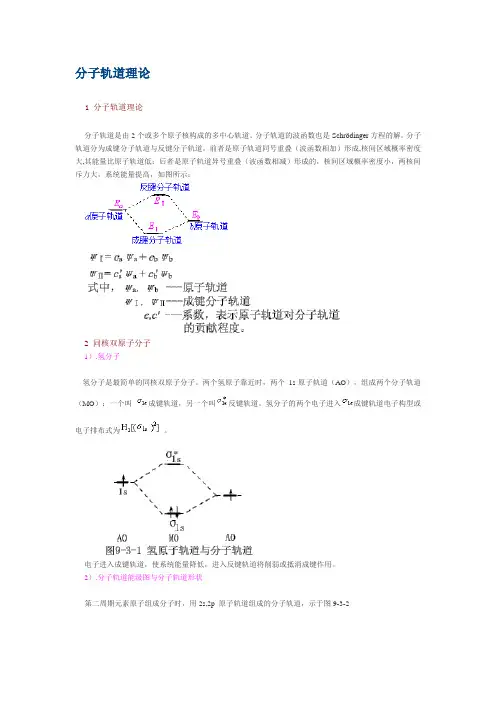
分子轨道理论1 分子轨道理论分子轨道是由2个或多个原子核构成的多中心轨道。
分子轨道的波函数也是Schrödinger方程的解。
分子轨道分为成键分子轨道与反键分子轨道,前者是原子轨道同号重叠(波函数相加)形成,核间区域概率密度大,其能量比原子轨道低;后者是原子轨道异号重叠(波函数相减)形成的,核间区域概率密度小,两核间斥力大,系统能量提高,如图所示:2 同核双原子分子1).氢分子氢分子是最简单的同核双原子分子。
两个氢原子靠近时,两个1s原子轨道(AO),组成两个分子轨道(MO):一个叫成键轨道,另一个叫反键轨道。
氢分子的两个电子进入成键轨道电子构型或电子排布式为。
电子进入成键轨道,使系统能量降低,进入反键轨道将削弱或抵消成键作用。
2).分子轨道能级图与分子轨道形状第二周期元素原子组成分子时,用2s,2p 原子轨道组成的分子轨道,示于图9-3-2由图可见,分子轨道的数目等于用于组合原子轨道数目。
两个2s原子轨道组成两个分子轨道和,6个2p原子轨道组成6个分子轨道,其中两个是σ分子轨道(和)4个是π分子轨道(两个和两个)。
相应的原子轨道及分子轨道的形状如图下所示。
由图可见:●成键轨道中核间的概率密度大,而在反键轨道中,则核间的概率密度小。
●一对2p z 原子轨道以“头碰头”方式组合形成分子轨道,时,电子沿核间联线方向的周围集中;一对2p x(2p y)原子轨道以“肩并肩”方式组合形成分子轨道,时,电子分布在核间垂直联线的方向上。
3).氧分子O2共有16个电子,O2的电子构型:O2分子有两个自旋方式相同的未成对电子,这一事实成功地解释了O2的顺磁性。
O2中对成键有贡献的是(σ2p)2和(π2p)4这3 对电子,即是一个σ键和两个π键。
O2的两个π键是三电子π键,反键轨道中的一个电子削弱了键的强度,一个三电子π键相当于半个键,故O2的叁键实际上与双键差不多。
4).氮分子N2的分子轨道能级图与O2比较,只是在和的相互位置有区别。

第11卷 第6期大 学 化 学1996年12月常见的分子轨道图李 平 赵桂兰 郭承育(青海师范大学化学系 西宁810008) 摘要 用严格的计算机程序,绘出了常见的严格意义上的各类分子轨道图,包括Ρ、Π、∆键等的轨道图。
并从周期律出发,讨论了它们与物质性质间的有趣联系。
分子轨道理论是当代化学键理论中最重要的部分,分子轨道的求解和讨论是量子化学的重要内容,分子轨道图形的绘制和解释则是理解化学键和分子的物理化学性质的重要手段。
国外早有专著[1]介绍,国内也早有学者从事这方面工作[2,3]。
现有的量子化学、结构化学方面的专著和教材,已注意到这方面的应用,但一般限于定性示意图,或者是平面等值图。
常见的各种典型的化学键图常不一致,使教学和科研第一线的师生深感困惑。
作者利用自编的分子波函数等值面投影图绘制程序[4,5],完成了氢原子和多电子原子的原子轨道图及简单反应过程的分子轨道图的绘制[6-9],近期又在周期律指导下,系统地绘制了各类典型分子轨道图和化学键图。
应当说明的是,各类分子轨道图形中,只有界面图的形状和大小是唯一的,得到多数人公认,称其为轨道图。
界面是等值面中的一种,该面内电子出现几率较大,在90%以上。
为了统一,我们取90±1%。
绘制分子轨道图,必须知道分子几何及分子轨道的具体形式。
一、 各种杂化原子轨道图 当由原子轨道组成分子轨道时,同一原子往往有两个以上的原子轨道参加,或者说是由杂化原子轨道参与形成化学键。
常见的杂化轨道有sp、sp2、sp3、d sp2、d sp3、d2sp3等。
作者绘制了sp、sp2、sp3杂化轨道平面等值图,发现它们形状都相似,例如,图1(a)、(b)、(c)为C原子sp、sp2、sp3杂化轨道的平面等值图,它们的形状都相似,只是随着p轨道成分的增加,左边虚线部分逐渐增加,更趋向于p轨道的形状。
图上数值为波函数Ω值,实线Ω为正,虚线Ω为负(下面各图皆如此)。


什么是分子轨道理论
分子轨道理论(Molecular Orbital Theory,简称MO理论)是1932年由美国化学家马利肯(R.S.Mulliken)及德国物理学家洪特(F.Hund)提出的一种描述多原子分子中电子所处状态的方法。
该理论认为原子形成分子后,电子不再属于个别的原子轨道,而是属于整个分子的分子轨道,分子轨道是多中心的。
分子轨道由原子轨道组合而成,形成分子轨道时遵从能量近似原则、对称性一致(匹配)原则、最大重叠原则,即通常说的“成键三原则”。
在分子中电子填充分子轨道的原则也服从能量最低原理、泡利不相容原理和洪特规则。
以上信息仅供参考,建议查阅化学专业书籍文献或咨询化学专业人士获取更全面更准确的信息。

分子轨道理分子轨道是描述分子中电子运动状态的波函数。
主要有4种类型的分子轨道:σ轨道、π轨道、非键轨道和反键轨道。
这些轨道的形状和能量级别决定了分子中电子的排布和化学性质。
下面将详细介绍这几种分子轨道的特征和相关理论。
首先是σ轨道。
σ轨道是分子中电子云最密集的轨道,具有球对称的形状。
它沿着化学键的轴向分布,所以也被称为轴向轨道。
σ轨道可以由两个原子轨道叠加而成,每个原子提供一个电子。
根据平面对称性的不同,σ轨道可以分为σ-s和σ-p轨道,前者为电子密度在分子中心沿轴向对称的轨道,后者为电子密度在分子平面中的两个方向上对称的轨道。
σ轨道主要参与形成化学键,是稳定的分子轨道。
接下来是π轨道。
π轨道具有两个相互垂直的环面,分别在化学键的上、下两侧。
与σ轨道不同,π轨道是运动在较大空间范围内的,所以也被称为侧向轨道。
π轨道可以由两个平行的原子轨道叠加而成,每个原子提供一个电子。
根据能级的不同,π轨道可以细分为π-s和π-p轨道,两者的电子密度在平面内的分布形式不同。
π轨道在化学键的形成中起到重要作用,决定了分子的共轭结构和反应性质。
非键轨道是分子中存在于原子之间的轨道。
它们是离域的电子轨道,不通过化学键与特定原子相关联。
非键轨道的能量相对较高,电子密度较低。
由于非键轨道的存在,分子可以吸收外部能量激发电子至非键轨道,从而进行各种光化学和电化学反应。
反键轨道与化学键中的σ和π轨道相对应,具有相同的空间分布形式,但电子的运动方向相反。
反键轨道的能级相对较高,电子密度较低。
它们主要参与分子中电子的排斥和共振现象,以及反应中的电荷转移。
分子轨道理论是通过量子力学的计算方法和原理来描述分子中电子的分布和运动状态,为解释分子光谱和化学反应提供了依据。
根据分子轨道理论,可以计算分子轨道的能级、形状和电子密度,并预测分子的化学性质。
分子轨道理论的成功应用包括描述分子的电子结构、解释分子间相互作用、预测分子的稳定性和反应性,以及设计新的功能分子。

分子轨道理
分子轨道理论是一种解释分子化学性质的理论,主要应用于复杂化学物质的计算和设计。
该理论结合量子力学和分子对称性理论,通过对分子中原子轨道的组合和相互作用的分析,得出分子轨道能级和电子分布,进而预测分子性质及其反应活性。
其主要内容包括:
1. 原理:分子轨道理论的核心原理是“波函数线性组合原理”,即分子轨道是由原子轨道按照一定的线性组合方式组成的。
线性组合系数称为“分子轨道系数”。
2. 能级:分子轨道能级是由原子轨道相互作用而形成的,其数目等于参与组合的原子轨道数目。
能级顺序和大小与分子轨道系数及原子轨道能级之间的相互作用有关。
3. 分子轨道类型:根据分子轨道能级和分子轨道系数的不同,分子轨道可分为sigma(σ)轨道、pi(π)轨道、delta(δ)轨道等。
4. 分子轨道的对称性:分子对称性对分子轨道的能级和分子性质有很大影响。
相同对称性的原子轨道组合会形成对称性相同的分子轨道。
5. MO图解:MO图是分子轨道理论的重要表述方式,用于描述分子中电子的能级和分布情况。
其结构为横坐标为分子轨道能级,纵坐标为分子轨道系数的坐标轴。
6. 应用:分子轨道理论可应用于物理、化学、生物等领域,如
化学反应机理、分子光谱学、药物设计等。
7. 限制和局限:分子轨道理论适用于与原子轨道相似的分子,但对于复杂分子和高能态的描述有一定局限性。

分子轨道理论1. 引言分子轨道理论是化学中的一种重要理论,它用量子力学的原理解释了分子的电子结构和化学性质。
本文将介绍分子轨道理论的基本概念、应用以及相关的计算方法。
2. 基本概念2.1 原子轨道在分子轨道理论中,首先要了解的是原子轨道。
原子轨道是描述单个原子中电子运动的波函数。
根据量子力学的原理,一个原子可以存在多个不同的原子轨道,每个原子轨道都对应着不同的能量状态。
2.2 分子轨道当两个或更多个原子靠近形成化学键时,原子轨道会互相重叠,形成新的分子轨道。
分子轨道描述的是电子在整个分子中的运动状态。
根据分子轨道理论,分子轨道可以分为两类:成键分子轨道和反键分子轨道。
成键分子轨道对应着电子的主要分布区域,而反键分子轨道则对应着电子分布相对较少的区域。
2.3 分子轨道能级分子轨道能级与原子轨道能级类似,分子轨道的能量随着轨道的能级增加而增加。
有时,分子轨道能级之间会有一定的能隙,这种能隙反映了分子稳定性的特征。
3. 分子轨道的应用分子轨道理论可以解释大量的化学现象和性质,下面列举了几个常见的应用:3.1 化学键的形成分子轨道理论提供了解释化学键产生的机制。
当两个原子靠近并形成化学键时,原子轨道会发生线性组合形成分子轨道。
通过分子轨道理论,我们可以理解不同类型的化学键(如共价键、离子键和金属键)是如何形成的以及其性质的差异。
3.2 分子轨道的能级顺序分子轨道理论还可以预测分子轨道的能级顺序,从而解释分子的化学性质。
能级较低的分子轨道通常具有较高的稳定性,从而决定了分子的化学反应性质。
3.3 分子光谱在分子光谱中,分子轨道理论被广泛应用。
分子轨道理论可以解释分子在吸收或发射光的过程中所发生的能级跃迁,从而解释不同光信号的产生和分子结构的变化。
4. 分子轨道的计算方法4.1 原子轨道模型著名的原子轨道计算方法包括Hartree-Fock方法和密度泛函理论。
这些方法通过求解原子的薛定谔方程,得到原子轨道及其能量。

分子轨道理论价键理论、杂化轨道理论虽能较好地说明共价键形成的本质和分子的空间构型,但由于其都是以电子配对为基础的,只考虑形成共价键的电子,而未将分子看成是一个整体,因此在应用中有其局限性。
按照价键理论,O 2分子的路易斯电子式是..O O ......,分子中应该没有成单电子,但是测定其磁性,表明氧为顺磁性物质,液态氧和固态氧极易为磁铁所吸引,故O 2分子中应该有成单电子。
高温下的B 2分子虽具有偶数的价电子,但它也是顺磁性物质。
而H 2+、O 2+、NO 、NO 2等奇数电子分子或离子也能够稳定存在。
这些事实,价键理论无法加以解释。
1932年,美国密立根和洪特等人提出了分子轨道理论(molecular orbital theory ,简称MO 法)。
该理论以量子力学为基础,把原子电子层结构的主要概念,推广到分子体系中去,很好地说明了上述实验事实,从另一个方面揭示了共价分子形成的本质。
1.分子轨道理论的基本要点 ⑴ 分子轨道理论认为,分子中的电子不再从属于某个特定的原子而是在整个分子空间范围内运动。
因此,分子中的电子运动状态应该用相应的波函数ψ(简称分子轨道)来描述。
每个分子轨道也具有相应的能量E ,由此可得到分子轨道能级图。
⑵ 分子轨道是由分子中原子的原子轨道线性组合(1inear combination of atomic orbitals )而成的。
n 个原子轨道线性组合,可以形成n 个分子轨道。
其中,2n个分子轨道的能量高于原子轨道,称为反键分子轨道(antibonding orbital ),2n 个分子轨道的能量低于原子轨道,称为成键分子轨道(bonding orbital )。
⑶ 原子轨道要有效组合成为分子轨道,必须遵循三个原则,即能量近似原则、轨道最大重叠原则和对称性匹配原则。
⑷ 分子中的电子将遵循保里不相容原理、能量最低原理和洪特规则,依次填入分子轨道之中。
2.原子轨道线性组合形成分子轨道原子轨道有效组合形成分子轨道必须遵循三个原则:能量近似原则、轨道最大重叠原则和对称性匹配原则。
分子轨道概念分子轨道理论是物理化学领域中最重要的理论之一,它是量子力学的一个主要分支,许多现代化学和物理理论都是以它为基础进行发展的。
分子轨道理论是十九世纪中叶德国教授古斯塔夫弗拉克创立的,他提出了一种新的思想,认为原子的属性可以由分子中的电子的形态来解释。
他认为,原子的径向因子可以用电子的波函数来表示,而电子的能量分布可以用该函数的方程来描述。
古斯塔夫弗拉克利用量子力学来解释原子及分子结构,为解决相关问题提出了分子轨道概念。
在分子轨道理论中,原子的结构和性质可由一组被称为“分子轨道(MO)”的力学性质的函数来表示。
这些函数的物理意义就是:它们描述了一组电子在原子内部活动时的“位置”和“动能”。
例如,由一组MO函数可确定一个分子的总能量,而每个MO函数的形状和能级则描述了该分子内部的电子的分布和能量分配。
分子轨道理论是以原子运动和量子效应为基础的。
原子运动是指电子在原子中运动时所表现出来的运动规律。
它取决于原子内部电子之间的相互作用以及与外界电场的作用。
量子效应是指电子在一定范围内有规律性地从一个能态跃迁至另一个能态的现象。
在分子轨道理论中,原子内部电子的运动和能量转换均遵循量子效应的规律。
因此分子轨道理论的对对象是原子,它通过描述原子内部电子的运动和相互作用,得出原子的物理和化学特性。
分子轨道理论是非常重要的,它提供了用来研究分子的一种理论体系,使得化学家可以准确地描述分子的特性和结构。
因此,它在物理化学中具有重要的地位,并且在许多领域,例如分子结构、分子对接和结构优化等方面都显示出重要的应用。
从理论上说,分子轨道理论既可用于描述单原子,也可用于描述多原子的分子系统,甚至可用于描述晶体结构。
分子轨道理论也为我们提供了一种解释不同化学物质之间相互作用机制的方法,从而为化学反应机理研究提供了理论框架。
例如,分子轨道理论可以用来解释离子和非离子之间相互作用的机制,以及分子间复杂相互作用等现象。
分子轨道理论还可以应用于模拟计算中,用来求出化学反应的可能结果,以及模拟化学反应的过程等。
第二章分子结构第五节分子轨道理论2.5.2 分子轨道能级图及其应用分子轨道能级图及其应用1. 同核双原子分子轨道能级图a图:适合O2,F2 b图:适合N2,C2 ,B2N2和O2分子轨道与N、O原子轨道能级数据2. 同核双原子分子轨道电子排布式:◆H 22H 1s 1 →H 2H 2 [(σ1s )2] (分子轨道式)键级 = (相当于共价单键)◆H 2+(氢分子离子)H 2+ [(σ1s )1]键级 = 单电子键(VB 法和Lewis 理论无此说法)20122--==成键分子轨道电子数反键分子轨道电子数100.52-=◆He 2 [(σ1s )2 (σ*1s )2 ]键级 = (不成键),He 2不能稳定存在。
◆He +2 [(σ1s )2 (σ*1s )1 ]键级= , He 2+ 可以存在。
2202-=210.52-=2*22*24221s 1s 2s 2s 2p 2p N ()()()()(π)()σσσσσ⎡⎤⎣⎦键级 = 1/2( 10 - 4 ) = 3N 22*22*224*221s 1s 2s 2s 2p 2p 2p O ()()()()()(π)(π)σσσσσ⎡⎤⎣⎦键级= 1/2 ( 10 - 6 ) = 2O 2第二周期同核双原子分子的电子结构、键级、稳定性及磁性:3.异核双原子分子的分子轨道图及电子排布式: 分子轨道符号不再用下标1s、2s、2p等。
HF分子的电子构型:2224σσσ[123 1 π]CO与N2互为等电子体(14 e ),分子轨道能级相近。
CO [1σ2 2σ2 3σ2 4σ21π45σ2]键级= 3 相当于价键法:C ≡ O对比:N2 (σ1s) 2 (σ*1s) 2 (σ2s) 2 (σ*2s) 2 (π2p) 4 (σ2p) 2。
分子轨道颜色-回复分子轨道颜色- 分子轨道理论对于颜色的解释引言:分子轨道理论是化学中非常重要的一个理论,它描述了分子内电子的分布和行为。
而颜色是我们日常生活中非常常见的现象,许多物质都有自己独特的颜色。
那么分子轨道理论是否能够解释物质的颜色呢?本文将一步一步回答这个问题。
一、经典色谱理论及其局限性经典色谱理论是描述物质颜色的一种理论,它认为物质的颜色是由于物质吸收光谱中特定波长的光而产生的。
根据这个理论,物质在吸收光谱中的吸收峰决定了它的颜色。
然而,这种理论并不能完全解释所有物质的颜色,尤其是分子化合物的颜色。
二、分子轨道理论的基本概念1. 原子轨道和分子轨道原子轨道是描述单个原子内电子运动的理论,而分子轨道是多个原子间电子运动的描述。
分子轨道由原子轨道线性组合得到,可以从分子的简单线性组合、共振和反键轨道等来描述。
2. 分子的能量级别分子的能量级别是由分子中电子的分布和排布决定的,分子轨道的能级由能量最低的基态轨道到能量较高的激发态轨道排序。
3. π电子和颜色的关系π电子是分子轨道理论中的关键概念之一。
具有π电子的分子能够吸收可见光区域的光,进而产生颜色。
根据分子轨道理论,只有分子的π电子能级与光的能量相匹配时,分子才能吸收光的能量,从而呈现出颜色。
三、分子轨道理论对颜色的解释根据分子轨道理论,分子的颜色来源于分子的电子转移。
分子在吸收光的过程中,电子从分子的基态轨道跃迁到激发态轨道。
这一过程中,吸收的光的能量必须与分子π电子能级的能量差相等。
当分子内的π电子发生跃迁时,电子从低能级跃迁到高能级,分子吸收并反射或透过光,这就是我们观察到的颜色。
根据分子轨道理论,不同分子的颜色差异是由于它们的π电子结构不同。
π电子的能量依赖于分子的键长、键的结构和连接方式等因素。
当π电子能级的能量和光的能量相等时,分子就会吸收光。
在吸收光时,分子内的电子会从低能级轨道跃迁到高能级轨道,这个过程使分子呈现出特定的颜色。