溶质的质量分数
- 格式:ppt
- 大小:2.33 MB
- 文档页数:25

溶液溶质质量分数
溶液的溶质质量分数(Massfractionofsoluteinsolution)是指溶液中溶质的质量与整个溶液质量的比例。
它通常以百分比表示,表示为百分数(%)或以小数形式表示。
溶质质量分数的计算公式如下:
溶质质量分数=(溶质的质量/溶液的总质量)×100%
其中,溶质的质量是指溶解在溶液中的溶质的质量,而溶液的总质量是指溶液中溶质和溶剂的总质量之和。
举个例子来说明,假设有一个溶液中含有20克的盐(溶质),而整个溶液的总质量是100克(包括溶质和溶剂),则可以计算溶质的质量分数如下:
溶质质量分数=(20克/100克)×100%=20%
因此,这个溶液中盐的质量分数为20%。
这意味着在这个溶液中,盐的质量占整个溶液质量的20%。
1/ 1。


溶质的质量分数【知识要点】一、溶质的质量分数1、概念:2、溶质质量分数=溶液质量=3、溶质质量分数与溶质质量、溶剂质量之间的关系练习:1、从20%的氢氧化钠溶液中取出5g,所取出溶液与原溶液溶质的质量分数相比()A、变小B、变大C、不变D、无法判断2、将30g氯化钠溶于70g水中,制取氯化钠溶液,则氯化钠溶液中溶质的质量分数是3、欲配制50g溶质质量分数为12%的食盐溶液,需要食盐g,水g.4、蒸发20g食盐溶液,结果得5g食盐,问原溶液的溶质质量分数是多少?4、有关溶质质量分数的计算例1:20g 10%的盐水倒出一半,问:剩余溶液的溶质质量分数例2:从一瓶氯化钾的溶液中取出40g,溶液蒸干后得到10g氯化钾固体,求这瓶溶液的溶质质量分数练习:1、将10g食盐完全溶解在40g水中,该食盐水中食盐的质量分数是多少?2、生理盐水是质量分数为0.9%的氯化钠溶液,现用1000g生理盐水给某病人输液,进入病人体内的氯化钠质量是多少?例3:在农业上常用质量分数为16%的氯化钠溶液来选种。
要配置150kg这种溶液,需要氯化钠和水的质量各多少?5、配制一定质量分数的氯化钠溶液探究内容:配制50g质量分数为6%的氯化钠溶液所需仪器:步骤:1、计算需要氯化钠质量为水的质量为2、用称取所需的氯化钠,倒入烧杯中3、把水的密度近似看做1g/cm3。
用量筒量取所需的水,倒入盛有氯化钠的烧杯里,用玻璃棒搅拌,使氯化钠溶解。
如何选取合适的量程量筒4、把配好的溶液装入试剂瓶中,盖好瓶塞贴上标签,放到试剂柜中。
练习:1、配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作()A.④⑤①②③B.①②③④⑤C.③④①②⑤D.②①④③⑤2、回答下列问题:①实验室配制100g 10%的氯化钠溶液时,需要g氯化钠固体。
②称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是右图的(填字母)。

两种溶质的溶质质量分数
溶质的溶质质量分数是指溶液中溶质的质量与溶液总质量之比。
假设溶质的质量为m溶质,溶剂的质量为m溶剂,溶液的总质量为
m溶液,则溶质的溶质质量分数可以用以下公式表示:
溶质的质量分数 = (溶质的质量 / 溶液的总质量) × 100%。
现在我们来看两种不同溶质的情况:
1. 如果我们有一种溶液,其中溶质A的质量为mA,溶剂的质
量为m溶剂A,溶液的总质量为m溶液A,则溶质A的溶质质量分数为:
溶质A的质量分数 = (mA / m溶液A) × 100%。
2. 同样地,如果我们有另一种溶液,其中溶质B的质量为mB,溶剂的质量为m溶剂B,溶液的总质量为m溶液B,则溶质B的溶质
质量分数为:
溶质B的质量分数 = (mB / m溶液B) × 100%。
这样,我们就可以得到两种不同溶质的溶质质量分数。
这些分
数可以帮助我们了解溶液中溶质的含量,对于溶液的制备和性质具
有重要的参考价值。
同时,这些分数也可以用来计算溶液的稀释和
浓缩过程中溶质的变化情况,对于溶液的处理和应用具有指导意义。
因此,了解和计算溶质的溶质质量分数对于化学实验和工业生产都
具有重要意义。


饱和溶液中溶质的质量分数
饱和溶液中溶质的质量分数(Mass Fraction of Solute)是指在饱和溶液中,溶质(通常是固体)的质量占整个溶液总质量的比例。
它通常以百分比表示。
计算饱和溶液中溶质的质量分数的公式如下:
质量分数(%)= (溶质的质量/ 溶液的总质量) ×100%
例如,如果你有100克的饱和食盐水溶液,其中食盐是溶质,那么如果食盐的质量为30克,那么饱和溶液中食盐的质量分数为:
(30克/ 100克) ×100% = 30%
这表示饱和食盐水溶液中食盐的质量分数为30%。
这个值告诉你,在这个溶液中,食盐的质量占总质量的30%。
质量分数是描述溶液浓度的一个常用方法,特别是在化学实验和工程中。

溶质质量分数计算溶质质量分数是实验化学中常用的一个概念,它能够帮助我们准确计算溶液中溶质的含量,进而指导我们进行相应的实验操作。
本文将详细介绍溶质质量分数的计算方法,并举具体例子加深理解。
首先,我们需要明确溶质是指溶解在溶剂中的物质,而溶剂则是对溶质进行溶解的介质。
在溶液中的溶质质量分数可以用以下公式计算:溶质质量分数 = (溶质的质量 / 溶液的总质量) × 100%其中,溶质的质量表示溶液中溶质所含的质量,溶液的总质量则是指溶质和溶剂的质量之和。
为了更好地理解溶质质量分数的计算过程,我们来看一个具体的例子。
假设我们有100ml含有30g食盐的溶液,那么我们如何计算食盐的质量分数呢?首先,我们需要将溶质的质量和溶液的总质量代入公式中。
根据题目中给出的数据,食盐的质量为30g,溶液的总质量为100ml。
需要注意的是,单位必须一致,所以我们需要将溶液的体积转换为质量。
假设该溶液的密度为1g/ml,那么溶液的总质量即为100g。
将数据代入公式,我们可以得到:食盐的质量分数= (30g / 100g) × 100% = 30%可以看出,该食盐溶液中食盐的质量分数为30%。
这意味着在100g溶液中,有30g的质量来自于食盐。
在实际应用中,溶质质量分数的计算方法经常被用于实验操作的设计和数据分析上。
例如,如果我们想制备一个5%浓度的盐酸溶液,我们可以根据溶质质量分数的计算方法来确定所需的盐酸含量。
假设我们需要制备1000ml的5%盐酸溶液,那么我们可以按照以下步骤进行计算:1. 首先,我们需要将所需的5%浓度转换为质量分数。
因为溶液的总质量即为溶质质量和溶剂质量之和,所以我们可以得到溶质的质量分数为5%。
2. 其次,我们可以根据已知的溶液总质量和所需的溶质质量分数来计算溶质的质量。
假设我们需要的盐酸质量为x克,总质量为1000g,则可以得到以下等式:x = (5/100) × 1000g = 50g。

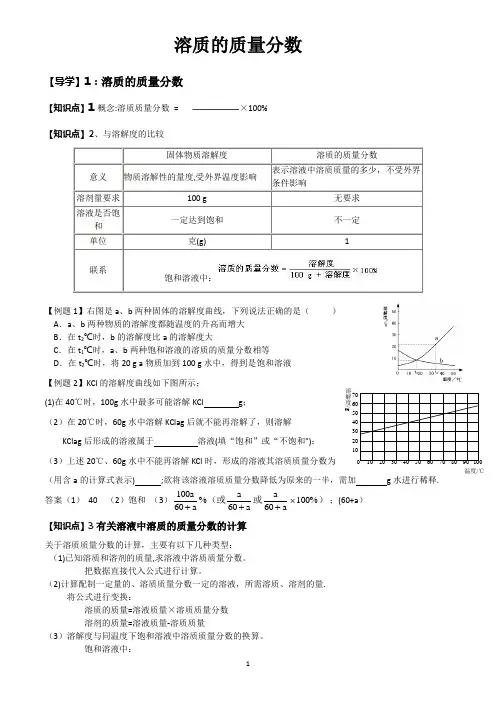
溶质的质量分数【导学】1:溶质的质量分数【知识点】1概念:溶质质量分数= ×100%【知识点】2、与溶解度的比较固体物质溶解度溶质的质量分数意义物质溶解性的量度,受外界温度影响表示溶液中溶质质量的多少,不受外界条件影响溶剂量要求100 g 无要求溶液是否饱和一定达到饱和不一定单位克(g) 1联系饱和溶液中:【例题1】右图是a、b两种固体的溶解度曲线,下列说法正确的是()A.a、b两种物质的溶解度都随温度的升高而增大B.在t2℃时,b的溶解度比a的溶解度大C.在t1℃时,a、b两种饱和溶液的溶质的质量分数相等D.在t2℃时,将20 g a物质加到100 g水中,得到是饱和溶液【例题2】KCl的溶解度曲线如下图所示:(1)在40℃时,100g水中最多可能溶解KCl g;(2)在20℃时,60g水中溶解KClag后就不能再溶解了,则溶解KClag后形成的溶液属于溶液(填“饱和”或“不饱和");(3)上述20℃、60g水中不能再溶解KCl时,形成的溶液其溶质质量分数为(用含a的计算式表示) ;欲将该溶液溶质质量分数降低为原来的一半,需加g水进行稀释.答案(1)40 (2)饱和(3)100606060100%aaaaaa+++⨯%(或或);(60+a)【知识点】3有关溶液中溶质的质量分数的计算关于溶质质量分数的计算,主要有以下几种类型:(1)已知溶质和溶剂的质量,求溶液中溶质质量分数。
把数据直接代入公式进行计算。
(2)计算配制一定量的、溶质质量分数一定的溶液,所需溶质、溶剂的量.将公式进行变换:溶质的质量=溶液质量×溶质质量分数溶剂的质量=溶液质量-溶质质量(3)溶解度与同温度下饱和溶液中溶质质量分数的换算。
饱和溶液中:溶解度/g0 10 20 30 40 50 60 70 80 90 100温度/℃(4)溶液稀释(或浓缩)的有关计算。
依据:稀释(或浓缩)前后,溶质的质量不变例如:有溶液A g,其溶质质量分数为a%,稀释(或浓缩)成溶质质量分数为b%的溶液B g,则:A g×a%=B g×b%①溶液加浓(再加入溶质溶解)的有关计算分析:加入溶质是否溶解,若溶解了一定质量,则溶解后溶质质量和溶液质量都一齐增加.(6)根据化学方程式可进行有关溶液参加反应的计算.在根据化学方程式列有关反应物、生成物的质量比时,要以溶质的质量列比例,而不能直接用溶液的质量或体积列比例.【例题3】已知t℃时,氯化钾的溶解度为40g。


溶质质量分数=m溶质/m溶液×100%=m溶质/(m溶质+m溶剂)×100%
注意:单位统一
质量分数用%,表示100g溶液中含有溶质的质量
未溶解的溶质不参与计算
某温度下某物质的饱和溶液的溶质质量分数=S/(100+S)×100%
应用:
1、已知任意2个量,求解第三个量。
2、若溶质溶于某溶液或水中,发生了化学变化,则溶液中的溶质为反应后的生成物。
例:6.5g 的锌粒加入到100g质量分数为9.8%的稀硫酸中,反应后,将所得溶液蒸发掉6.3g的水,则最终溶液的溶质质量分数是多少?
3、浓溶液的稀释
m浓×C浓=m稀×C稀=(m浓+m水)×C稀
4、溶液的浓缩
(1)加溶质
若原溶液质量为Ag,浓度为a% ,加入Bg溶质后,浓度变为b%
则A×a%+B=(A+B)×b%
例:有100g浓度为10%的氢氧化钠溶液,加入多少克氢氧化钠固体,可将其浓度调整为20%?
(2)蒸发溶剂
若原溶液质量为Ag,浓度为a% ,蒸发Bg水后,浓度变为b%
则A×a% =(A-B)×b%
例:有100g浓度为10%的氢氧化钠溶液,蒸发多少克水,可将其浓度调整为20%?
(3)加浓溶液
若原溶液的质量为Ag,浓度为a%,浓溶液的质量为Bg,浓度为b%,两溶液混合得到的溶液溶质质量分数为w%
则A×a% +B×b%=(A+B)×w%
例:有100g浓度为10%的氢氧化钠溶液,加入多少克浓度为40%的氢氧化钠溶液,可将其浓度调整为20%?。