炔烃的芳氨基双官能团化反应-TheZhouGroup@WHU
- 格式:pdf
- 大小:690.54 KB
- 文档页数:4


buchwald-hartwig 芳胺化反应
Buchwald-Hartwig芳胺化反应是一种官能团转移反应,通常用于合成芳香胺化合物。
在该反应中,苯胺与卤代芳烃在存在钯催化剂的情况下结合,生成相应的芳香胺。
反应机理包括以下步骤:
1. 钯催化剂与配体结合形成活性的钯催化剂。
2. 芳烃中的卤素离子发生还原消除,生成亲电芳香基。
3. 亲电芳香基与苯胺发生配位形成中间体。
4. 中间体中的钯催化剂被还原,同时胺离子发生消除还原,生成芳香胺产物。
Buchwald-Hartwig芳胺化反应的优点包括高选择性、宽广的反应底物适应性、高收率和易于实施。
该反应在有机合成中被广泛应用,并被认为是一种绿色合成方法。
另外,该反应还可以用于合成其他含氮杂环化合物,并且可以进行多步反应,扩展其反应适用范围。

XXXX大学研究生学位课程论文(2012 ——-— 2013 学年第一学期)学院(中心、所):化学化工学院专业名称:应用化学课程名称:高等有机化学论文题目:金属有机化学中的钯催化的反应授课教师(职称) XXXX(教授)研究生姓名: XXXX年级: 2012级学号: XXXXXXXXX成绩:评阅日期:XXXX大学研究生学院2012年 12 月 25 日金属有机化学中的钯催化的反应XXXXXX(XXXX大学化学化工学院,山西,太原,030006)摘要:过渡金属钯在金属有机化学方面具有丰富的反应性,在各类有机化学反应中如氢化、氧化脱氢、偶联、环加成等反应中,钯是优良的催化剂,或是催化剂的重要组分之一。
本文在查阅大量近几年文献资料的基础上,综述了钯催化的反应,同时综述了钯催化反应的机理以及钯催化反应的研究现状。
关键词:钯,催化剂,反应机理,研究进展1钯催化的反应类型及反应机理在现今炼油、石油化工等工业催化反应中,有很多的钯催化反应,尤其是氢化反应中的选择加氢,以及氧化反应中选择氧化生产乙醛、醋酸乙烯、甲基丙烯酸甲酯,均广泛采用和开发钯催化剂.对石油重整反应,钯也是常选取的催化剂组分之一。
1.1氢化反应钯催化剂具有很大的活性和极优良的选择性,部分氢化选择性高,常用作烯烃选择性氢化催化剂。
1。
1。
1反应式及反应机理反应底物首先和氢气分子分别被吸附到催化剂上,然后和催化剂的活性中心形成配位键,最后完成氢的转移,氢和反应底物形成σ—键.1。
1。
2反应方程式举例1.2氧化反应烯烃和炔烃是十分常见并且重要的有机化合物,选择性地氧化这类不饱和碳氢化合物一直是化学工业和学术界的重要研究目标之一。
1.2。
1分子氧参与的钯催化烯烃的氧化反应根据亲核试剂的不同,如氧、氮和碳等亲核试剂,把催化烯烃的氧化反应可以形成C-O、 C—N和C-C 键。
1。
2.1。
1反应机理钯催化烯烃的氧化反应都经过三个过程:首先,把插入烯烃形成新的C—Pd键;接着,有机钯中间体进行β—H消除产生Pd(0);最后,Pd(0)被重新氧化为Pd(П)。

有机化学复习总结一、有机化合物的命名命名是学习有机化学的“语言”,因此,要求学习者必须掌握。
有机合物的命名包括俗名、习惯命名、系统命名等方法,要求能对常见有机化合物写出正确的名称或根据名称写出结构式或构型式。
1、俗名及缩写:要求掌握一些常用俗名所代表的化合物的结构式,如:木醇、甘醇、甘油、石炭酸、蚁酸、水杨醛、水杨酸、氯仿、草酸、苦味酸、肉桂酸、苯酐、甘氨酸、丙氨酸、谷氨酸、巴豆醛、葡萄糖、果糖等。
还应熟悉一些常见的缩写及商品名称所代表的化合物,如:RNA、DNA、阿司匹林、福尔马林、尼古丁等。
2、习惯命名法:要求掌握“正、异、新”、“伯、仲、叔、季”等字头的含义及用法,掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等。
3、系统命名法:系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原则。
其中烃类的命名是基础,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视。
要牢记命名中所遵循的“次序规则”。
4、次序规则:次序规则是各种取代基按照优先顺序排列的规则(1)原子:原子序数大的排在前面,同位素质量数大的优先。
几种常见原子的优先次序为:I>Br>Cl>S>P>O>N>C>H(2)饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推。
常见的烃基优先次序为:(CH3)3C->(CH3)2CH->CH3CH2->CH3- (3)不饱和基团:可看作是与两个或三个相同的原子相连。
不饱和烃基的优先次序为: -C≡CH>-CH=CH2>(CH3)2CH-次序规则主要应用于烷烃的系统命名和烯烃中几何异构体的命名烷烃的系统命名:如果在主链上连有几个不同的取代基,则取代基按照“次序规则”一次列出,优先基团后列出。
按照次序规则,烷基的优先次序为:叔丁基>异丁基>异丙基>丁基>丙基>乙基>甲基。


第十章氨基化10.1概述氨基化指的是氨与有机化合物发生复分解而生成伯胺的反应,它包括氨解和胺化,氨解反应的通式可简单表示如下:R-Y+NH3一R-NH2+HY式中R可以是脂基或芳基,Y可以是羟基、卤基、磺基或硝基等。
胺化是指氨与双键加成生成胺的反应则只能叫胺化。
广义上,氨基化还包括所生成的伯胺进一步反应生成仲胺和叔胺的反应。
脂肪族伯胺的制备主要采用氨解和胺化法。
其中最重要的是醇羟基的氨解,其次是羰基化合物的胺化氢化法,有时也用到脂链上的卤基氨解法。
另外,脂胺也可以用脂羧酰胺或脂腈的加氢法来制备。
芳伯胺的制备主要采用硝化-还原法。
但是,如果用硝化.还原法不能将氨基引入到芳环上的指定位置或收率很低时,则需要采用芳环上取代基的氨解法。
其中最重要的是卤基的氨解,其次是酚羟基的氨解,有时也用到磺基~或硝基的氨解。
氨基化剂所用的反应剂主要是液氨和氨水。
有时也用到气态氨或含氨基的化合物,例如尿素、碳酸氢胺和羟胺等。
气态氨只用于气.固相接触催化氨基化。
含氨基的化合物只用于个别氨基化反应。
下面介绍液氨和氨水的物理性质和使用情况。
①液氨液氨主要用于需要避免水解副反应的氨基化过程。
用液氨进行氨基化的缺点是:操作压力高,过量的液氨较难再以液态氨的形式回收。
②氨水对于液相氨基化过程,氨水是最广泛使用的氨基化剂。
它的优点是操作方面,过量的氨可用水吸收,回收的氨水可循环使用,适用面广。
另外,氨水还能溶解芳磺酸盐以及氯蒽醌氨解时所用的催化剂(铜盐或亚铜盐)和还原抑制剂(氯酸钠、间硝基苯磺酸钠)。
氨水的缺点是对某些芳香族被氨解物溶解度小,水的存在特别是升高温度时会引起水解副反应。
因此,生产上往往采用较浓的氨水作氨解剂,并适当降低反应温度。
用氨水进行的氨基化过程,应该解释为是由NH3引起的,因为水是很弱的“酸”,它和N地的氢键缔合作用不很稳定。
由于OH-的存在,在某些氨解反应中会同时发生水解副反应。
10.2卤素的氨解10.2.1芳环上卤基的氨解10.2.1.1反应历程卤基氨解属于亲核取代反应。

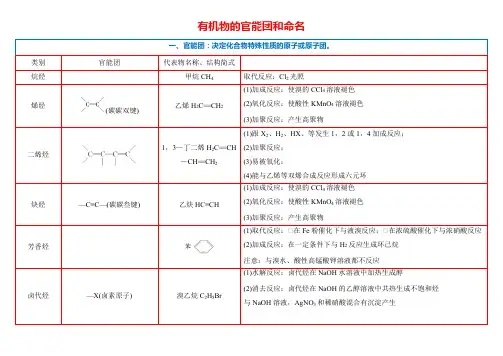
有机物的官能团和命名(碳碳双键)醇—OH(羟基)乙醇C 2H 5OH(1)与活泼金属(Na)反应放出H 2(2)催化氧化:在铜或银催化下被氧化成乙醛 (3)与羧酸发生酯化反应生成酯 酚(1)弱酸性:能与NaOH 溶液反应生成(2)显色反应:遇FeCl 3溶液显紫色 (3)取代反应:与浓溴水反应生成白色沉淀醚(醚键)乙醚CH 3CH 2OCH 2CH 3醛(醛基)乙醛CH 3CHO(1)氧化反应:①与银氨溶液反应产生光亮的银镜①与新制Cu(OH)2悬浊液共热产生红色沉淀 (2)还原反应:与H 2加成生成乙醇酮(羰基)丙酮CH 3COCH 3能与H 2、HCN 等发生加成反应羧酸(羧基)乙酸CH 3COOH(1)酸的通性:与NaHCO 3溶液有CO 2气体放出(2)酯化反应:在浓硫酸催化下与醇反应生成酯和水 酯(酯基)乙酸乙酯CH 3COOCH 2CH 3水解反应:①酸性条件下水解生成羧酸和醇乙酸乙酯水解方程式:CH 3COOC 2H 5+H 2O 稀H 2SO 4①C 2H 5OH +CH 3COOH①碱性条件下水解生成羧酸盐和醇酸性:氨基酸分子结构中含有—COOH,具有酸性与NaOH溶液反应化学方程式:与HCl反应的化学方程式:氰基①含醛基的物质不一定为醛类,如:HCOOH、HCOOCH3、葡萄糖等。
③分子中化学键或官能团可对红外线发生振动吸收,不同化学键或官能团吸收频率不同,在红外光谱图上将处于不同的位置,从而可以获得分子中含有何种化学键或官能团的信息。
红外光谱几乎可以测量出所有化学键的种类,但不能测出化学键的个数。
1.烷烃的习惯命名法2.烷烃的系统命名法(1)命名三步骤(2)编号三原则(3)示例3.烯烃和炔烃的命名4.苯的同系物的命名(1)习惯命名法苯作为母体,其他基团作为取代基。
苯环上二元取代物可分别用邻、间、对表示。
(2)系统命名法将苯环上的6个碳原子编号,以某个甲基所在的碳原子的位置为1号,选取最小位次号给另一甲基编号。


有机化学基础知识芳香胺的合成和反应有机化学中,芳香胺是一类具有芳香环结构的胺物质。
它具有广泛的应用领域,包括医药、染料、合成材料等。
本文将介绍芳香胺的合成方法和一些常见的反应。
一、芳香胺的合成方法1. 氨基化反应氨基化反应是最常见的制备芳香胺的方法之一。
该方法通过芳香化合物与氨气在催化剂的作用下进行反应,生成相应的芳香胺。
催化剂常用的有铜催化剂、铂催化剂等。
2. 还原反应还原反应是另一种制备芳香胺的常用方法。
通常使用还原剂如亚磺酸盐或铁-氯化亚砜作为催化剂,使芳基的硝基化合物还原成相应的芳香胺。
3. 叠氮化反应叠氮化反应是一种将芳香胺转化为芳基叠氮盐的方法。
该反应可以通过在芳香胺溶液中加入硝酸钠等叠氮化合物来完成。
芳基叠氮盐是一类重要的中间体,可进一步用于合成其他有机化合物。
4. Ar-NH2衍生物的还原有时候我们可以通过芳基硝基化合物的还原来制备芳香胺。
硫酸亚铁等还原剂能将芳香硝基衍生物还原成相应的芳香胺。
二、芳香胺的反应1. 古典Schotten-Baumann反应Schotten-Baumann反应是一种芳香胺与酸酐反应的常用方法。
通过该反应,可以制备芳香胺的酰胺衍生物。
反应中常使用的酸酐有乙酰氯、苯酰氯等。
2. 叔胺化反应叔胺化反应是一种将芳香胺转化为N,N-二芳基胺的方法。
通过将芳香胺与叔胺类化合物反应,可以得到其相应的叔胺化物。
3. 氨基阴离子取代反应芳香胺具有亲核性,可以与烯烃或卤代烃等亲电性物质发生取代反应。
通过该反应,可以引入不同的官能团到芳香胺分子上,从而得到其相应的取代产物。
4. 氧化反应芳香胺也可以发生氧化反应。
常见的氧化剂有过氧化氢、高碘酸钠等。
该反应可以将芳香胺氧化为相应的亚硝基化合物或苯醌等。
综上所述,芳香胺是有机化学中重要的化合物之一,具有广泛的应用前景。
了解芳香胺的合成方法和反应规律对于有机化学领域的研究和应用具有重要意义。
这些方法的研究和应用不仅有助于我们更好地理解有机化学的基础知识,还可以为相关领域的研究和应用提供有力支持。
【有机】C-H官能团化Angew:Co催化分子间不对称碳胺化反应廉价3d过渡金属催化的不对称C-H官能团化反应在手性分子的构建中具有巨大的应用潜力。
这类方法的发展具有很大的挑战性,常常需要设计新型的手性配体或催化剂。
例如,Ackermann、Matsunaga、Yoshino和Shi课题组在Co催化的不对称C-H官能团化反应中取得了开创性的进展。
Ackermann和Matsunaga课题组利用非手性Co复合物与手性酸作为催化剂,实现了吲哚化合物的立体选择性C-H烷基化反应。
Matsunaga和Yoshino课题组使用非手性的Co催化剂与手性羧酸,通过CMD过程,也实现了硫代酰胺的C-H活化反应。
同时,这些反应也促进了二茂铁官能团化反应的发展与手性羧酸的设计及应用。
2019年,瑞士洛桑理工学院的Nicolai Cramer 课题组报道了一种新型手性Cp x Co复合物,利用N-氯苯甲酰胺与多种烯烃通过C-H官能团化反应制备二氢异喹诺酮,相比于与Cp x Rh复合物,Co催化剂不仅更加廉价,而且具有更好的区域选择性及立体选择性。
相比于其他金属,高价Co催化剂在C-H官能团化反应中具有更广阔的发展空间。
例如,Glorius课题组报道了Cp*Co III复合物在丙烯酸酯的碳胺化反应中的应用。
作为对比,类似的Cp*Rh III催化剂则会发生快速的β-H消除反应,生成Heck反应产物。
Co催化剂和Rh催化剂的差异在苯氧基乙酰胺与双环烯烃的反应中也得到了体现。
Cp*Co III 复合物会催化反应得到消旋的碳胺化产物,而Cp*Rh III催化剂则会使反应得到分子间酰胺转移产物或桥接多环骨架。
烯烃的碳胺化反应可以一步实现C-C键及C-N的构建,可用于合成胺类化合物。
然而,C-H 活化过程参与的不对称碳胺化反应报道较少,且大多使用Rh催化剂。
为了突破这个局限,最近Nicolai Cramer课题组采用手性环戊二烯-钴(III)配合物实现了烯烃的分子间不对称碳胺化反应,合成了一系列酪氨酸衍生物以及氨基取代的双环支架(Scheme 1)。
炔烃双官能团化是一种重要的有机化学反应,它通过在炔烃分子中引入两个官能团,从而合成具有特殊结构和性质的有机化合物。
这种反应在有机合成、材料科学和药物研发等领域具有广泛的应用。
本文将详细介绍炔烃双官能团化的反应机理、合成方法以及应用前景。
一、炔烃双官能团化的反应机理炔烃双官能团化反应通常涉及过渡金属催化剂和氧化剂的参与。
在反应过程中,炔烃分子首先与过渡金属催化剂形成π-配合物,然后通过氧化剂的作用,将两个官能团分别引入到炔烃的两个碳原子上。
根据不同的反应条件和催化剂的选择,可以引入不同的官能团,如卤素、羰基、酯基、酰胺基等。
二、炔烃双官能团化的合成方法1卤代炔烃的双官能团化卤代炔烃是一种重要的中间体,可以通过卤代反应将卤素原子引入到炔烃分子中。
随后,卤代炔烃可以与各种亲核试剂发生取代反应,从而引入第二个官能团。
例如,卤代炔烃与醇类反应可以生成酯类化合物;与胺类反应可以生成酰胺类化合物。
2炔烃的氧化双官能团化在氧化剂的作用下,炔烃可以直接发生氧化双官能团化反应。
例如,炔烃与过氧化氢在铜催化剂的作用下,可以生成1,2-二酮类化合物。
此外,炔烃还可以通过与氧化剂如高锰酸钾、重铬酸钾等反应,生成相应的羧酸或羧酸酯类化合物。
3炔烃的加成-消除双官能团化在过渡金属催化剂的作用下,炔烃可以首先与一个亲电试剂发生加成反应,形成一个中间体。
随后,该中间体可以发生消除反应,生成含有两个官能团的产物。
例如,炔烃与卤代烃在钯催化剂的作用下,可以发生Sonogashira偶联反应,生成含有碳-碳三键和卤素原子的双官能团化产物。
4炔烃的环化双官能团化在某些条件下,炔烃可以发生分子内的环化反应,生成含有两个官能团的环状化合物。
例如,炔烃在钯催化剂和氧化剂的作用下,可以发生分子内的氧化环化反应,生成1,2-二氧代环戊烷类化合物。
三、炔烃双官能团化的应用前景1有机合成炔烃双官能团化反应为有机合成提供了丰富的方法论。
通过选择合适的催化剂、氧化剂和亲核试剂,可以合成各种具有特定结构和性质的有机化合物。
15/10/2017 Ying Yang
炔烃的芳氨基双官能团化反应
Graphic Abstract:
图1. 分子间芳基氨基化反应
炔烃的双官能团化反应是区域选择性合成三取代/四取代烯烃的主要方法之一。
随着过渡金属催化反应方法学的发展,现今已经可以较高的收率构建含有C-
C/C-X杂原子键的多取代烯烃(图1A)。
对于合成含有N-取代的烯烃,目前主要通过炔烃的氢胺化反应实现。
该方法已经广泛的应用于天然产物、药物分子和聚合物的合成中。
但是通过炔烃和芳香胺的加成一步得到芳基氨基双官能团化的反应至今仍然是一个难以解决的问题(图1B)。
最近,来自英国曼彻斯特大学的Michael F. Greaney课题组报道了无金属催化的炔烃分子间芳基氨基双官能团化反应。
关于炔烃双官能团化的反应,陆熙炎院士和刘桂霞博士等人曾经报道了Rh 催化的N-苯氧基乙酰胺对炔的加成反应(图2);李燕博士等人报道过Cu催化的N-氟代磺酰亚胺对炔丙醇的自由基加成反应(图3);Tonks等人发展了Ti催化的炔烃、烯烃和偶氮苯的反应,然而这些反应都不具有良好的底物普适性。
图2. Rh催化的N-苯氧基乙酰胺对炔的加成反应
图3. Cu催化剂催化的N-氟代磺酰亚胺对炔丙醇的自由基加成反应
图4. Ti催化剂催化的炔烃、烯烃和偶氮苯的反应
本文作者设计使用芳香磺酰胺作为氨基和芳基的来源对炔烃进行双官能团
化。
磺酰胺广泛的应用于药物和农用化学品中,具有良好的理化性质和稳定性。
作者设想反应由芳香磺酰胺中的SO2离去引发,分别得到亲核性的氨基和亲电性的芳基,通过这种加成-取代-SO2离去的反应循环得到双官能团化产物(图1C)。
之前已经发现类似的途径可以发生在活性较高的苯炔中间体中,经过加成-重排反应得到联芳基化合物。
因此,他们希望将此途径拓展到普通炔烃分子中,通过新型的氨基来源一步得到多种取代的烯胺化合物,并且Csp2-Csp2键的形成不需要过渡金属的参与。
图5. 底物拓展
他们首先尝试4-硝基苯磺酰胺4a与不同缺电子炔烃(2)的反应,发现以DMF为溶剂在70 ℃的条件下,仅需要加入K2CO3就能够以理想的收率得到烯胺化合物(图5)。
作者通过3d和3g的单晶结构,可以确认氨基与芳基处于反式位置,这可能与分子内氢键有关。
虽然磺酰胺4a亲核性较弱,但是多种含有不同取代基(如直链/支链烷基、芳基、芳香杂环等基团)的炔烃,都可以和4a 反应得到烯胺(3a-3e,3k);给电子和吸电子取代基的炔烃参与反应同样具有良好的收率(3g-3i),且位阻对反应的影响较大(3f)。
乙氧基丙炔酸甲酯也可以发生反应得到N,O-缩醛3j;羰基取代的炔烃同样适用于该反应(3l)。
当改变磺酰胺的取代基时(图5),通过反应机理可知,Smiles重排反应的关键中间体Meisenheimer中间体(图1, 6)需要有吸电子取代基加以稳定。
因此,当芳环上含有硝基、羰基、氰基、多个卤素基团或者是其他含氮芳香杂环时,反应都能以中等到良好的收率得到目标产物(3m-3t)。
此外,二级磺酰胺也能够在标准条件下得到相应的产物(3u-3x),并且3u可以做到克级规模放大生产。
图6. 产物的衍生化与拓展
最后,作者对产物的衍生化进行了研究(图6)。
产物烯胺可以通过不同的高价碘试剂氧化得到吲哚环7或者氮杂环丙烯8;3u通过Adams催化剂还原可以得到β-氨基酸衍生物9,该化合物可以作为合成多种治疗心血管疾病药物的关键中间体。
此外,4a与联烯10反应可以以3.5:1的比例得到化合物11a与11b。
总结全文,Greaney课题组发展了一种通过炔烃的氨基芳基化反应,一步合成四取代烯胺的方法。
该反应具有良好的底物普适性,并且不需要过渡金属催化剂的参与。
产物烯胺可以作为合成生物活性分子的关键中间体,具有良好的应用价值。