芳酰胺化反应
- 格式:pdf
- 大小:425.66 KB
- 文档页数:18



浅谈Buchwald反应及其在有机合成中的应用发布时间:2022-07-13T05:54:36.090Z 来源:《科学与技术》2022年第3月第5期作者:梁腾[导读] Buchwald-Hartwig偶联反应可直接形成C—N键,生成相关含氮化合物,被广泛应用于天然产物和药物合成中。
梁腾******************摘要:Buchwald-Hartwig偶联反应可直接形成C—N键,生成相关含氮化合物,被广泛应用于天然产物和药物合成中。
其中嘧啶-2-胺是许多抗癌药(如伊马替尼碱)中的共同结构,因此其衍生物的布赫瓦尔特-哈特维希结合反应尤为重要。
这种反应可以进行嘧啶-2-胺结构的引入,也可以应用于嘧啶-2-胺的改性,这种改性为药物合成提供了有力的工具。
但是,现代催化技术存在一些问题,如贵金属的使用、高剂量配体、不可回收的催化剂和催化剂的低转化率。
因此,从实用化的角度来看,开发利用无配体的可回收催化剂的有效催化方法是一个非常重要的研究课题。
同时,纳米催化剂是催化领域的前沿之一。
其中,以聚苯胺为载体的纳米金属催化剂具有重要的实用意义。
苯胺价格低廉,适合大规模应用。
苯胺有毒性,但聚苯胺毒性较小。
另外,与无机配体相比,聚苯胺替代品可以调节催化剂的性能,使催化剂适合各种反应案例。
随着催化氧化技术的迅速发展,合成聚苯胺的绿色方法已经成熟,为相关催化剂的工业应用奠定了基础。
最近,我们的研究小组设计和制造了含有聚苯胺的铜催化剂,并将其应用于吡啶-2-胺衍生物的布赫波罗的海-哈特维希化合物的反应中,开发了一种无需额外配体的有效方法。
基于此,本篇文章对Buchwald反应及其在有机合成中的应用进行研究,以供参考。
关键词:Buchwald反应;有机合成;应用分析引言吩嗪及其衍生物广泛存在于天然产物和生物分子中。
它们最早是在假单胞菌产生的次级代谢产物中发现的,具有抑制竞争微生物和影响细菌种群结构和组织的特性。
经证明,从天然衍生物中合成分离的苯那嗪具有抗菌、抗肿瘤、抗疟疾和抗寄生虫的活性。


氯虫苯甲酰胺合成工艺流程氯虫苯甲酰胺的合成主要包括芳香胺的氯化磺化反应、氯化磺化物的取代反应和酰胺化反应等几个步骤。
下面将详细介绍这些步骤的工艺流程。
1.芳香胺的氯化磺化反应芳香胺是氯虫苯甲酰胺的合成原料之一,通常选择间甲酚作为芳香胺的原料。
反应方程式如下:H₃C-C₆H₄-OH + Cl₂SO₂ → H₃C-C₆H₄-Cl + HClO₃S其中,Cl₂SO₂是氯化磺化合物,它是由二氧化硫与氯气在光照条件下反应得到的。
在反应条件下,将间甲酚和氯化磺加入反应釜中,控制反应温度在50-60°C,反应时间为1-2小时,反应结束后得到芳香胺氯化磺化物。
2.氯化磺化物的取代反应将得到的芳香胺氯化磺化物与二氯乙烷进行取代反应,得到氯代芳烃。
反应方程式如下:H₃C-C₆H₄-Cl + ClCH₂CHCl₂ → H₃C-C₆H₄-NH-SO₂Cl + HCl在反应条件下,将芳香胺氯化磺化物和二氯乙烷加入反应釜中,控制反应温度在80-90°C,反应时间为3-4小时,反应结束后得到氯代芳烃。
3.氯代芳烃的酰胺化反应将得到的氯代芳烃与氯乙酰氯进行酰胺化反应,得到氯虫苯甲酰胺。
反应方程式如下:H₃C-C₆H₄-NH-SO₂Cl + ClC₂H₃OCl → H₃C-C₆H₄-NH-CO-C₂H₃Cl + HCl在反应条件下,将氯代芳烃和氯乙酰氯加入反应釜中,控制反应温度在60-70°C,反应时间为5-6小时,反应结束后得到氯虫苯甲酰胺。
以上就是氯虫苯甲酰胺的合成工艺流程,通过对芳香胺的氯化磺化反应、氯化磺化物的取代反应和酰胺化反应等几个步骤的介绍,我们可以清晰地了解到氯虫苯甲酰胺的合成过程。
这一合成工艺流程不仅需要控制好反应条件,还需要注意原料的纯度、反应物的比例以及反应釜的密封性等方面的问题,这样才能够得到高纯度、高产率的氯虫苯甲酰胺产品。
当然,在实际生产中,还需要根据具体情况对工艺流程进行调整,以获得最佳的合成效果。

化学反应中的酰胺水解机制解析酰胺水解是指酰胺与水在一定条件下发生化学反应,生成相应的羧酸和胺。
这个反应在许多化学领域都有广泛的应用,特别是在有机合成中。
本文将对酰胺水解的机制进行详细解析,以加深我们对这一重要反应的理解。
1. 酰胺的结构和性质首先,我们来了解一下酰胺的结构和性质。
酰胺是由酸酐或酰氯与胺反应生成的化合物,通常由羰基碳上的氧与胺中的氮形成结合。
酰胺可分为脂肪酰胺和芳香酰胺两类,它们在反应中的行为有一定的差异。
脂肪酰胺水解较容易进行,而芳香酰胺的水解速率较慢。
2. 酰胺水解的机制酰胺水解的机制主要分为碱性水解和酸性水解两种情况。
下面我们将分别讨论这两种情况。
2.1 碱性水解碱性水解是指酰胺与碱性介质(如氢氧化钠溶液)反应生成相应的羧酸和胺的过程。
这一反应的机制涉及了亲核取代反应和质子转移两个步骤。
首先,酰胺中的羰基碳与碱中的氢氧根离子发生亲核取代反应,形成过渡态。
在过渡态中,氧上的电荷被氨或胺中的氮原子吸引,从而断裂碳氧键。
形成的负离子经过质子转移,与水分子结合生成羧酸。
同时,亲核碱中的氨或胺离子与亲电酰胺碳上的氮原子结合,生成相应的胺。
2.2 酸性水解酸性水解是指酰胺与酸性介质(如酸溶液)反应生成相应的羧酸和胺的过程。
这一反应的机制主要涉及了质子转移和亲电取代两个步骤。
首先,酰胺的氮原子上的非键电子亲电地吸引溶液中的酸(如H3O+),生成质子化的酰胺。
在质子化的酰胺中,氧上的电荷失去了吸引力,碳氧键被断裂,形成正离子。
这个正离子在质子转移的过程中捕获了一个质子,生成质子化的羧酸及相应的胺。
3. 影响酰胺水解的因素酰胺水解受到多种因素的影响,以下是其中几个重要的因素:3.1 反应物的结构和性质酰胺的结构和性质对其水解速率有一定的影响。
一般来说,脂肪酰胺比芳香酰胺易于水解。
此外,酰胺中羰基碳上的取代基和氮上的取代基也会影响反应速率。
3.2 溶剂的性质溶剂的性质对酰胺水解反应也有一定的影响。


bergman芳构化反应Bergman芳构化反应是一种重要的有机化学反应,它是指在特定的反应条件下,芳香化合物中的酰胺键(C=O)被断裂,生成两个芳香环的反应。
以下是从多个角度全面完整回答关于Bergman芳构化反应的问题。
1. 反应机理:Bergman芳构化反应的机理涉及到一个中间体,即环丁炔酮。
首先,芳香化合物中的酰胺键被加热或通过光照等外部激发条件断裂,生成环丁炔酮。
然后,环丁炔酮通过一个类似于Diels-Alder 反应的过程,发生一个[2+2]环加成反应,生成两个新的芳香环。
最后,环丁炔酮经历一个脱氢步骤,形成两个芳香环。
2. 反应条件:Bergman芳构化反应通常在高温下进行,一般在200-300摄氏度范围内。
此外,还需要一些外部激发条件,如光照或者加热等,以促进酰胺键的断裂。
3. 反应适用性:Bergman芳构化反应适用于具有合适的结构和功能团的芳香化合物。
常见的反应底物包括芳香酮、芳香酰胺和芳香酸等。
此外,反应的产物通常是两个芳香环,具有较高的环境稳定性和生物活性。
4. 反应应用:Bergman芳构化反应在有机合成中具有广泛的应用。
它可以用于合成具有特定结构和功能的化合物,如天然产物、药物分子和材料科学中的有机材料等。
此外,该反应还可以用于构建具有特定的空间构型和立体化学活性的化合物。
5. 反应优势和局限性:Bergman芳构化反应具有高效、高选择性和原子经济性等优势。
它可以在温和的条件下实现复杂分子的构建。
然而,该反应也存在一些局限性,如需要较高的温度和特定的反应条件,以及对底物结构的一定限制等。
总结起来,Bergman芳构化反应是一种重要的有机化学反应,通过断裂酰胺键和环加成反应的过程,可以合成具有两个芳香环的化合物。
它在有机合成中具有广泛的应用前景,但也需要考虑其反应条件和适用性的限制。

酰肼基结构式范文酰肼(hydrazinecarbonyl)是一种有机化合物,化学式为H2NNHCO,结构式为NNHCO。
它是一种无色或微黄色的液体,具有强烈的氨臭味。
酰肼是肼(N2H4)与二氧化碳反应而得。
酰肼的合成方法有多种。
一种常用的方法是将肼溶解在二氯甲烷中,加入二氧化碳气体使其生成酰肼。
反应的化学方程式如下:N2H4+CO2→H2NNHCO酰肼的化学结构中的肼基与羰基成键,形成一个独特的结构。
这种结构的存在使得酰肼具有一些特殊的化学性质和应用。
首先,酰肼可以发生酰胺化反应。
与醛或酮反应时,酰肼中的氮氢原子与羰基氧原子发生亲核加成反应,形成酰胺。
这个反应在有机合成中具有广泛的应用。
例如,酰肼可以与酮类化合物发生反应,形成对应的酰胺类似物。
这个反应对于合成具有特殊功能的有机分子非常有用。
其次,酰肼可以发生芳香酰胺化反应。
在芳香酰胺化反应中,酰肼可以与芳香酸酐反应,形成芳香酰肼,然后经过水解转化为芳香酰胺。
这个反应也是有机合成中常用的方法之一酰肼也可以发生脱氮反应,生成氮气和一些有机胺。
这个反应在有机合成中有一定的应用,可以用于合成芳香胺。
此外,酰肼具有还原性,可以与一些氧化剂反应,发生氧化还原反应。
酰肼还可用作燃料,在火箭发动机中有应用。
酰肼的燃烧产物中含有大量的氮气,可以提供更大的推力。
它也用于生产聚氨酯、半胱胺等有机化合物。
总而言之,酰肼是一种具有特殊结构的有机化合物,其在有机合成中具有重要应用。
它可以通过肼与二氧化碳的反应得到,能够发生酰胺化反应、芳香酰胺化反应和脱氮反应等。
此外,酰肼还可以用作燃料,应用于火箭发动机。

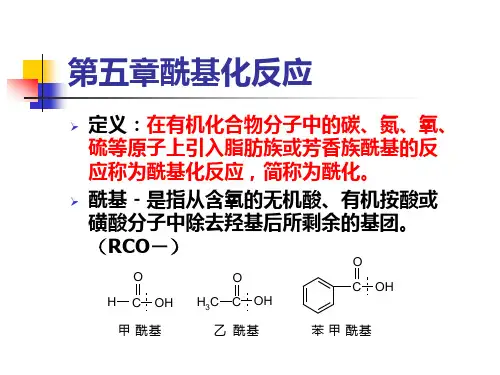
有机化学基础知识点酰胺的性质和反应酰胺是有机化合物中一类重要的官能团,广泛存在于生物体内和许多化学合成中。
其性质和反应是有机化学基础知识的重要组成部分。
本文将就酰胺的性质和反应进行探讨。
一、酰胺的结构特点酰胺是由羧酸与胺缩合而成,它的一般结构可以表示为R-CO-NH2。
其中R代表烃基或芳香基。
酰胺分为两类,一类是脂肪酰胺,即R为烷基;另一类是芳香酰胺,即R为芳香基。
二、酰胺的物理性质1. 熔点和沸点:酰胺的熔点和沸点较高,这是由于酰胺分子内部间存在较强的氢键和范德华力,使得酰胺分子之间的结合较紧密。
2. 溶解性:酰胺在水中可以溶解,而且与许多有机溶剂(如醇、醚等)也有良好的溶解性。
三、酰胺的重要性质和反应1. 氢键性质:酰胺中的氮原子可以与邻近的羰基氧形成氢键,这种氢键对于酰胺的稳定性和物理性质有很大影响。
2. 氨解反应:酰胺可以通过与强碱(如氨水)反应,发生氨解反应生成胺和酸的盐。
示例如下:R-CO-NH2 + NH3 → R-NH2 + NH4+ + COO-3. 水解反应:酰胺可以通过与水反应发生水解反应,生成相应的酸和胺。
示例如下:R-CO-NH2 + H2O → R-COOH + NH34. 酰胺的脱水缩合反应:酰胺中的羰基与胺的氮原子发生脱水缩合反应,生成酰胺之间的化合物。
示例如下:R-CO-NH2 + R'-CO-NH2 → R-CO-NH-R'-CO-NH2 + H2O5. 酰胺的磺化反应:酰胺可以与磺酰氯反应,发生磺化反应生成相应的磺酰胺。
示例如下:R-CO-NH2 + SCl2 → R-CO-NH-SO2Cl6. 酰胺的酰基取代反应:酰胺中的酰基可以被卤代烷取代,生成相应的酰胺衍生物。
示例如下:R-CO-NH2 + RX → R-CO-NHR + HX7. 酰胺的氧化反应:酰胺可以发生氧化反应,生成相应的酰胺衍生物或酮。
示例如下:R-CO-NH2 + [O] → R-CO-NH-R + H2O总结:酰胺作为一类重要的有机化合物,其性质和反应体现了有机化学的基础知识。
长三角绿色制药协同创新中心《绿色制药技术》研讨报告题目:机械化学在酰胺化反应中的应用姓名:学号:班级:绿色制药1301研讨课主题:机械化学技术用于无溶剂合成反应研讨课时间:2015.11.25目录1研究背景 (1)1.1无溶剂反应 (1)1.2机械研磨化学 (1)1.3酰胺化反应 (2)2技术应用案列 (3)2.1机械研磨法合成甲酰胺类化合物 (3)2.2机械研磨条件下芳醛芳胺直接氧化酰胺化反应 (4)3总结与讨论 (4)3.1机械研磨合成的优缺点 (4)3.2机械研磨设备和反应条件的探讨 (5)参考文献 (5)1研究背景1.1无溶剂反应大多数的有机反应是在溶液中进行的,在溶液中反应物分子能均匀分散,稳定地交换能量。
由于大多数有机溶剂都具有易燃易爆、有毒有害的缺点,所以对无溶剂参与的有机反应进行研究具有十分重要的理论意义和广泛的应用前景。
没有溶剂参与的有机反应,由于没有溶剂分子的介入,反应体系的微环境不同于溶液中,使得反应物局部的高浓度,提高了反应速度和效率,并且由于这种反应操作简单,加热、振荡、研磨、超声辐射及微波辐照都可以加速反应,同时避免了由于使用溶剂所带来的危险性、毒害性和增加成本等缺点,所以无溶剂的合成反应成为近年来的研究热点之一,并已实现了多种重要的有机反应。
90年代初人们明确提出无溶剂有机合成,它既包括经典的固-固反应,又包括气-固反应和液-固反应[1]。
机械研磨化学就是属于固相无溶剂有机合成的一种。
1.2机械研磨化学机械研磨有多种方式,最简单的就是实验室常用的研钵,这种手工研磨能够引发一系列不需要克服高能垒的反应。
另一种是球磨,一般应用于引发需要更高能量或者反应时间较长的反应。
不管是哪一种,它们的基本原理是一样的,都是由机械力诱发使其发生化学反应。
这里所说的机械力范围较广,主要包括粉碎和研磨过程中的冲击力或研磨作用力、压力、摩擦力等。
所以,凝聚态下的物质受到外来机械力的作用而发生化学变化的现象都可以称为机械化学反应。
有机化学基础知识点整理酰胺和酰肼有机化学基础知识点整理:酰胺和酰肼酰胺(Amides)是有机化合物中的一类重要官能团,它们由酸和胺反应生成。
酰胺可用于合成其他有机物,也是许多生物活性分子的结构基础。
1. 酰胺的命名和结构酰胺的命名通常采用将相应的酰基(acyl)和胺命名并组合而成。
例如,乙酰胺(Acetamide)即由乙酰基和胺组成。
酰胺的结构可以表示为RCONR'R'',其中R为酰基,R'和R''为有机基团。
2. 酰胺的合成方法(1)酰化反应:酰胺可以由酸酐和胺反应生成,常用的酸酐有酰氯和酸酐酯。
(2)胺和酸反应:胺和酸在适当条件下反应也可以生成酰胺。
(3)芳香酰胺的合成:通过氨基苯基化反应,芳香胺和芳香酰氯反应生成芳香酰胺。
3. 酰胺的性质和反应(1)氢键性质:酰胺中的氮原子可以形成氢键,使得酰胺具有较高的沸点和熔点。
(2)酰胺水解:酰胺在酸性条件下水解为相应的酸和胺;在碱性条件下水解为相应的酸酐和胺。
(3)酰胺的缩合反应:酰胺可以发生缩合反应生成关环化合物,例如拉兹酰胺反应和烯酰胺反应。
酰胺在有机化学中具有广泛的应用,常见的应用包括合成农药、药物、染料等。
以下是一些具有代表性的酰胺化合物及其应用:1. 乙酰胺(Acetamide)乙酰胺广泛应用于农药和医药领域,是合成其他酰胺类化合物的重要中间体。
2. 苯甲酰胺(Benzamide)苯甲酰胺是非处方止痛药对乙酰氨基酚(Paracetamol)的结构类似物,也用于合成其他药物和染料。
3. 尿素(Urea)尿素是一种含有两个酰胺基团的有机化合物,广泛应用于农药和化妆品等领域,也是合成其他有机化合物的重要中间体。
酰肼(Acyl Hydrazides)是一类含有酰肼(NH-NH-R)官能团的有机化合物。
它们的结构中含有一个酰基和一个肼基,酰肼可以通过酸酐和肼的反应生成。
酰肼常用于有机合成中的氨基保护基,也可以作为杀虫剂和荷尔蒙制剂的前体。
经典化学合成反应标准操作芳酰胺化反应目录1. 前言 (2)2. 铜催化下的芳酰胺化 (3)2.1 芳香卤参与反应 (3)2.1.1 铜盐 (4)2.1.2 配体 (5)2.1.3 溶剂 (7)2.1.4 碱 (7)2.2 铜催化下的芳基硼酸与酰胺的偶联反应 (9)2.3 三芳基铋参与的反应 (10)3. 钯催化下的芳酰胺化 (12)1. 前言最早的芳酰胺化反应是Goldberg 1906年报道的铜催化下的芳基化反应。
1早期的Goldberg反应局限于卤代芳烃和芳酰胺之间的偶联,尽管实际起作用的是一价铜络合物,在反应中人们通常使用过量的铜粉。
反应的温度通常高达210℃,反应的后续处理困难,反应产物复杂,反应的产率也不高。
尽管如此,由于在早期人们没有其它办法来实现亲电性sp2碳与亲核试剂之间的直接偶联,Goldberg反应仍然被合成工作者大量使用。
值得注意的是,在早期的实验中人们发现卤代芳烃上的吸电子基团,特别是卤素邻位的吸电子基团可以大大地活化Goldberg反应。
通过在芳基亲核化合物上添加给电子基团以增加其亲核性也可以促进Goldberg 反应。
后来,中科院有机所的马大为及其同事发现CuI催化的N-芳基化在某些α-氨基酸存在下,可以在90℃下顺利进行。
Buchwald 等人2发现用乙二胺类做配体,CuI催化的Goldberg 反应可以在较温和的条件下进行,并对之进行了较深入的研究。
用相应的芳基硼酸代替芳卤化合物进N-芳基化近年来也取得了长足的进展,其条件要比相应的Goldberg反应温和的多。
基于铜盐催化的芳基化有诸多的缺点,近几年由Pd催化的交叉偶联反应也引起了人们的极大关注。
Pd催化较传统的Goldberg反应具有条件温和、反应简单等优点。
由于Buckwald和Hartwig组在这方面做了大量的工作,因而,人们有时也称这类反应为Buckwald-Hartwig芳酰胺化。
在Pd和Ni催化反应被发现之后,人们从二十世纪七十年代起逐渐放弃了对Goldberg 反应的研究。
经典化学合成反应标准操作芳酰胺化反应目录1. 前言 (1)2. 铜催化下的芳酰胺化 (2)2.1 芳香卤参与反应 (2)2.1.1 铜盐 (3)2.1.2 配体 (4)2.1.3 溶剂 (6)2.1.4 碱 (6)2.2 铜催化下的芳基硼酸与酰胺的偶联反应 (8)2.3 三芳基铋参与的反应 (9)3. 钯催化下的芳酰胺化 (11)1. 前言最早的芳酰胺化反应是Goldberg 1906年报道的铜催化下的芳基化反应。
1早期的Goldberg反应局限于卤代芳烃和芳酰胺之间的偶联,尽管实际起作用的是一价铜络合物,在反应中人们通常使用过量的铜粉。
反应的温度通常高达210℃,反应的后续处理困难,反应产物复杂,反应的产率也不高。
尽管如此,由于在早期人们没有其它办法来实现亲电性sp2碳与亲核试剂之间的直接偶联,Goldberg反应仍然被合成工作者大量使用。
值得注意的是,在早期的实验中人们发现卤代芳烃上的吸电子基团,特别是卤素邻位的吸电子基团可以大大地活化Goldberg反应。
通过在芳基亲核化合物上添加给电子基团以增加其亲核性也可以促进Goldberg 反应。
后来,中科院有机所的马大为及其同事发现CuI催化的N-芳基化在某些α-氨基酸存在下,可以在90℃下顺利进行。
Buchwald 等人2发现用乙二胺类做配体,CuI催化的Goldberg 反应可以在较温和的条件下进行,并对之进行了较深入的研究。
用相应的芳基硼酸代替芳卤化合物进N-芳基化近年来也取得了长足的进展,其条件要比相应的Goldberg反应温和的多。
基于铜盐催化的芳基化有诸多的缺点,近几年由Pd催化的交叉偶联反应也引起了人们的极大关注。
Pd催化较传统的Goldberg反应具有条件温和、反应简单等优点。
由于Buckwald和Hartwig组在这方面做了大量的工作,因而,人们有时也称这类反应为Buckwald-Hartwig芳酰胺化。
在Pd和Ni催化反应被发现之后,人们从二十世纪七十年代起逐渐放弃了对Goldberg 反应的研究。