08-酰胺和胺的人名反应解析
- 格式:ppt
- 大小:731.00 KB
- 文档页数:55




关于碳氮键构建的人名反应人名反应是有机化学中一类重要的化学反应,以其发现者或首次报道者的名字命名。
碳氮键构建反应是指在有机分子中引入新的碳氮键。
1.库奥帕夫反应(Kumada-Corriu交叉偶联反应)库奥帕夫反应是碳氮键构建的一种经典方法,由日本化学家库奥帕夫(Kumada)于1972年首次报道。
该反应可使通过钯催化的交叉偶联反应,催化剂通常为[Pd(PPh3)4]。
反应中,氯化烃与有机卤化物经由钯催化,在碳氮键构建的过程中用于引入新的碳链。
这种反应广泛应用于天然产物合成和医药化学领域。
2.索巴克-霍菲曼反应(Schlosser modification of the Hofmann degradation)索巴克-霍菲曼反应是由法国化学家索巴克(Schlosser)和霍菲曼(Hofmann)于1977年首次报道的一种碳氮键构建反应。
该反应的目的是将有机化合物中的一个氨基基团替换为一个卤素基团。
反应中,溴苯与亚铁氰酸钠反应,生成二烷基氨基亚铁氰酸钠,在酸性条件下可经过脱烷基反应得到相应的酰胺。
这种反应对于合成含氨基有机化合物的功能化转化具有重要意义。
3.萨克霍夫反应(Sakurai-Hosomi碳氮键构建反应)萨克霍夫反应是由日本化学家萨克霍夫(Sakurai)和保住(Hosomi)于1984年首次报道的一种碳氮键构建反应。
该反应通过硅烷试剂和有机亚胺的反应,以钯催化构建碳氮键。
在反应中,硅烷试剂作为亲核试剂,与有机亚胺反应生成中间体,再与钯催化剂加成反应,形成碳氮键。
这种反应具有高效、高选择性和广泛适用性,被广泛应用于有机化学合成中。
4.伯明翰霍夫曼氨解反应(Birch-Hofmann氨解反应)伯明翰霍夫曼氨解反应是由澳大利亚化学家伯明翰(Birch)和霍菲曼(Hofmann)于1946年首次报道的一种碳氮键构建反应。
该反应以氯氰或溴氰作为亲核试剂,与有机胺发生核烯反应,生成相应的氯胺或溴胺。

反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
反应:将上面改为铜粉和氢卤酸。
反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。
反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下,在芳核或杂环上引入甲酰基。
反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应。
反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合。
若两个酯在同一分子之内,在上述条件下可发生分子内缩合,得环状β-酮酸酯,此反应称为Dieckmann反应。
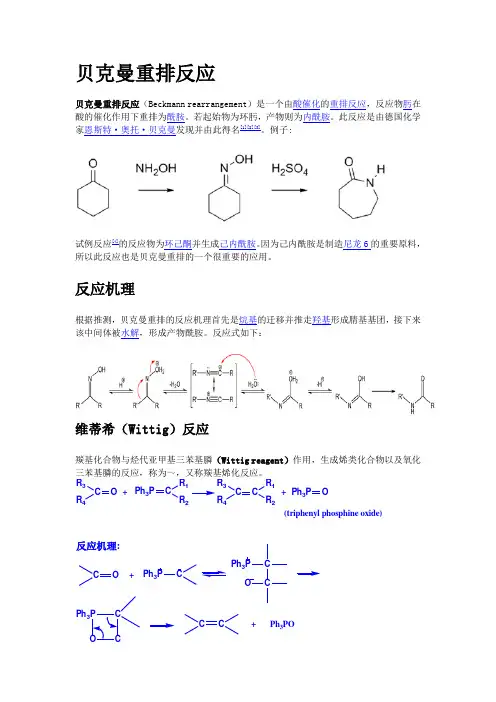
贝克曼重排反应贝克曼重排反应(Beckmann rearrangement )是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名[1][2][3]。
例子:试例反应[4]的反应物为环己酮并生成己内酰胺。
因为己内酰胺是制造尼龙6的重要原料,所以此反应也是贝克曼重排的一个很重要的应用。
反应机理根据推测,贝克曼重排的反应机理首先是烷基的迁移并推走羟基形成腈基基团,接下来该中间体被水解,形成产物酰胺。
反应式如下:维蒂希(Wittig )反应羰基化合物与烃代亚甲基三苯基膦(Wittig reagent )作用,生成烯类化合物以及氧化三苯基膦的反应,称为~,又称羰基烯化反应。
R 3R 4C O C R 2R1Ph 3P R 3R 4C C R 2R 1Ph 3P O ++(triphenyl phosphine oxide)C O C C Ph 3P C C O Ph 3Ph 3PC +Ph 3PO+反应机理:贝里斯-希尔曼反应贝里斯-希尔曼反应(Baylis–Hillman reaction),是α,β-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。
催化剂一般采用DABCO(1,4-二氮双环[2,2,2]辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇[1]。
这一反应又被称为森田-贝里斯-希尔曼反应(Morita–Baylis–Hillman reaction),或者简称为MBH反应(MBH reaction)[2],这一反应名称得名自日本化学家森田健一(Ken-ichi Morita)、英国化学家安东尼·贝里斯(Anthony B. Baylis)和德国化学家梅维尔·希尔曼(Melville E. D. Hillman)。
反应机理贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael加成反应启动的加成-消除反应历程[6]。

1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按 S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer----Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault---Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。

1. Aldol Condensation:羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
反应第一步为羟醛反应,第二部反应为脱水反应。
酸催化碱催化图例使用OCH3 做碱2.Baeyer –Villiger Oxidation酮在过氧化物如过氧化氢、过氧化羧酸等氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
2.Baylis –Hillman Reactionαβ-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。
催化剂一般采用DABCO(14-二氮双环222辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇1。
贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael 加成反应启动的加成-消除反应历程4. Beckmann Rearrangement是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
α-二酮、α-酮酸、α-叔烃基酮反式、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易,又斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为―异常贝克曼重排‖称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
5. Benzoin Condensation 安息香缩合反应,又称苯偶姻缩合,是一个有机反应,是氰离子催化下两分子芳香醛进行缩合生成一个偶姻分子的反应。
由于生成物是安息香(Ph-CO-CHOH-Ph)的衍生物,故名??. Birch Reduction钠和醇在液氨中将芳香环还原成14-环己二烯的有机还原反应。
Birch 还原的重要性在于:尽管剩下的双键(非芳香性)更为活泼,该反应却能停留在环己双烯上,而不继续还原。
反应中的钠也可以用锂或钾取代,使用的醇通常是甲醇或叔丁醇。
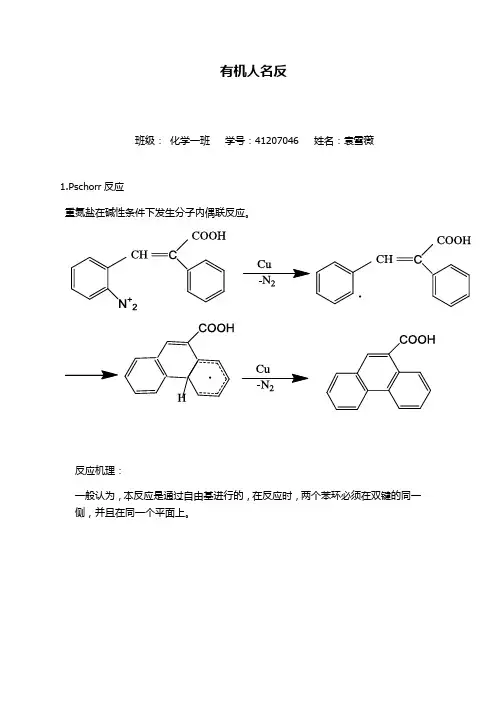
有机人名反班级:化学一班学号:41207046 姓名:袁雪薇1.Pschorr反应重氮盐在碱性条件下发生分子内偶联反应。
反应机理:一般认为,本反应是通过自由基进行的,在反应时,两个苯环必须在双键的同一侧,并且在同一个平面上。
2.Dkin反应邻位或对位有羟基(或氨基)的芳醛或芳酮在碱溶液中用过氧化氢或其他氧化物氧化,得到相应的多元酚。
化学方程式:反应机理:3.Baeyer-Viliger 氧化酮类化合物用过酸如或氧乙酸等氧化,可在羰基旁边插一个氧原子,生成相应的酯。
反应机理4.Vilsmeier 反应芳烃、活化烯烃化合物用二取代甲酰胺及三氯氧磷处理得到醛类。
是在芳环上引入甲酰基的常用方法。
化学方程式:反应机理:5. Hantzsch反应原料:羰基酸酯,醛,氨,氧化剂反应方程式:反应机理:R /ORO O R //+R /O ONH 3NR //CO 2R /RRR /O 2C主要应用:用于合成吡啶的同系物,在生物、医药等 6. Birch 反应原料:芳香化合物、碱金属(钠、钾或锂)、液氨、醇(乙醇、异丙醇或仲丁醇) 反应方程式:反应机理:主要应用:Birch 还原时连接芳香族和脂肪族化合物的桥梁,它使许多芳香族衍生物成为合成脂肪族化合物。
Birch 还原早期集中于烷基苯和芳香醚类化合物的合成,现在已扩展到芳香族酸、酯和酮等化合物,在天然有机产物合成中得到广泛应用。
例如手性环己烷衍生物的合成。
Na3Na +NH3Na +e+HHeEtOHHHeHH EtOHHH7. Fries重排原料:酚、酯、lewis酸也可以是硝基苯、硝基甲烷溶剂反应方程式:酚酯在lewis酸存在下加热发生酰基重排,生成邻羟基和对羟基芳酮的混合物。
邻对位比例取决于酚酯的结构、反应条件和催化剂等。
温度对产物比例影响较大,一般来说,较低温度下重排有利于形成对位异构产物,较高温度下有利于形成邻位异构产物。
反应机理:O CORAlCl3OHCOR+OHCO R3O CCH3OCH33165℃OHCH3H3CCO80~85%95%COCH3O COCH3AlCl3AlCl3+H3CCO+OH3CCOH+-AlCl3OHH3CCO主要应用:主要在药物合成中应用广泛,丙酸苯酯的Fries重排可以合成抗早产药利托君的中间体,还可以合成肾上腺素,是一种强心剂。
1. Beckma nn 重排* * 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:2.Birch 还原芳香化合物用碱金属〔钠"钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇:)的混合液中旺原,苯坏可被as原成非共純的匕4-坏己二烯化合反应实例取代的苯也能发生还原*并且通常得到单一的还原产物9例如;NaCH3 HaNH3(liq,XEtOH3.Ca nn izzaro 反应4•反应实例4.Chichibab in 反应杂坏碱类,与碱金属的氨基物一起加热时发生胺化反应.得到相应的氨基衍生牺如毗喘与氨基钠反应生成2-氨基毗碇,如果世位已被占据,则得片氨基毗噪,但产率很低*本法是在樂环上引入氨基的简便有敢的方法’广泛适用于各种氮杂芳环,如苯并咪毗异劇t叮喘和菲喘类化合枷均能发生本反应。
哇咻、毗嗪、曙咗、囈醴类化合物反应较为困难。
氨基化试剂除氨基钠、氨基钾外J还可以用取代的碱金属氯优物:f J + Nmc冋--------------- rl反应实例吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难本反应是在杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶和菲啶类化合物均能发生本反应5.Claise n酯缩合反应含有幻氢的酯在醇讷等碱性缩合剂作用下发生縮合作用,失去f子醇得到酸酯。
如2分子乙酸乙酯左金属钠和少量乙醇作用下发生缩含得到乙酰乙酸乙酯。
C a H5ONa2也岁0角论-------- 一GHgCOCH云0心眄75%二元羧酸酯的分子内酯缩合见Dieckma nn 缩合反应。
1.Arbuzov 反应一般认为是按SN2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer----V illiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault---Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
6.Bucherer 反应萘酚及其衍生物在亚硫酸或亚硫酸氢盐存在下和氨进行高温反应,可得萘胺衍生物,反应是可逆的。
7.Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
常见人名反应及机理 Document number:NOCG-YUNOO-BUYTT-UU986-1986UTBeckmann重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:Birch还原反应机理Cannizzaro反应反应机理Claisen酯缩合含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见反应机理乙酸乙酯的α-氢酸性很弱(,而乙醇钠又是一个相对较弱的碱(乙醇的pKa~),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
Claisen_Schmidt反应一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮:反应机理Clemmensen还原醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用还原。
Cope重排1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应()反应称为Cope 重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。