生物化学知识实验一蛋白质和氨基酸的呈色反应.doc
- 格式:doc
- 大小:299.00 KB
- 文档页数:4

实验一 蛋白质及氨基酸的呈色反应一、实验目的1、了解构成蛋白质的基本结构单位及主要联接方式2、了解蛋白质和某些氨基酸的呈色反应原理3、学习几种常用的鉴定蛋白质和氨基酸的方法 二、实验原理1. 双缩脲反应(biuret reaction)蛋白质和多肽分子中肽键在稀碱溶液中与硫酸铜共热,呈现紫色或红色,此反应称为双缩脲反应,双缩脲反应可用来检测蛋白质水解程度。
2. 茚三酮反应(ninhydrin reaction)蛋白质经水解后产生的氨基酸也可发生茚三酮反应。
3.苯环的黄色反应Tyr TrpPhe+少量浓硫酸+浓硝酸黄色 4. 乙醛酸的反应:检测Trp 或含Trp 蛋白质的反应。
当Trp 与乙醛酸和浓硫酸在试管中滴加时,产生分层现象,界面出现紫色环。
主要是由于蛋白质中的吲哚环作用。
5. 偶氮反应偶氮化合物都含有-N=N-这样结构,通常作为染料。
()↓--→+--+Pb COO NH Pb COOH N H 2222Pr Pr 三、实验步骤1. 双缩脲反应(biuret reaction)取1支试管,加乳蛋白溶液(蛋清:水= 1:9)约1ml 和10%NaOH 约2ml ,摇匀,再加1%CuSO4溶液2滴,随加随摇。
观察现象,记录。
2. 茚三酮反应(ninhydrin reaction)(1)取2支试管分别加入蛋白质溶液(蛋清:水= 1:9)和甘氨酸溶液1ml ,再各加0.5ml0.1%茚三酮,混匀,沸水浴中加热1-2分钟,观察颜色是否由粉红色变紫红色再变蓝色。
(2)在一块小滤纸上滴1滴0.5%的甘氨酸溶液,风干后再在原处滴1滴0.1%茚三酮乙醇溶液,在微火旁烘干显色,观察是否有紫红色斑点的出现。
3.苯环的黄色反应向6个试管中按下表加试剂,观察现象并记录。
鸡蛋清溶液(蛋清:水= 1:9)4. 乙醛酸的反应:向3个试管中按下表加试剂,观察现象并记录。
蛋白质溶液(蛋清:水= 1:20)向3个试管中按下表加试剂,观察现象并记录。

生物化学实验安排实验一蛋白质及氨基酸的呈色反应一、实验目的1、了解构成蛋白质的基本结构单位及主要联接方式2、了解蛋白质和某些氨基酸的呈色反应原理3、学习几种常用的鉴定蛋白质和氨基酸的方法二、实验原理1. 双缩脲反应(biuret reaction)蛋白质和多肽分子中肽键在稀碱溶液中与硫酸铜共热,呈现紫色或红色,此反应称为双缩脲反应,双缩脲反应可用来检测蛋白质水解程度。
2. 茚三酮反应(ninhydrin reaction)蛋白质经水解后产生的氨基酸也可发生茚三酮反应。
3.苯环的黄色反应Tyr+ 浓硝酸黄色TrpPhe+少量浓硫酸+浓硝酸黄色4. 乙醛酸的反应:检测Trp或含Trp蛋白质的反应。
当Trp与乙醛酸和浓硫酸在试管中滴加时,产生分层现象,界面出现紫色环。
主要是由于蛋白质中的吲哚环作用。
5. 偶氮反应偶氮化合物都含有-N=N-这样结构,通常作为染料。
6. 醋酸铅反应()↓--→+--+Pb COO NH Pb COOH N H 2222Pr Pr三、实验步骤1. 双缩脲反应(biuret reaction)取1支试管,加乳蛋白溶液(蛋清:水= 1:9)约1ml 和10%NaOH 约2ml ,摇匀,再加1%CuSO4溶液2滴,随加随摇。
观察现象,记录。
2. 茚三酮反应(ninhydrin reaction)(1)取2支试管分别加入蛋白质溶液(蛋清:水= 1:9)和甘氨酸溶液1ml ,再各加0.5ml0.1%茚三酮,混匀,沸水浴中加热1-2分钟,观察颜色是否由粉红色变紫红色再变蓝色。
(2)在一块小滤纸上滴1滴0.5%的甘氨酸溶液,风干后再在原处滴1滴0.1%茚三酮乙醇溶液,在微火旁烘干显色,观察是否有紫红色斑点的出现。
3. 苯环的黄色反应向6个试管中按下表加试剂,观察现象并记录。
鸡蛋清溶液(蛋清:水= 1:9)4. 乙醛酸的反应:向3个试管中按下表加试剂,观察现象并记录。
蛋白质溶液(蛋清:水= 1:20)5. 偶氮反应向3个试管中按下表加试剂,观察现象并记录。

竭诚为您提供优质文档/双击可除茚三酮呈色反应实验报告篇一:实验三蛋白质及氨基酸的呈色反应实验三蛋白质及氨基酸的呈色反应一、实验目的1、了解蛋白质和某些氨基酸的特殊颜色反应及其原理2、掌握几种常用鉴定蛋白质和氨基酸的方法二、实验内容对蛋白质及氨基酸的双缩脲反应、茚三酮反应、黄色反应、乙醛酸反应、偶氮反应、醋酸铅反应等颜色及沉淀反应进行定性确定。
三、实验操作(一)双缩脲反应1、实验原理当尿素加热到180℃左右时,两个分子的尿素缩合可放出一个分子氨后形成双缩脲,双缩脲在碱性溶液中与铜离子结合生成复杂的红色配合物,此呈色反应称为双缩脲反应。
由于蛋白质分子中含有多个肽键,其结构与双缩脲相似,故能呈此反应,而形成紫红色或蓝紫色的配合物。
此反应常用作蛋白质的定性或定量的测定。
2、试剂(1)尿素(2)10%naoh溶液(3)1%cuso4溶液(4)蛋白质溶液:将鸡蛋清用蒸馏水稀释10~20倍,3层纱布过滤,滤液冷藏备用。
3、操作(1)取少许结晶尿素放在干燥试管,微火加热,则尿素开始熔化,并形成双缩脲,释放的氨可用湿润的红色石蕊试纸鉴定。
待熔融的尿素开始硬化,试管内有白色固体出现,停止加热,让试管缓慢冷却。
然后加10%naoh溶液1ml和1%cuso42~3滴,混匀后观察颜色的变化。
(2)另取一试管,加蛋白质溶液1ml、10%naoh溶液2ml 及1%cuso42~3滴,振荡后将出现的紫红色与双缩脲反应所产生的颜色相对比。
(二)茚三酮反应1、实验原理除脯氨酸和羟脯氨酸与茚三酮作用生成黄色物质外,所有α-氨基酸与茚三酮发生反应生成紫红色物质,最终形成蓝紫色化合物。
1︰1500000浓度的氨基酸水溶液即能发生反应而显色。
反应的适宜ph为5~7。
此反应目前广泛地应用于氨基酸定量测定。
2、试剂蛋白质溶液(同前);0.5%甘氨酸;0.5%茚三酮水溶液3、操作取2支试管分别加入蛋白质溶液和甘氨酸溶液各1ml,再各加0.5ml0.1%茚三酮水溶液,混匀,在沸水浴加热2~3分钟,观察颜色变化。

本科生实验报告实验课程学院名称专业名称学生姓名学生学号指导教师实验地点实验成绩二〇一五年月二〇一五年月实验一氨基酸的分离鉴定----纸层析法一、实验目的通过氨基酸的分离,学习纸层析法的基本原理及实验方法。
二、实验原理纸层析法是用滤纸作为惰性支持物的分配层析法。
滤纸纤维上的羟基具有亲水性,因此吸附一层水作为固定相,而通常把有机溶剂作为流动相。
纸层析法是根据不同氨基酸在两相间的分配比不同而进行分离的:在固定相分配的比例大的氨基酸,随流动相移动的速度慢,而在流动相分配的比例大的则随流动相流动的速度快。
层析溶剂由有机溶剂和谁组成。
物质被分离后用比移值(Rf值)来衡量各组分的分离情况,如图所示。
根据图得到:Rf=a\b其中:a为原点到层析点中心的距离(cm),b为原点到溶剂前沿的距离(cm)。
在一定的条件下某种物质的Rf值是常数。
Rf值最大等于1,即该组分随溶剂一起上升,Rf值最小等于0,即该组分基本上留在原点不动。
Rf值的大小与物质的结构、性质、溶剂系统、层析滤纸的质量和温度等因素有关。
本实验利用纸层析法分离氨基酸。
三、实验药品、实验器材1.扩展剂:将20mL正丁醇和5mL冰醋酸放入分液漏斗中,与15mL水混合,充分震荡,静置数分层后,放出下层水相。
取分液漏斗内的扩展剂约5mL置于小烧杯中作为平衡溶剂,其余的倒入杯中备用。
2.氨基酸溶液:赖氨酸、脯氨酸、缬氨酸、苯丙氨酸、亮氨酸溶液及它们的混合液(各组分浓度均为0.5%),各5mL。
3.显色剂:0.1%水合茚三酮正丁醇溶液。
4.层析缸:毛细管,喷雾剂,培养皿,层析滤纸,分液漏斗,针,线。
四、实验方法1.将盛有平衡溶剂的小烧杯置于密闭的层析缸中,使展开剂达到饱和。
2.取层析滤纸(长22cm,宽14cm)一张。
在纸的一端距边缘2cm处用铅笔画一条直线,在此直线上每间隔2cm作一记号。
3.点样:用毛细管将氨基酸样品分别点在这6个位置上,吹干后再点一次。
注意没点再纸上扩散的直径最大不超过3mm。



实验一、甲醛滴定法测定氨基氮一、 实验目的:初步掌握甲醛滴定法测定氨基酸含量的原理和操作要点。
二、 实验原理氨基酸是两性电解质,在水溶液中有如下平衡:对溶液氨基酸含量的测定主要依据平衡中电离H +的浓度来确定。
因此,反应平衡应向右进行。
平衡向右的促进方式:1)增加底物的浓度——A 、增加AA 的浓度(本实验目的是测定氨基酸的含量,必须保证固定的氨基酸浓度;B 、加碱,让H +电离。
但—NH 3+ 是弱酸,完全解离时pH 为11~12或更高,若用碱滴定—NH 3+所释放的H + 不测量氨基酸,一般指示剂色域小于10,很难准确指示终点。
因此,直接用碱滴定是不可行的。
2)降低产物的浓度——在本实验中用加入过量甲醛的方式:常温下,甲醛能迅速与氨基酸的氨基结合,生成羟甲基化合物,使平衡右移,促使—NH 3+释放H +,使溶液的酸度增加,同时也使滴定终点从强碱区域(pH11~12)移至弱碱区域(pH9.0左右)。
而这一区域正好是酚酞的敏感变色区域(pH8~10)。
因此,可用酚酞用指示剂,用标准氢氧化钠溶液滴定(刚好微红)。
由滴定所用的NaOH 量就可计算出溶液中氨基酸的含量,这就称氨基酸的甲醛滴定法。
如样品为一种已知的氨基酸,从甲醛滴定的结果可算出氨基氮的含量。
当然,如样品是蛋白质水解液,(实际上是多种氨基酸的混合物),则滴定结果不能作为氨基酸的定量依据。
但是,基本规律如下:当蛋白质水解时,放出游离的氨基,随着水解程度的增加,滴定值也增加。
当滴定值不再增加,表示水解作用已完全。
相反,蛋白质合成时游离氨基减少。
因此,可以用此法测定溶液中的氨基量,就能大体判断出蛋白质水解或合成的进度。
二羟甲基氨基酸三、实验器材1、25ml锥形瓶2、微量滴定管3、吸管4、移液管四、实验试剂1、0.1mol/L标准甘氨酸溶液300ml准确称取750mg甘氨酸,溶解后定容至100ml。
2、0.1mol/L 标准氢氧化钠溶液500ml3、酚酞指示剂20ml0.5%酚酞的50%乙醇溶液4、中性醛溶液400ml在50ml 36%~37% 分析纯甲醛溶液中加入1mL 0.1% 酚酞乙醇水溶液,用0.1mol/L的NaOH溶液滴定到微红,贮于密闭的玻璃瓶中。



实验一蛋白质和氨基酸的呈色反应一、目的要求验证蛋白质特性;学习和掌握蛋白质呈色反应的原理和方法;学习几种常用的鉴定蛋白质和氨基酸的方法。
二、实验原理蛋白质中的某些化学键或氨基酸残基中的某些化学基团可以与某些特殊试剂形成特定的有色物质。
这些反应称为蛋白质的呈色反应。
各种蛋白质的氨基酸残基不完全相同。
因此,呈色反应产物的颜色也不完全一样。
呈色反应不是蛋白质所特有,一些非蛋白物质也能呈现类似的呈色反应。
因此,不能仅以呈色反应结果来判别被测物质是否为蛋白质。
三、呈色反应双缩脲反应1.原理两分子尿素经加热至180°C后可以缩合成一分子双缩脲,并放出一分子氨。
双缩脲在碱性溶液中与铜离子结合生成紫红色络合物,此反应称为双缩脲反应。
多肽及所有蛋白质均具有肽键,与双缩脲分子中亚酰胺键结构相同,也能发生此反应,因此,蛋白质在碱性溶液中与铜离子也能呈现出类似于双缩脲的颜色反应。
2.器材与试剂1)器材试管、药匙、电炉、试管夹、滴管。
2)试剂〈1〉蛋白质溶液(10%卵清蛋白溶液):吸取鸡蛋清溶液10ml,加蒸馏水稀释,定容至100ml。
〈2〉10%氢氧化钠溶液。
〈3〉1%硫酸铜(CuSO4)溶液。
〈4〉0.1%甘氨酸(Gly)溶液:称0.1g甘氨酸溶于蒸馏水中,稀释至100ml。
〈5〉结晶尿素。
3.实验步骤双缩脲反应实验(1)制备双缩脲:取结晶尿素少许(约火柴头大小),放入干燥的小试管中。
微火加热至尿素熔解至硬化,刚硬化时立即停止加热,尿素放出氨,此时双缩脲即已形成。
冷却后作为双缩脲样品(1号管)。
(2)另取3支试管,与1号管一起按表加样,混匀,观察各管颜色变化,记录结果并解释现象。
茚三酮反应1.原理蛋白质或氨基酸在弱碱性条件下,其上的氨基与茚三酮共热可产生蓝紫色缩合物。
此反应为一切蛋白质和α-氨基酸所共有,具有亚氨基的脯氨酸和羟脯氨酸与茚三酮反应产生特征性的黄色化合物,含有氨基的其他化合物也能呈此反应。
2.器材与试剂1)器材滤纸、试管、试管夹、药匙、电炉、滴管、吸管、水浴锅。
生物化学(上)实验实验一、氨基酸的纸层析一、实验目的:1、通过氨基酸的分离,学习并掌握纸层析的原理和操作技术;2、掌握影响分配系数的因素。
3、学会分析未知样品的氨基酸成分。
二、原理滤纸层析是以滤纸为惰性支持物的分配层析,滤纸纤维上的羟基具有亲水性,吸附一层水作为固定相,有机溶剂为流动相。
有机相流经固定相支持物时,与固定相之间连续抽提,使物质在两相间不断分配而得到分离。
溶质在滤纸上的移动速度用Rf值表示:R f=原点到层析斑点中心的距离/ 原点到溶剂前沿的距离物质结构、溶剂系统的物质组成等因素都会影响Rf值。
三、实验材料、仪器和试剂:1、实验材料:谷氨酸、组氨酸、脯氨酸、亮氨酸标准品2、仪器:(1)毛细管(2)电热吹风机(3)层析缸(4)层析滤纸(5)小型玻璃喷雾器(6)铅笔、直尺等。
3、试剂:(1)氨基酸标准溶液:亮氨酸、脯氨酸、谷氨酸、组氨酸标准品。
(2)溶剂系统:正丁醇:甲酸:水=15:3:2(体积比)摇匀;(3)0.25%的水合茚三酮溶液。
四、实验步骤:1、样品的准备:称取谷氨酸、组氨酸、脯氨酸、亮氨酸标准品各1mg混合溶于10%异丙醇中。
2、滤纸的准备:取一长方形滤纸,在滤纸纵向对应的两边距边沿2cm处,各画两条平行线,一条作前沿标志,一条作点样线,在点线上每隔2cm画一个“+”作为点样位置,共5个点。
3、点样:用毛细管点样,中间的点混合氨基酸,两侧点四种标准氨基酸;每个点样点重复点5次,每点一次用电吹风吹干后再点下次(此时,用冷风吹干,防止氨基酸变性降解),点样点的直径应控制在2mm左右,点样完毕用大头针将滤纸做成筒形,点样面向外,注意纸的两边不要接触。
4、展层:向层析缸中加入层析溶剂,液层不要超过点样线,(高约1.5cm,约50-60ml 溶剂)将滤纸点样点朝下放入层析溶剂中,将层析缸密闭,待溶剂到达标志线后取出,冷风吹干。
5、显色:用喷雾器将0.25%茚三酮显色剂均匀喷在滤纸上,热风(加快反应)反应吹干显色。
.实验一蛋白质和氨基酸的呈色反应一、目的要求验证蛋白质特性;学习和掌握蛋白质呈色反应的原理和方法;学习几种常用的鉴定蛋白质和氨基酸的方法。
二、实验原理蛋白质中的某些化学键或氨基酸残基中的某些化学基团可以与某些特殊试剂形成特定的有色物质。
这些反应称为蛋白质的呈色反应。
各种蛋白质的氨基酸残基不完全相同。
因此,呈色反应产物的颜色也不完全一样。
呈色反应不是蛋白质所特有,一些非蛋白物质也能呈现类似的呈色反应。
因此,不能仅以呈色反应结果来判别被测物质是否为蛋白质。
三、呈色反应双缩脲反应1.原理两分子尿素经加热至180°C后可以缩合成一分子双缩脲,并放出一分子氨。
双缩脲在碱性溶液中与铜离子结合生成紫红色络合物,此反应称为双缩脲反应。
多肽及所有蛋白质均具有肽键,与双缩脲分子中亚酰胺键结构相同,也能发生此反应,因此,蛋白质在碱性溶液中与铜离子也能呈现出类似于双缩脲的颜色反应。
2.器材与试剂1)器材试管、药匙、电炉、试管夹、滴管。
2)试剂〈1〉蛋白质溶液(10%卵清蛋白溶液):吸取鸡蛋清溶液10ml,加蒸馏水稀释,定容至100ml。
〈2〉10%氢氧化钠溶液。
〈3〉1%硫酸铜(CuSO4)溶液。
〈4〉0.1%甘氨酸(Gly)溶液:称0.1g甘氨酸溶于蒸馏水中,稀释至100ml。
〈5〉结晶尿素。
3.实验步骤双缩脲反应实验试管试剂/滴1234尿素+加热后的尿素+蛋白质溶液/滴30.1%Gly/滴310%NaOH/滴55551%CuSO/滴11114显色现象(1)制备双缩脲:取结晶尿素少许(约火柴头大小),放入干燥的小试管中。
微火加热至尿素熔解至硬化,刚硬化时立即停止加热,尿素放出氨,此时双缩脲1 / 4 .即已形成。
冷却后作为双缩脲样品(1号管)。
(2)另取3支试管,与1号管一起按表加样,混匀,观察各管颜色变化,记录结果并解释现象。
茚三酮反应1.原理蛋白质或氨基酸在弱碱性条件下,其上的氨基与茚三酮共热可产生蓝紫色缩合物。
第一部分 基础生化实验实验一 氨基酸及蛋白质的性质【实验目的】1. 加深理解所学有关的蛋白质性质的理论知识2. 掌握氨基酸和蛋白质常用的定性、定量分析的方法及原理一、蛋白质呈色反应蛋白质的呈色反应是指蛋白质所含的某些氨基酸及其特殊结构,在一定条件下可与某些试剂发生了生成有色的物质的反应。
不同蛋白质分子所含的氨基酸残基也是不完全相同,因此所发生的成色反应也不完全一样。
另外呈色反应并不是蛋白质的专一反应,某些非蛋白质类物质(含有-CS-NH 、-CH 2-NH 2、-CRH-NH 2、-CHOH-CH 2NH 2等基团的物质)也能发生类似的颜色反应。
因此,不能仅仅根据呈色反应的结果为阳性就来判断被测物质一定是蛋白质。
注意:本次实验为定性实验,试剂的量取用滴管完成。
(一)双缩脲反应【实验原理】当尿素经加热至180℃左右时,两分子尿素脱去一分子氨,进而缩合成一分子双缩脲。
其在碱性条件下双缩脲与铜离子结合成红紫色络合物,此反应称为双缩脲反应。
其反应过程如下:多肽及蛋白质分子结构中均含有许多肽键,其结构与双缩脲分子中的亚酰胺键相同。
因此,在碱性条件下与铜离子也能呈现出类似于双缩脲的呈色反应。
其反应过程如下:【试剂】1. 蛋白质溶液(鸡蛋清用蒸馏水稀释10倍,通过2-3层沙布滤去不容物)2. 0.1%甘氨酸溶液C OH 2NH 2N+COH 2N H 2NH 22O O+NH3.0.01%精氨酸溶液4.10%NaOH溶液5.1%CuSO4溶液6.尿素结晶【实验操作】1. 双缩脲的制备取少许尿素结晶 (约火柴头大小)放入干燥的试管中,微火加热至尿素熔解至硬化,刚硬化时立即停止加热,此时双缩脲即已形成。
冷却后加10%氢氧化钠溶液约1ml、并震荡,再加入1%硫酸铜溶液2滴,再震荡,观察颜色的变化。
注意:a.在操作过程中试管不能冲向其他人以防止烫伤;b.控制加热的时间既不能过长也不能过短;c.加热时火不能太大,防止碳化。
实验一 蛋白质和氨基酸的呈色反应
一、目的要求
验证蛋白质特性;学习和掌握蛋白质呈色反应的原理和方法;学习几种常用
的鉴定蛋白质和氨基酸的方法。
二、实验原理
蛋白质中的某些化学键或氨基酸残基中的某些化学基团可以与某些特殊试
剂形成特定的有色物质。
这些反应称为蛋白质的呈色反应。
各种蛋白质的氨基酸残基不完全相同。
因此,呈色反应产物的颜色也不完全
一样。
呈色反应不是蛋白质所特有,一些非蛋白物质也能呈现类似的呈色反应。
因此,不能仅以呈色反应结果来判别被测物质是否为蛋白质。
三、呈色反应
双缩脲反应
1.原理
两分子尿素经加热至180°C 后可以缩合成一分子双缩脲,并放出一分子氨。
双缩脲在碱性溶液中与铜离子结合生成紫红色络合物,此反应称为双缩脲反应。
多肽及所有蛋白质均具有肽键,与双缩脲分子中亚酰胺键结构相同,也能发
生此反应,因此,蛋白质在碱性溶液中与铜离子也能呈现出类似于双缩脲的颜色反应。
2.器材与试剂
1)器材
试管、药匙、电炉、试管夹、滴管。
2)试剂
〈1〉蛋白质溶液(10%卵清蛋白溶液):吸取鸡蛋清溶液10ml ,加蒸馏水稀
释,定容至100ml 。
〈2〉10%氢氧化钠溶液。
〈3〉1%硫酸铜(CuSO4)溶液。
〈4〉0.1%甘氨酸(Gly)溶液:称0.1g 甘氨酸溶于蒸馏水中,稀释至100ml 。
〈5〉结晶尿素。
3.实验步骤
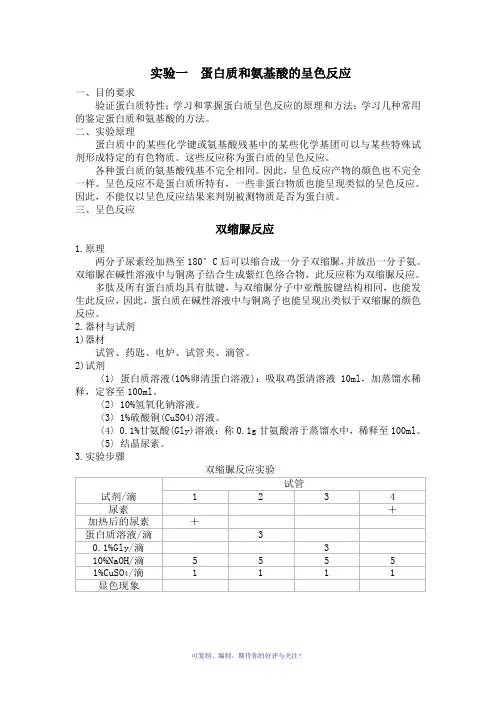
双缩脲反应实验
1234
尿素+
加热后的尿素+
蛋白质溶液/滴3
0.1%Gly/滴3
10%NaOH/滴5555
1%CuSO 4/滴1111
显色现象
试管
试剂/滴
(1)制备双缩脲:取结晶尿素少许(约火柴头大小),放入干燥的小试管中。
微火加热至尿素熔解至硬化,刚硬化时立即停止加热,尿素放出氨,此时双缩脲
即已形成。
冷却后作为双缩脲样品(1号管)。
(2)另取3支试管,与1号管一起按表加样,混匀,观察各管颜色变化,记
录结果并解释现象。
茚三酮反应
1.原理
蛋白质或氨基酸在弱碱性条件下,其上的氨基与茚三酮共热可产生蓝紫色缩
合物。
此反应为一切蛋白质和α-氨基酸所共有,具有亚氨基的脯氨酸和羟脯氨酸与茚三酮反应产生特征性的黄色化合物,含有氨基的其他化合物也能呈此反应。
2.器材与试剂
1)器材
滤纸、试管、试管夹、药匙、电炉、滴管、吸管、水浴锅。
2)试剂
〈1〉卵清蛋白溶液100ml :与双缩脲反应相同。
〈2〉0.1%甘氨酸(Gly)溶液。
〈3〉0.1%茚三酮水溶液。
〈4〉0.1%茚三酮-乙醇溶液:0.1g 茚三酮溶解于乙醇中并用乙醇定容至
100ml 。
3.实验步骤与结果观察
(1)取两支试管,按表加样。
茚三酮反应实验
1
2蛋白质溶液
1.00.1%Gly 1.0
0.1%茚三酮水溶液0.50.5
现象
试剂/ml 试管
沸水浴中加热1-2min,观察颜色由粉色变成紫红色再变蓝 (2)另取一张滤纸,滴一滴0.1%Gly 溶液,风干后,在原处滴一滴0.1%茚三
酮-乙醇溶液,在微火旁烘干显色,观察紫红色斑点的出现。
黄色反应
1.原理
在蛋白质分子中,具有芳香环的氨基酸(如酪氨酸、色氨酸等)残基上的芳香
环经硝酸作用可生成黄色的硝基化合物,后者在碱性条件下可转变为橘黄色的硝醌衍生物。
多数蛋白质分子含有带苯环的氨基酸,所以有黄色反应,苯丙氨酸不易硝化,
需加入少许浓硫酸后才会有黄色反应。
2.器材与试剂
1)器材
同茚三酮反应
2)试剂
〈1〉卵清蛋白溶液100ml :与双缩脲反应相同。
〈2〉10%氢氧化钠溶液。
〈3〉头发。
〈4〉指甲。
〈5〉0.5%苯酚溶液。
〈6〉浓硝酸。
〈7〉0.3%色氨酸(Trp)溶液。
〈8〉0.3%酪氨酸(Tyr)溶液。
3.实验步骤与结果观察
取6支试管,按表加入试剂,观察各管出现的现象,有的试管反应慢,可置
沸水浴加热5min 。
蛋白质的黄色反应实验
123456
材料/滴蛋白质溶液指甲头发0.5%苯酚溶液0.3%色氨酸0.3%酪氨酸
4少许少许444
浓硝酸/滴24040444
现象
试管
试剂 待各管出现黄色后于室温下逐滴加入10%氢氧化钠溶液至碱性,观察颜色变化。
实验结果:
双缩脲反应:
1号管紫红色,2号管浅紫色,3号管蓝紫色,4号管蓝紫色。
因为多肽及所有蛋白质分子均具有肽键,与双缩脲分子中亚酰胺键结构相同,也能发生此反应,因此,蛋白质在碱性溶液中与铜离子也能呈现出类似双缩脲的颜色反应。
茚三酮反应:
观察紫红色斑点
黄色反应:
1号、2号、3号、4号、5号、6号试管都出现黄色。
于室温下逐滴加入10%氢氧化钠溶液至碱性,1号、2号、4号、6号试管变为橘黄色。
3号、5号实验失败,没有出现橘黄色。