4.五章钝化(4次)
- 格式:ppt
- 大小:244.00 KB
- 文档页数:13

第一章腐蚀电化学基础一、概念及简答1.双电层金属浸入电解质溶液内,其表面的原子与溶液中的极性水分子、电解质离子、氧等相互作用,使界面的金属和溶液侧分别形成带有异性电荷的结构——双电层。
2.电极电位电极反应使电极和溶液界面上建立的双电层电位跃。
3.极化、极化曲线及极化图电池工作过程中,由于电流流动而引起电极电位偏离初始值的现象。
用来表示极化电位与极化电流或极化电流密度之间关系的曲线。
将构成腐蚀电池的阴极和阳极极化曲线绘在同一E-I坐标上得到的图线,简称极化图。
4.超电压腐蚀电池工作时,由于极化作用使阴极电位下降,阳极电位升高。
这个值与各极的平衡电位差值的绝对值称为超电压或过电位。
以η表示。
5.钝化金属表面从活性溶解状态变成非常耐蚀的状态的突变现象称为钝化。
6.去极化反应:发生在阴极上的吸收电子的还原反应。
析氢腐蚀其发生的条件析氢腐蚀定义:指溶液中的氢离子作为去极剂,在阴极上进行阴极反应,使金属持续溶解而被腐蚀。
条件:腐蚀电池中的阳极电位必须低于阴极的析氢电极电位。
7. 耗氧腐蚀其发生的条件腐蚀电池上的阴极反应由溶液内氧分子参与完成,称为吸氧或耗氧反应。
耗氧腐蚀的条件为:腐蚀电池中的阳极初始电位EºM必须低于该溶液中氧的平衡电位Ee,O28.金属腐蚀的热力学条件金属溶解的氧化反应若进行,则金属的实际电位必更正于金属的平衡电极电位。
E>Ee,M 去极化反应若进行,则有金属电极电位必更负于去极剂的氧化还原反应电位。
E<Ee,k 上述条件需同时满足。
9.腐蚀速度的工程表示方法重量法和深度法10.耐蚀性评定及其适用范围第二章局部腐蚀一、概念及简答1、应力腐蚀:在固定拉应力和特定介质的共同作用下所引起的破裂。
应力腐蚀产生的条件(特定材料+)固定拉应力+ 特定腐蚀性介质2、腐蚀疲劳:金属材料在循环应力或脉动应力和腐蚀介质的联合作用下,所引起的腐蚀。
(注意与疲劳断裂的区别)条件:变应力+腐蚀性介质3、磨损腐蚀:腐蚀性流体与金属以较高速度做相对运动而引起金属的腐蚀损坏,简称磨蚀。



《材料腐蚀与防护》习题与思考题第一章绪论1.何谓腐蚀?为何提出几种不同的腐蚀定义?2.表示均匀腐蚀速度的方法有哪些?它们之间有何联系?3.镁在海水中的腐蚀速度为 1.45g/m2.d, 问每年腐蚀多厚?若铅以这个速度腐蚀,其ϖ深(mm/a)多大?4.已知铁在介质中的腐蚀电流密度为0.1mA/cm2,求其腐蚀速度ϖ失和ϖ深。
问铁在此介质中是否耐蚀?第二章电化学腐蚀热力学1.如何根据热力学数据判断金属腐蚀的倾向?如何使用电极电势判断金属腐蚀的倾向?2.何谓电势-pH图?举例说明它在腐蚀研究中的用途及其局限性。
3.何谓腐蚀电池?有哪些类型?举例说明可能引起的腐蚀种类。
4.金属化学腐蚀与电化学腐蚀的基本区别是什么?5.a)计算Zn在0.3mol/LZnSO4溶液中的电解电势(相对于SHE)。
b) 将你的答案换成相对于SCE的电势值。
6.当银浸在pH=9的充空气的KCN溶液中,CN-的活度为1.0和Ag(CN)2-的活度为0.001时,银是否会发生析氢腐蚀?7.Zn浸在CuCl2溶液中将发生什么反应?当Zn2+/Cu2+的活度比是多少时此反应将停止?第三章电化学腐蚀反应动力学1.从腐蚀电池出发,分析影响电化学腐蚀速度的主要因素。
2.在活化极化控制下决定腐蚀速度的主要因素是什么?3.浓差极化控制下决定腐蚀速度的主要因素是什么?4.混合电位理论的基本假说是什么?它在哪方面补充、取代或发展了经典微电池腐蚀理论?5.何谓腐蚀极化图?举例说明其应用。
6.试用腐蚀极化图说明电化学腐蚀的几种控制因素以及控制程度的计算方法。
7.何谓腐蚀电势?试用混合电位理论说明氧化剂对腐蚀电位和腐蚀速度的影响。
8.铁电极在pH=4.0的电解液中以0.001A/cm2的电流密度阴极化到电势-0.916V(相对1mol/L甘汞电极)时的氢过电势是多少?9.Cu2+离子从0.2mol/LCuSO4溶液中沉积到Cu电极上的电势为-0.180V(相对1mol/L甘汞电极),计算该电极的极化值。





第5章金属的钝化铁、铝等金属在稀HNO3或稀H2SO4中能很快腐蚀,但是在浓HNO3或浓H2SO4中腐蚀现象几乎完全停止。
1836年斯柯比(Schobein)称金属在浓HNO3或浓H2SO4中获得的耐蚀状态为钝态。
从此,人们对金属的钝化进行了广泛的研究。
现今钝化在控制金属腐蚀和提高金属材料的耐蚀性方面占有十分重要的地位。
经钝化的铁重新放入稀HNO3中也不会再溶解,因为铁处于钝态。
金属或合金受一些因素影响,化学稳定性明显增强的现象,称为金属的钝化(Passivation of metals)。
由某些钝化剂(氧化剂)所引起的金属钝化,称为化学钝化。
如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4和O2等氧化剂都可使金属钝化。
此外,用电化学方法也可使金属钝化,如将铁置于H2SO4溶液中作为阳极,用外加的直流电使铁的电位升高到一定数值(即阳极极化),也能使铁的表面生成钝化膜。
由阳极极化引起的金属钝化现象,叫电化学钝化或阳极钝化。
研究钝化现象有很大的实际意义。
金属处于钝化状态能显著降低金属的自溶解和阳极溶解速度,保护金属防止腐蚀,但有时为了保证金属能正常参与反应而溶解,又必须防止钝化,如化学电源中电极的钝化常常带来有害的后果,使最大输出电流密度以及活性物质的利用率降低。
所以,长期以来,对钝化现象的研究受到很大的重视。
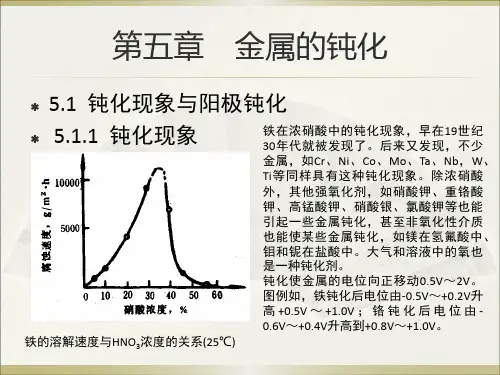
5.1 金属的钝化现象5.1.1 金属钝化的两种方式—化学钝化与电化学钝化1.化学钝化如果把一块铁片放在HNO3中,并考察铁片的溶解速度与HNO3浓度的关系(如图5.1所示),可以发现铁在稀硝酸中剧烈地溶解,并且铁的溶解速度随着HNO3浓度的增大而迅速增大。
当HNO3的浓度增加到30~40%时,铁的腐蚀速度达到最大值,若继续增加HNO3浓度超过40%,则铁的溶解速度就突然下降到原来的的1/4000,这一现象称为钝化。
如果继续增大HNO3浓度到90%以上,腐蚀速度又有较快的上升(在95%HNO3中铁的腐蚀速度约为90%HNO3中的10倍),这一现象称为过钝化。

(每日一练)全国通用版高中化学第五章化工生产中的重要非金属元素知识点总结归纳完整版填空题1、现有1.92g 铜与足量的稀硝酸反应,回答以下问题。
(1)写出反应的离子方程式______。
(2)计算生成标准状况下气体的体积和被还原硝酸的物质的量______。
答案: ;解析:(1)铜和稀硝酸反应,生成硝酸铜、NO 和水,反应的化学方程式为:3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O ,HNO 3和Cu(NO 3)2都是可溶于水的强电解质,可以写成离子,离子方程式为:3Cu+8H ++2=3Cu 2++2NO↑+4H 2O 。
(2)1.92g 铜的物质的量为=0.03mol 。
根据反应的化学方程式可知,消耗3mol 铜生成2molNO ,则消耗0.03molCu 生成0.02molNO ,标准状况下NO 的体积为0.02mol×22.4L/mol=0.448L ;根据反应的化学方程式,当有3molCu 参加反应时,消耗8molHNO 3,其中只有2molHNO 3发生了化合价的变化,即只有2molHNO 3被还原,所以当0.03molCu 参加反应时,被还原的硝酸的物质的量为0.02mol 。
2、二氧化硫是形成酸雨的“罪魁祸首”,为了保护环境,应减少二氧化硫在大气中的排放。
请回答下列问题: (1)二氧化硫与水反应可生成亚硫酸,那么二氧化硫是电解质还是非电解质?__________。
(2)工业尾气中的二氧化硫常用氢氧化钠溶液吸收,生成亚硫酸钠或亚硫酸氢钠: ①亚硫酸钠溶于水的电离方程式是______________________; ②亚硫酸氢钠溶于水的电离方程式是______________________。
2323Cu 8H 2NO 3Cu 2NO 4H O =+-+++↑+0.448L 0.02mol 3NO -1.92g64g /mol(3)二氧化硫在催化剂的作用下可被氧气氧化成三氧化硫,三氧化硫与水反应生成硫酸:①三氧化硫是电解质还是非电解质?__________;②氧气属于电解质或非电解质吗?__________。