腐蚀电化学-金属的钝化
- 格式:ppt
- 大小:807.00 KB
- 文档页数:11





第5章金属的钝化铁、铝等金属在稀HNO3或稀H2SO4中能很快腐蚀,但是在浓HNO3或浓H2SO4中腐蚀现象几乎完全停止。
1836年斯柯比(Schobein)称金属在浓HNO3或浓H2SO4中获得的耐蚀状态为钝态。
从此,人们对金属的钝化进行了广泛的研究。
现今钝化在控制金属腐蚀和提高金属材料的耐蚀性方面占有十分重要的地位。
经钝化的铁重新放入稀HNO3中也不会再溶解,因为铁处于钝态。
金属或合金受一些因素影响,化学稳定性明显增强的现象,称为金属的钝化(Passivation of metals)。
由某些钝化剂(氧化剂)所引起的金属钝化,称为化学钝化。
如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4和O2等氧化剂都可使金属钝化。
此外,用电化学方法也可使金属钝化,如将铁置于H2SO4溶液中作为阳极,用外加的直流电使铁的电位升高到一定数值(即阳极极化),也能使铁的表面生成钝化膜。
由阳极极化引起的金属钝化现象,叫电化学钝化或阳极钝化。
研究钝化现象有很大的实际意义。
金属处于钝化状态能显著降低金属的自溶解和阳极溶解速度,保护金属防止腐蚀,但有时为了保证金属能正常参与反应而溶解,又必须防止钝化,如化学电源中电极的钝化常常带来有害的后果,使最大输出电流密度以及活性物质的利用率降低。
所以,长期以来,对钝化现象的研究受到很大的重视。
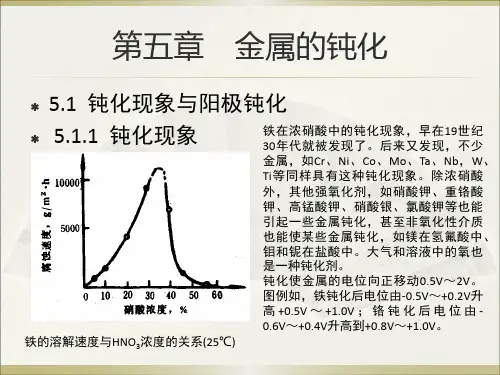
5.1 金属的钝化现象5.1.1 金属钝化的两种方式—化学钝化与电化学钝化1.化学钝化如果把一块铁片放在HNO3中,并考察铁片的溶解速度与HNO3浓度的关系(如图5.1所示),可以发现铁在稀硝酸中剧烈地溶解,并且铁的溶解速度随着HNO3浓度的增大而迅速增大。
当HNO3的浓度增加到30~40%时,铁的腐蚀速度达到最大值,若继续增加HNO3浓度超过40%,则铁的溶解速度就突然下降到原来的的1/4000,这一现象称为钝化。
如果继续增大HNO3浓度到90%以上,腐蚀速度又有较快的上升(在95%HNO3中铁的腐蚀速度约为90%HNO3中的10倍),这一现象称为过钝化。




第二章金属的电化学腐蚀2.5 腐蚀极化图2.6 金属的钝化2.7 塔菲尔关系2.8 能斯特方程一、伊文思(Evans)极化图二、腐蚀电流三、腐蚀控制因素伊文思(Evans)极化图不考虑电位随电流变化细节,将两个电极反应所对应的阴极、阳极极化曲线简化成直线画在一张图上,这种简化了的图称为伊文思极化图伊文思(Evans)极化图↘在一个均相的腐蚀电极上,如果只进行两个电极反应,则金属阳极溶解的电流强度一定等于阴极还原反应的电流强度↘在实验室里,一般用外加电流测定阴、阳极极化曲线来绘制伊文思极化图伊文思(Evans)腐蚀图↘AB阳极极化曲线BC阴极极化曲线OG欧姆电位降CH欧姆、阴极极化总线↘阳极极化率Pa=tgβ阴极极化率Pc=tgα伊文思(Evans )腐蚀图↘考虑欧姆压降,腐蚀电流为I ’,↘阳极极化的电位降:ΔE a = E ’a –E 0a =I ’tgβ= I ’Pa阴极极化的电位降:ΔE c = E ’c –E 0c =I ’tg α= I ’Pc欧姆压降:ΔE r = I ’R腐蚀电池总压降:E 0c -E 0a = I ’(Pa+Pc+ R )腐蚀电流:腐蚀控制因素1)初始电位差与腐蚀电流的关系2)极化率与腐蚀电流的关系3)氢过电位与腐蚀速度的关系阴极析氢过电位:阴极电极材料表面状态不同金属表面上氢过电位不同。
腐蚀控制因素1)虽然锌的氢过电位比较铁的电位负,但由于氢过电位高,锌在还原性酸溶液中的腐蚀速度反而比铁小;2)如果在溶液中加入少量的Pt 盐,由于氢在析出的铂上的过电位比锌、铁都低,所以铁和锌的腐蚀速度都明显增加。
钝化现象1)实际情况中,一些较活泼的金属在某些特定的环境介质中,都具有较好的耐蚀性。
2)Fe在不同浓度的硝酸中的腐蚀w < 30%:硝酸浓度上升,腐蚀速率增加w=30~40%:腐蚀速率最大w > 40%:硝酸浓度上升,腐蚀速率突然急剧降低—钝化w-80%:腐蚀速率又增加,—过钝化钝化现象1)金属或合金在某种条件下,由活化态转为钝态的过程称为钝化。

金属表面钝化膜破坏的原因
钝化膜是一种覆盖在金属表面的保护层,能够防止金属腐蚀和氧化。
然而,有时候这层钝化膜会被破坏,导致金属暴露在空气中,加速了金属的腐蚀和损坏。
下面将详细介绍几种可能导致钝化膜破坏的原因。
1. 化学腐蚀:化学物质对金属表面的腐蚀是钝化膜破坏的主要原因之一。
例如,酸性物质如硫酸、盐酸等可以侵蚀金属表面的钝化膜,使其失去保护功能。
此外,碱性物质如氨水、钠氢氧化物等也能破坏钝化膜的完整性。
2. 机械磨损:金属表面的钝化膜还可能受到机械磨损的影响而破坏。
当金属表面受到磨擦、刮擦、撞击等外力作用时,钝化膜可能会被磨损或剥落,从而暴露出金属表面。
3. 温度变化:温度的变化也可能导致钝化膜破坏。
当金属表面发生温度变化时,钝化膜可能会出现热胀冷缩的现象,从而导致膜层开裂或脱落。
4. 电化学反应:金属表面的钝化膜还可能受到电化学反应的影响而破坏。
例如,金属表面与电解质溶液接触时,可能发生氧化还原反应,导致钝化膜被破坏。
5. 金属离子释放:金属表面的钝化膜还可能受到金属离子的释放而
破坏。
当金属表面存在缺陷或局部腐蚀时,金属离子可能会从钝化膜中释放出来,导致膜层破坏。
总的来说,金属表面钝化膜破坏的原因有很多种,包括化学腐蚀、机械磨损、温度变化、电化学反应和金属离子释放等。
了解这些破坏原因,可以帮助我们更好地保护金属表面,延长其使用寿命。
金属钝化原理
金属钝化是一种通过化学方法将金属表面形成一层保护膜,以防止金属腐蚀的
技术。
金属钝化的原理主要是利用金属表面形成一层致密的氧化物或者其他化合物膜,从而隔绝金属与外界环境的直接接触,达到防止金属腐蚀的目的。
金属钝化技术在工业生产和日常生活中有着广泛的应用,下面将详细介绍金属钝化的原理及其应用。
金属钝化的原理主要有以下几种:
1. 阻隔原理,金属表面形成一层致密的氧化膜或者其他化合物膜,使得金属与
外界环境隔绝开来,防止金属腐蚀的发生。
2. 电化学原理,金属表面形成一层电化学稳定的膜,使得金属处于一个稳定的
电化学状态,从而减少金属的电化学腐蚀。
3. 吸附原理,金属表面形成一层吸附膜,可以吸附一些有害物质,防止其对金
属的腐蚀。
金属钝化技术的应用范围非常广泛,主要包括以下几个方面:
1. 金属腐蚀防护,金属钝化技术可以有效防止金属在潮湿、酸碱环境中的腐蚀,延长金属的使用寿命。
2. 电化学工业,金属钝化技术在电镀、电解等电化学工艺中有着重要的应用,
可以提高金属的耐蚀性和导电性能。
3. 冶金工业,金属钝化技术在冶金工业中可以用于金属的保护和表面处理,提
高金属的耐磨性和耐蚀性。
4. 化工工业,金属钝化技术在化工工业中可以用于管道、容器等设备的防腐蚀
处理,保证设备的安全运行。
5. 日常生活,金属钝化技术在日常生活中也有着广泛的应用,比如厨具、家具等金属制品的防腐蚀处理。
总之,金属钝化技术是一种非常重要的防腐蚀技术,可以有效延长金属的使用寿命,保护设备的安全运行。
随着科学技术的不断发展,金属钝化技术也在不断创新和完善,将会有更广泛的应用前景。
关于金属的钝化知识概论电化学腐蚀动力学的一般规律表明,当金属按照正常的阳极反应历程溶解时,则电极电位愈正,金属的溶解速度也愈大。
镍和铁在盐酸中进行阳极极化时即如此。
但是在许多情况下,也可看到与此相反的结果。
如金属的电极电位因外加阳极电流或局部阳极电流而向正方向移动,当超过一定数值后,金属的溶解速度反而剧烈地减小了。
铁和不锈钢在硫酸中进行阳极极化时便台观察到此现象。
金属阳极溶解过程中的这种“反常”现象称为金属的钝化过程。
如果把一铁片放在稀硝酸中,定会剧烈地溶解,且铁的溶解速度随硝酸浓度的增加而迅速增大,当硝酸浓度增加到30-40%时,溶解度达到最大值,若继续增大硝酸的浓度(>40%),铁的溶解度却突然成万倍下降,并使表面处理一种特殊的状态。
这时即使把它转移到硫酸中去,也不会再受到酸的浸蚀,因为金属已发生了钝化。
除硝酸外,倘若介质中含有强氧化性的氯酸、氯酸钾、重铬酸钾、高锰酸钾和氧这类化合物,都能使金属产生钝化。
它们统称为钝化剂,不过钝化的发生并不单纯地取决于钝化剂氧化性的强弱。
例如,过氧化氢或高锰酸钾的氧化还原电位比重铬酸钾的氧化还原电位要正,按理说它们的是更强的氧化剂,但是实际上它们对铁的钝化作用动比重铬酸盐差。
过硫酸盐的氧化还原电位比重铬酸盐更正些,可是它反而不能使铁钝化。
显然,这是阴离子的牲对钝化过程的影响有关。
钝化现象的发生虽然通常和氧化性介质的作用有关,但有些金属却可在非氧化性介质中发生钝化。
例如镁可在氢氟酸中钝化,钼和铌可在盐酸中钝化,汞和银在氯离子的作用下却能钝化。
综上所述,钝化现象若是因金属与钝化剂的自然作用而产生则称之为“化学钝化”或“自动钝化”。
铬、铝、钛等金属在空气中和很多种含氧的溶液中都易于被氧所钝化,故被称之为“自钝化金属”。
实验结果表明,在不含有活性氯离子的电解质溶液中,金属的钝化也可以由阳极极化而引起,例如18-8型不锈钢在30%的硫酸中会剧烈溶解,但倘若外加电流使其阳极极化,当极化至-0.1V(SCE)之后,不锈钢的溶解速度将迅速下降到原来的数万分之一。